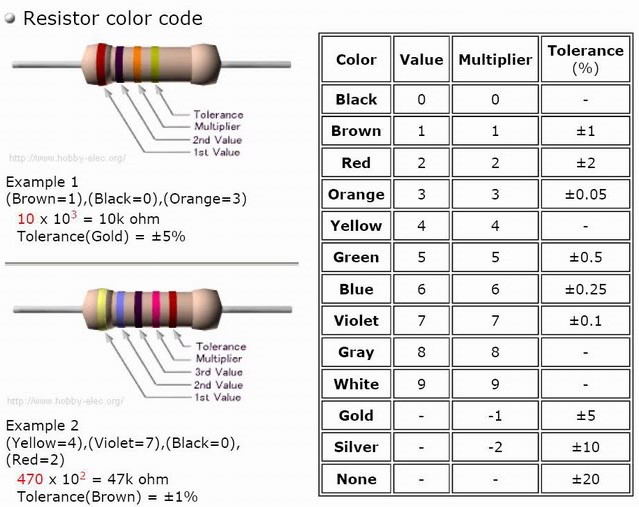
Chủ đề phân cực là gì hóa học: Phân cực trong hóa học là một khái niệm quan trọng, liên quan đến sự phân bố điện tích trong phân tử. Bài viết này sẽ giúp bạn hiểu rõ phân cực là gì, phân biệt giữa phân tử phân cực và không phân cực, cùng với những ứng dụng thực tiễn của chúng trong đời sống và công nghệ.
Mục lục
Khái Niệm Phân Cực Trong Hóa Học
Trong hóa học, phân cực là hiện tượng mà các liên kết hóa học trong một phân tử có sự phân bố không đồng đều của điện tích, dẫn đến một đầu của phân tử mang điện tích âm, và đầu kia mang điện tích dương. Sự phân cực này thường xuất hiện trong các phân tử có các nguyên tử có độ âm điện khác nhau, làm cho cặp electron dùng chung bị kéo về phía nguyên tử có độ âm điện cao hơn.
Liên Kết Cộng Hóa Trị Phân Cực
Liên kết cộng hóa trị phân cực xảy ra khi hai nguyên tử trong một phân tử có độ âm điện khác nhau đáng kể. Khi đó, cặp electron dùng chung sẽ bị lệch về phía nguyên tử có độ âm điện lớn hơn, tạo ra một mômen lưỡng cực. Mômen lưỡng cực (\(\mu\)) được tính bằng công thức:
\[
\mu = Q \times r
\]
Trong đó:
- Q: Độ lớn của điện tích.
- r: Khoảng cách giữa hai tâm điện tích.
Mômen Lưỡng Cực và Sự Phân Cực Của Phân Tử
Mômen lưỡng cực là một đại lượng vector có hướng từ điện tích dương đến điện tích âm trong phân tử. Đối với các phân tử đối xứng như CO2, dù có chứa liên kết phân cực, nhưng tổng mômen lưỡng cực bằng 0 do sự đối xứng, dẫn đến phân tử không phân cực.
Ví Dụ Về Phân Tử Phân Cực
- H2O: Phân tử nước có hình dạng góc, với oxy có độ âm điện cao hơn hydro, tạo ra một mômen lưỡng cực mạnh.
- HCl: Hydro chloride là một phân tử phân cực với liên kết cộng hóa trị phân cực giữa hydro và clo.
Phân Tử Không Phân Cực
Phân tử không phân cực là những phân tử mà mômen lưỡng cực tổng bằng 0 do sự đối xứng của phân tử, hoặc các liên kết trong phân tử không phân cực. Ví dụ, các phân tử như N2 và O2 là không phân cực vì chúng có sự phân bố điện tích đồng đều.

.png)
1. Giới Thiệu Về Phân Cực Trong Hóa Học
Phân cực trong hóa học là hiện tượng xảy ra khi các phân tử hoặc nguyên tử có sự chênh lệch về độ âm điện, dẫn đến việc tạo ra hai cực điện tích khác nhau. Điều này xuất phát từ sự phân bố không đều của điện tích trong liên kết hóa học. Các liên kết phân cực là kết quả của sự không đối xứng trong sự phân chia các cặp electron giữa các nguyên tử.
Liên kết hóa học có thể được chia thành hai loại chính: liên kết cộng hóa trị phân cực và liên kết cộng hóa trị không phân cực. Trong liên kết phân cực, một nguyên tử có độ âm điện cao hơn sẽ hút các electron mạnh hơn, tạo nên sự không cân bằng về điện tích. Điều này dẫn đến việc tạo ra các cực điện tích, với một đầu phân tử mang điện tích dương và đầu còn lại mang điện tích âm.
- Định nghĩa: Liên kết phân cực là sự phân bố không đều của cặp electron trong liên kết, dẫn đến tạo ra các cực điện tích dương và âm.
- Liên kết cộng hóa trị phân cực: Xảy ra khi hai nguyên tử trong liên kết có sự chênh lệch đáng kể về độ âm điện.
- Phân tử phân cực: Là phân tử có sự chênh lệch về điện tích giữa các đầu, ví dụ như phân tử nước \( \left( H_2O \right) \).
Các phân tử phân cực có xu hướng tạo ra các tương tác mạnh mẽ với các phân tử khác và ảnh hưởng đến nhiều tính chất vật lý và hóa học như điểm sôi, độ hòa tan và tính dẫn điện. Hiểu rõ về sự phân cực trong hóa học giúp giải thích các hiện tượng như sự hòa tan của các chất, sự tương tác giữa các phân tử trong dung dịch, và sự hình thành các liên kết ion.
2. Phân Biệt Phân Cực Và Không Phân Cực
Trong hóa học, phân tử được phân loại thành phân cực và không phân cực dựa trên sự phân bố của các electron trong liên kết hóa học và hình học phân tử.
- Phân tử phân cực: Xảy ra khi có sự chênh lệch độ âm điện giữa các nguyên tử trong phân tử, khiến các electron bị hút về phía nguyên tử có độ âm điện cao hơn. Điều này tạo ra một cực âm và một cực dương trong phân tử. Ví dụ, phân tử \( \text{H}_2\text{O} \) là phân cực do các liên kết \( \text{O-H} \) có độ âm điện chênh lệch lớn, tạo ra momen lưỡng cực \( (\mu > 0) \).
- Phân tử không phân cực: Khi các nguyên tử trong phân tử có độ âm điện tương đương nhau, hoặc cấu trúc phân tử đối xứng khiến các momen lưỡng cực triệt tiêu lẫn nhau. Ví dụ, phân tử \( \text{CO}_2 \) có cấu trúc thẳng, nên các momen lưỡng cực \( (\mu = 0) \) bị triệt tiêu.
Momen lưỡng cực (\( \mu \)) là đại lượng quan trọng để đánh giá mức độ phân cực của phân tử. Công thức tính mômen lưỡng cực:
Trong đó:
- \( q \) là độ lớn của điện tích
- \( d \) là khoảng cách giữa hai điện tích
Các phân tử có hình dạng đối xứng cao thường không có momen lưỡng cực dù các liên kết trong chúng có cực.

3. Ứng Dụng Của Phân Cực Trong Đời Sống
Phân cực là một hiện tượng có nhiều ứng dụng quan trọng trong cuộc sống hàng ngày và khoa học. Các ứng dụng phổ biến bao gồm:
- Ứng dụng trong công nghệ màn hình: Các màn hình LCD và kính râm phân cực sử dụng nguyên lý phân cực để giảm độ chói và tạo ra hình ảnh rõ nét hơn.
- Ứng dụng trong hóa học phân tích: Phân cực giúp xác định cấu trúc và tính chất của các phân tử trong hóa học, đặc biệt là trong các phép phân tích phổ và xác định cấu trúc phân tử.
- Ứng dụng trong vật lý quang học: Hiện tượng phân cực được sử dụng để chế tạo các bộ lọc quang học, giúp điều khiển hướng và cường độ ánh sáng.
- Ứng dụng trong truyền thông không dây: Sóng điện từ phân cực được sử dụng trong các hệ thống truyền thông không dây để tối ưu hóa tín hiệu và giảm nhiễu.
- Ứng dụng trong nhiếp ảnh: Các bộ lọc phân cực được sử dụng để loại bỏ ánh sáng phản chiếu, giúp tạo ra những bức ảnh sắc nét hơn, đặc biệt khi chụp ngoài trời.
Hiểu biết về hiện tượng phân cực mang lại nhiều lợi ích trong việc nghiên cứu và phát triển các công nghệ mới, cải thiện chất lượng cuộc sống.

4. Ảnh Hưởng Của Phân Cực Đến Sự Hòa Tan
Phân cực của phân tử đóng vai trò quan trọng trong việc xác định khả năng hòa tan của chất trong các dung môi khác nhau. Quy tắc chung là "chất phân cực hòa tan trong dung môi phân cực" và "chất không phân cực hòa tan trong dung môi không phân cực".
Đối với dung môi phân cực như nước, do cấu trúc phân tử có liên kết hydro mạnh mẽ giữa các nguyên tử hydrogen và oxygen, nước có khả năng hòa tan tốt các chất phân cực như muối (NaCl) và đường (C₆H₁₂O₆). Khi chất phân cực tan trong nước, các ion hoặc phân tử của chúng bị hút về phía các cực tương ứng của phân tử nước, dẫn đến quá trình hòa tan.
Ngược lại, các dung môi không phân cực như hexan chủ yếu hòa tan các chất không phân cực do không có lực hút giữa các phần tử phân cực. Ví dụ, dầu mỏ có thể hòa tan trong hexan, nhưng không hòa tan trong nước vì sự khác biệt về phân cực.
Trong thực tế, phân cực ảnh hưởng rất nhiều đến việc lựa chọn dung môi trong các ngành công nghiệp như dược phẩm, hóa chất và thực phẩm. Việc hiểu rõ về phân cực giúp chúng ta tối ưu hóa quá trình hòa tan, chiết tách và tách chất trong các hỗn hợp phức tạp.

5. Các Bài Tập Liên Quan Đến Phân Cực
Dưới đây là một số bài tập điển hình về phân cực giúp bạn củng cố kiến thức:
- Cho các phân tử \( \text{H}_2\text{O} \), \( \text{CO}_2 \), \( \text{CH}_4 \), \( \text{NH}_3 \). Xác định phân tử nào là phân cực và giải thích lý do.
- Mô tả cách phân cực ảnh hưởng đến khả năng hòa tan của các chất khi hòa tan trong dung môi phân cực và không phân cực.
- Xét liên kết giữa hai nguyên tử có độ âm điện khác nhau. Dự đoán loại liên kết và mức độ phân cực của liên kết đó.
- So sánh độ phân cực của các liên kết \( \text{H-Cl} \), \( \text{H-F} \), \( \text{H-Br} \). Giải thích sự khác biệt về độ phân cực dựa trên độ âm điện của các nguyên tố.
- Vẽ và phân tích dạng hình học của các phân tử \( \text{H}_2\text{O} \), \( \text{CO}_2 \), \( \text{BF}_3 \). Giải thích tại sao một số phân tử có hình dạng đối xứng nhưng không phân cực.
Các bài tập này không chỉ giúp bạn rèn luyện kỹ năng phân tích, mà còn nắm bắt được bản chất của các liên kết hóa học và sự phân cực trong các hợp chất. Thực hành thường xuyên là cách tốt nhất để hiểu rõ hơn về chủ đề này.