Chủ đề o3 có phân cực không: O3 có phân cực không? Đây là một câu hỏi thú vị trong hóa học. Phân tử O3 hay ozon, với cấu trúc gồm ba nguyên tử oxy, có nhiều tính chất đặc biệt. Trong bài viết này, chúng ta sẽ khám phá cấu tạo, tính chất hóa học và phân cực của ozon để hiểu rõ hơn về loại phân tử này.
Mục lục
- Thông Tin Chi Tiết Về Ozone (O3) Và Tính Phân Cực
- 1. Giới Thiệu Về Ozone (O3)
- 2. Tính Chất Hóa Học Của Ozone
- 3. Ứng Dụng Của Ozone Trong Đời Sống Và Công Nghiệp
- 4. Tác Động Của Ozone Đến Môi Trường Và Sức Khỏe
- 5. Các Phương Pháp Nghiên Cứu Tính Phân Cực Của Ozone
- 6. Bài Tập Về Ozone Và Tính Phân Cực (Có Lời Giải)
- Bài Tập 1: Xác Định Tính Phân Cực Của Các Phân Tử Liên Quan
- Bài Tập 2: So Sánh Độ Phân Cực Của O3 Với Các Phân Tử Khác
- Bài Tập 3: Phân Tích Cấu Trúc Cộng Hưởng Của Ozone
- Bài Tập 4: Tính Năng Lượng Liên Kết Trong Phân Tử Ozone
- Bài Tập 5: Tính Toán Độ Phân Cực Sử Dụng Phương Pháp Lý Thuyết
- Bài Tập 6: Đánh Giá Tác Động Của Ozone Đến Sức Khỏe
- Bài Tập 7: Xác Định Ứng Dụng Của Ozone Trong Công Nghiệp
- Bài Tập 8: Nghiên Cứu Biện Pháp Giảm Thiểu Ô Nhiễm Ozone
- Bài Tập 9: Thực Hành Xác Định Độ Phân Cực Qua Thí Nghiệm
- Bài Tập 10: Tính Toán Và Mô Phỏng Sự Phân Cực Của Ozone
Thông Tin Chi Tiết Về Ozone (O3) Và Tính Phân Cực
Ozone (\(O_3\)) là một phân tử hóa học quan trọng trong bầu khí quyển, đặc biệt trong tầng bình lưu, nơi nó đóng vai trò bảo vệ Trái Đất khỏi tia cực tím có hại từ Mặt Trời. Phân tử này có những đặc điểm cấu trúc và tính chất hóa học độc đáo, đặc biệt là tính phân cực và cấu trúc cộng hưởng.
Cấu Trúc Phân Tử Ozone
Ozone là một phân tử bao gồm ba nguyên tử oxy. Trong phân tử \(O_3\), các nguyên tử oxy không liên kết trực tiếp với nhau bằng các liên kết đơn hay đôi thông thường, mà có cấu trúc cộng hưởng. Điều này có nghĩa là các liên kết trong phân tử có sự phân bố electron đồng đều giữa các nguyên tử oxy, tạo ra một trạng thái trung gian với độ dài và năng lượng liên kết giữa liên kết đơn và liên kết đôi.
- Cấu trúc phân tử: hình dạng chữ V hoặc tam giác.
- Góc liên kết: khoảng 117 độ.
- Chiều dài liên kết \(O-O\): khoảng 1.28 Å.
Cấu trúc cộng hưởng giúp phân tử \(O_3\) ổn định hơn và có năng lượng thấp hơn so với nếu các liên kết đều là liên kết đơn hoặc đôi. Điều này dẫn đến việc phân tử ozone có tính phân cực do sự không đồng đều trong phân bố điện tích trên các nguyên tử oxy.
Tính Phân Cực Của Ozone
Phân tử ozone có tính phân cực, nghĩa là có sự phân bố không đồng đều của mật độ electron, dẫn đến sự hình thành của một điện tích dương nhỏ tại trung tâm và điện tích âm nhỏ ở các đầu của phân tử. Điều này làm cho ozone có khả năng tương tác mạnh với các phân tử khác, đặc biệt là các chất có liên kết đôi, dẫn đến các phản ứng hóa học quan trọng trong khí quyển.
Tính Chất Hóa Học Và Ứng Dụng
Ozone là một chất oxy hóa mạnh với nhiều tính chất hóa học độc đáo, bao gồm khả năng oxy hóa các kim loại và phi kim, phản ứng với các hợp chất hữu cơ và khả năng tự phân hủy thành \(O_2\) và một nguyên tử oxy tự do:
Các phản ứng này làm cho ozone có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Xử lý nước: Ozone được sử dụng để khử trùng nước uống, loại bỏ vi khuẩn, virus và các chất gây ô nhiễm.
- Khử trùng không khí: Ozone được dùng để làm sạch không khí, loại bỏ mùi hôi và các chất độc hại.
- Ứng dụng trong công nghiệp: Ozone được sử dụng trong ngành công nghiệp thực phẩm và xử lý nước để tiệt trùng và bảo quản.
Biện Pháp Bảo Vệ Và Phục Hồi Tầng Ozone
Tầng ozone đóng vai trò quan trọng trong việc bảo vệ sự sống trên Trái Đất bằng cách hấp thụ phần lớn tia cực tím có hại từ Mặt Trời. Tuy nhiên, hoạt động của con người đã làm suy giảm tầng ozone, do đó, cần có những biện pháp để bảo vệ và phục hồi tầng ozone:
- Hạn chế sử dụng các sản phẩm chứa HCFCs và các hợp chất có hại khác.
- Sử dụng phương tiện công cộng và giảm phát thải.
- Quản lý chất thải và giảm thiểu sử dụng hóa chất gây hại.
Như vậy, hiểu rõ về tính chất và vai trò của ozone không chỉ giúp chúng ta bảo vệ sức khỏe mà còn góp phần bảo vệ môi trường và tầng ozone quý giá của Trái Đất.
 3) Và Tính Phân Cực" style="object-fit:cover; margin-right: 20px;" width="760px" height="1013">
3) Và Tính Phân Cực" style="object-fit:cover; margin-right: 20px;" width="760px" height="1013">.png)
1. Giới Thiệu Về Ozone (O3)
Ozone (O3) là một dạng thù hình của oxy, bao gồm ba nguyên tử oxy liên kết với nhau. Phân tử O3 được phát hiện lần đầu tiên vào thế kỷ 19 và có vai trò quan trọng trong cả hóa học và môi trường. Nó tồn tại trong tự nhiên chủ yếu ở tầng bình lưu, nơi nó tạo thành một lớp bảo vệ quan trọng ngăn chặn các tia cực tím (UV) có hại từ Mặt trời.
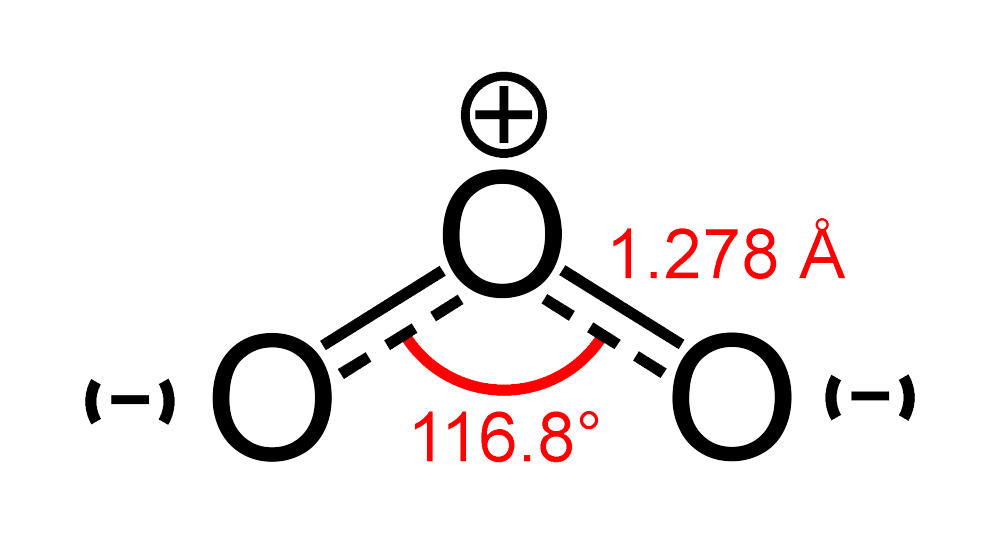
Về cấu trúc, phân tử ozone có hình dạng góc với góc liên kết khoảng 116,8 độ và độ dài liên kết giữa hai nguyên tử oxy là 1,278 Å. Do có cấu trúc không đối xứng và momen lưỡng cực (μ = 0,52 D), phân tử O3 có tính phân cực, khiến nó có khả năng tương tác với nhiều chất hóa học khác.
- Đặc điểm cấu tạo: Phân tử O3 có cấu trúc góc với một liên kết đôi và một liên kết đơn giữa các nguyên tử oxy, tạo ra một cấu trúc cộng hưởng ổn định.
- Tính chất hóa học: Ozone là một chất oxy hóa mạnh, mạnh hơn oxy phân tử (O2). Nó có khả năng oxy hóa nhiều chất khác nhau, từ các hợp chất hữu cơ đến kim loại.
- Vai trò trong môi trường: Ở tầng bình lưu, ozone đóng vai trò là lá chắn bảo vệ Trái đất khỏi các bức xạ UV. Tuy nhiên, ở tầng đối lưu gần mặt đất, ozone là một thành phần của khói bụi và có thể gây hại cho sức khỏe con người.
- Ứng dụng: Ozone được sử dụng trong các quy trình khử trùng nước, làm sạch không khí và khử mùi trong công nghiệp. Ngoài ra, nó cũng được sử dụng trong các quy trình hóa học để tạo ra các chất khác.
Nhờ vào cấu trúc đặc biệt và tính chất hóa học, ozone có vai trò quan trọng trong nhiều lĩnh vực khoa học và công nghệ. Hiểu rõ về phân tử này giúp chúng ta áp dụng hiệu quả và bảo vệ môi trường một cách bền vững.
2. Tính Chất Hóa Học Của Ozone
Ozone (\(O_3\)) là một chất khí có tính chất hóa học đặc biệt, khác biệt so với nhiều khí khác trong bầu khí quyển. Ozone có cấu trúc phân tử hình tam giác không đều với góc liên kết khoảng \(116.8^\circ\), tạo nên sự phân cực trong phân tử. Điều này làm cho ozone có khả năng phản ứng mạnh mẽ trong các phản ứng hóa học.
- Tính oxy hóa mạnh: Ozone là một chất oxy hóa rất mạnh, mạnh hơn cả oxy phân tử (\(O_2\)). Khả năng oxy hóa này cho phép ozone tham gia vào các phản ứng hóa học phức tạp, đặc biệt là trong việc khử trùng và làm sạch nước và không khí.
- Phản ứng với kim loại: Ozone có thể phản ứng với một số kim loại như sắt, đồng, và bạc, tạo ra oxit kim loại. Ví dụ, phản ứng giữa ozone và sắt có thể được biểu diễn bằng phương trình hóa học sau: \[ 2Fe + 3O_3 \rightarrow 2Fe_2O_3 \]
- Phản ứng với hợp chất hữu cơ: Ozone có khả năng phản ứng với các hợp chất hữu cơ không bão hòa như anken, ankin, dẫn đến sự phân hủy hoặc oxy hóa các hợp chất này. Ví dụ, phản ứng giữa ozone và etylen (\(C_2H_4\)) có thể diễn ra như sau: \[ C_2H_4 + O_3 \rightarrow C_2H_4O_3 \]
- Phản ứng với oxit nitơ: Ozone phản ứng với các oxit nitơ (\(NO\) và \(NO_2\)), tham gia vào chu trình phá hủy ozone trong tầng bình lưu cũng như góp phần tạo ra sương mù quang hóa trong tầng đối lưu. Phản ứng với nitơ monoxide (\(NO\)) có thể được viết như sau: \[ O_3 + NO \rightarrow O_2 + NO_2 \]
Với những tính chất hóa học này, ozone có nhiều ứng dụng quan trọng trong đời sống hàng ngày cũng như trong công nghiệp và y tế. Tuy nhiên, việc sử dụng ozone cần phải được kiểm soát cẩn thận để tránh những tác động tiêu cực đến sức khỏe con người và môi trường.

3. Ứng Dụng Của Ozone Trong Đời Sống Và Công Nghiệp
Ozone (O3) là một dạng thù hình của oxy, được sử dụng rộng rãi trong đời sống và công nghiệp nhờ tính chất oxy hóa mạnh và khả năng khử trùng hiệu quả. Dưới đây là một số ứng dụng quan trọng của ozone trong các lĩnh vực khác nhau:
- Khử trùng và khử mùi: Ozone được sử dụng trong các hệ thống xử lý nước để tiêu diệt vi khuẩn, virus và các vi sinh vật có hại khác. Ngoài ra, ozone còn được sử dụng để khử mùi trong các nhà máy xử lý nước thải, cơ sở chế biến thực phẩm và các tòa nhà công cộng.
- Chế biến thực phẩm: Ozone được áp dụng trong quá trình xử lý bề mặt của rau quả và thực phẩm để kéo dài thời gian bảo quản bằng cách tiêu diệt vi khuẩn và nấm mốc mà không để lại hóa chất độc hại. Điều này giúp duy trì chất lượng và sự tươi mới của thực phẩm lâu hơn.
- Ngành công nghiệp giấy và bột giấy: Ozone được sử dụng trong quá trình tẩy trắng bột giấy, giúp giảm lượng sử dụng các hóa chất có hại như chlorine. Quá trình này không chỉ an toàn cho môi trường mà còn giúp cải thiện chất lượng sản phẩm.
- Xử lý không khí: Trong các hệ thống điều hòa không khí và thông gió, ozone được sử dụng để khử trùng không khí, loại bỏ các chất gây dị ứng và cải thiện chất lượng không khí trong nhà. Ozone có thể phân hủy các hợp chất hữu cơ bay hơi (VOC) và các chất gây ô nhiễm khác, giúp giảm thiểu các nguy cơ về sức khỏe liên quan đến không khí ô nhiễm.
- Ngành dệt may: Ozone được sử dụng trong quá trình xử lý vải và quần áo để tẩy màu và khử mùi. Điều này không chỉ giúp giảm thiểu sự sử dụng nước và hóa chất, mà còn cải thiện tính bền vững của quá trình sản xuất.
- Y tế và chăm sóc sức khỏe: Ozone cũng được sử dụng trong y tế để tiệt trùng các dụng cụ phẫu thuật và khử trùng phòng mổ, nhờ vào khả năng tiêu diệt các vi khuẩn và virus mà không gây hại cho sức khỏe con người.
Nhờ vào những tính chất đặc biệt như khả năng oxy hóa mạnh, ozone đóng vai trò quan trọng trong việc bảo vệ sức khỏe con người và môi trường, đồng thời nâng cao hiệu quả trong nhiều ngành công nghiệp. Các ứng dụng của ozone đang ngày càng được mở rộng và phát triển, góp phần vào sự tiến bộ của xã hội.

4. Tác Động Của Ozone Đến Môi Trường Và Sức Khỏe
Ozone (O3) là một chất khí có khả năng oxy hóa mạnh mẽ, tồn tại chủ yếu ở hai tầng khí quyển: tầng bình lưu và tầng đối lưu. Tùy vào vị trí tồn tại mà ozone có thể mang lại cả lợi ích và tác hại đến môi trường và sức khỏe con người.
Tác Động Đến Môi Trường
- Sương mù quang hóa: Ozone ở tầng đối lưu góp phần tạo ra sương mù quang hóa, một dạng ô nhiễm không khí phổ biến ở các đô thị lớn. Sương mù này không chỉ ảnh hưởng đến chất lượng không khí mà còn làm giảm khả năng quang hợp của thực vật, ảnh hưởng tiêu cực đến hệ sinh thái.
- Ảnh hưởng đến cây trồng và thực vật: Ozone có thể gây hại cho lá cây, làm giảm năng suất và chất lượng của nông sản. Điều này không chỉ tác động đến chuỗi thức ăn tự nhiên mà còn ảnh hưởng đến kinh tế nông nghiệp và đa dạng sinh học.
- Phản ứng hóa học trong bầu khí quyển: Ozone tương tác với các chất ô nhiễm khác, tạo ra các phản ứng hóa học phức tạp trong không khí, góp phần hình thành các chất ô nhiễm mới và tăng cường mức độ ô nhiễm không khí.
Tác Động Đến Sức Khỏe Con Người
- Hệ hô hấp: Tiếp xúc với ozone ở nồng độ cao có thể gây tổn thương các tế bào biểu mô của đường hô hấp, dẫn đến các triệu chứng như ho, viêm họng, và khó thở. Đặc biệt, những người mắc bệnh hô hấp mãn tính như hen suyễn hoặc viêm phế quản có nguy cơ gặp phải các biến chứng nặng hơn.
- Sức khỏe tim mạch: Nghiên cứu cho thấy ozone có thể làm tăng nguy cơ tử vong do các bệnh tim mạch, đặc biệt khi tiếp xúc lâu dài với nồng độ ozone cao.
- Nhóm người nhạy cảm: Trẻ em, người già, và những người có bệnh nền là các nhóm dễ bị ảnh hưởng bởi ozone nhất. Việc sống trong môi trường có nồng độ ozone cao có thể dẫn đến tình trạng sức khỏe xấu đi nhanh chóng đối với các nhóm này.
Các Biện Pháp Giảm Thiểu Tác Động
Để giảm thiểu tác hại của ozone đối với sức khỏe và môi trường, cần có các biện pháp như:
- Hạn chế tiếp xúc với ozone trong các ngày nắng nóng và mức độ ô nhiễm cao bằng cách ở trong nhà hoặc sử dụng khẩu trang bảo vệ.
- Phát triển các biện pháp giảm thiểu khí thải từ các phương tiện giao thông và các hoạt động công nghiệp, góp phần giảm nồng độ ozone ở tầng đối lưu.
- Tăng cường ý thức cộng đồng về bảo vệ môi trường, bao gồm việc giảm sử dụng các sản phẩm gây ô nhiễm và tăng cường trồng cây xanh để cân bằng khí quyển.
Như vậy, mặc dù ozone có thể gây ra nhiều tác động tiêu cực đến sức khỏe và môi trường, nhưng với các biện pháp kiểm soát và ý thức bảo vệ, chúng ta có thể giảm thiểu được các tác động này và bảo vệ sức khỏe cộng đồng cũng như môi trường sống.

5. Các Phương Pháp Nghiên Cứu Tính Phân Cực Của Ozone
Tính phân cực của ozone (O3) là một chủ đề quan trọng trong hóa học, liên quan đến cách mà các phân tử này phân bố điện tích và tương tác với môi trường xung quanh. Để nghiên cứu tính phân cực của ozone, có một số phương pháp khoa học được sử dụng rộng rãi. Dưới đây là các bước nghiên cứu chi tiết:
- Đo lường mômen lưỡng cực:
Một trong những cách phổ biến để xác định tính phân cực của ozone là đo lường mômen lưỡng cực. Mômen lưỡng cực (\(\mu\)) của một phân tử là tích của độ lớn điện tích và khoảng cách giữa các điện tích này. Đối với ozone, mômen lưỡng cực được xác định thông qua các phương pháp thực nghiệm hoặc tính toán lý thuyết, cho phép chúng ta hiểu rõ hơn về cách mà phân tử ozone tương tác với điện trường.
- \(\mu = q \times d\)
- Trong đó \(\mu\) là mômen lưỡng cực, \(q\) là độ lớn của điện tích, và \(d\) là khoảng cách giữa các điện tích.
- Sử dụng phổ hồng ngoại (IR Spectroscopy):
Phương pháp phổ hồng ngoại giúp xác định các dao động phân tử có liên quan đến tính phân cực của ozone. Bằng cách phân tích các dải hấp thụ trong phổ hồng ngoại, ta có thể xác định các dao động lưỡng cực của phân tử ozone, từ đó suy ra tính phân cực của nó.
- Mô phỏng và tính toán hóa học lượng tử:
Phương pháp này sử dụng các phần mềm tính toán để mô phỏng sự phân bố electron trong phân tử ozone. Các phần mềm này dựa trên các lý thuyết lượng tử như lý thuyết chức năng mật độ (DFT) để mô phỏng và tính toán mômen lưỡng cực cũng như các đặc tính điện tử khác. Kết quả từ các mô phỏng này cung cấp thông tin chi tiết về tính phân cực của ozone mà các phương pháp thực nghiệm có thể không dễ dàng đạt được.
- Xác định độ âm điện của nguyên tử oxy:
Tính phân cực của phân tử ozone cũng có thể được nghiên cứu thông qua sự khác biệt về độ âm điện giữa các nguyên tử oxy. Độ âm điện càng cao, xu hướng thu hút electron càng lớn, dẫn đến sự phân bố không đồng đều của mật độ electron trong phân tử ozone, từ đó tạo nên tính phân cực.
- Phân tích mô hình điện từ trường:
Ozone có thể được nghiên cứu bằng cách sử dụng các mô hình điện từ trường để hiểu cách nó tương tác với các phân tử khác trong môi trường. Phương pháp này giúp xác định các tương tác phân tử và cấu trúc phân tử chi tiết hơn, từ đó xác định tính phân cực của ozone.
Các phương pháp trên giúp chúng ta hiểu rõ hơn về tính phân cực của ozone và vai trò của nó trong các phản ứng hóa học, đặc biệt là trong khí quyển và môi trường xung quanh chúng ta.
XEM THÊM:
6. Bài Tập Về Ozone Và Tính Phân Cực (Có Lời Giải)
Ozone (O\(_3\)) là một phân tử quan trọng trong hóa học khí quyển và có những tính chất hóa học thú vị. Dưới đây là một số bài tập về tính phân cực của ozone và các giải thích chi tiết.
- Bài Tập 1: Xác định xem O\(_3\) có phải là phân tử phân cực không và giải thích lý do tại sao.
Lời Giải:
- Cấu trúc hình học của O\(_3\) là hình chữ V (bent) với một góc liên kết khoảng 117 độ. Điều này là do sự có mặt của một cặp electron đơn lẻ trên nguyên tử oxy trung tâm.
- Các liên kết trong phân tử O\(_3\) là liên kết cộng hóa trị đôi, không có sự phân bố không đều của electron giữa các nguyên tử oxy. Điều này có nghĩa là không có một cực dương hoặc cực âm rõ rệt trong phân tử.
- Do đó, O\(_3\) không phải là phân tử phân cực, vì các electron được chia sẻ đồng đều giữa các nguyên tử oxy.
Sử dụng kiến thức trên, hãy trả lời câu hỏi sau:
- Bài Tập 2: Vẽ cấu trúc Lewis của O\(_3\) và giải thích tại sao cấu trúc này cho thấy O\(_3\) là không phân cực.
Lời Giải:
- Để vẽ cấu trúc Lewis của O\(_3\), ta cần xác định số lượng electron hóa trị:
- Mỗi nguyên tử oxy có 6 electron hóa trị, vì vậy tổng số electron hóa trị trong O\(_3\) là \(3 \times 6 = 18\) electron.
- Cấu trúc Lewis của O\(_3\) cho thấy hai liên kết đôi và một cặp electron đơn lẻ trên nguyên tử oxy trung tâm:
- Vì các liên kết đôi chia sẻ electron đồng đều giữa các nguyên tử oxy, không có sự phân cực điện trong phân tử. Đây là lý do tại sao O\(_3\) không phân cực.

Kết Luận: Qua các bài tập trên, chúng ta đã tìm hiểu rằng O\(_3\) không phải là phân tử phân cực. Điều này do cấu trúc hình học của nó và sự phân bố electron đồng đều trong các liên kết cộng hóa trị đôi.
Bài Tập 1: Xác Định Tính Phân Cực Của Các Phân Tử Liên Quan
Để xác định tính phân cực của các phân tử liên quan, trước hết chúng ta cần hiểu rõ về khái niệm phân cực và cách xác định nó dựa trên độ âm điện và cấu trúc hình học của phân tử. Trong bài tập này, chúng ta sẽ tiến hành phân tích tính phân cực của các phân tử sau: O3 (Ozone), CO2 (Carbon Dioxide), H2O (Nước), và NH3 (Amoniac).
1. Phân Tích Tính Phân Cực Của Ozone (O3)
Ozone là một phân tử có cấu trúc hình học góc, với một nguyên tử oxy ở giữa và hai nguyên tử oxy ở hai đầu. Do có cặp electron không liên kết trên nguyên tử oxy trung tâm, cấu trúc của O3 không đối xứng hoàn toàn, dẫn đến việc phân tử này có tính phân cực. Độ phân cực của phân tử có thể được xác định dựa trên sự phân bố không đồng đều của điện tích:
- Độ âm điện của Oxy: 3.44
- Cặp electron không liên kết trên nguyên tử trung tâm làm cho phân tử không có sự đối xứng hoàn toàn.
Vì vậy, O3 là một phân tử phân cực.
2. Phân Tích Tính Phân Cực Của Carbon Dioxide (CO2)
Carbon Dioxide có cấu trúc tuyến tính, với nguyên tử carbon ở giữa và hai nguyên tử oxy ở hai đầu. Do cấu trúc đối xứng tuyến tính, lực hút của các nguyên tử oxy lên nguyên tử carbon là như nhau và ngược chiều, do đó làm cho CO2 là một phân tử không phân cực.
3. Phân Tích Tính Phân Cực Của Nước (H2O)
Nước có cấu trúc hình góc với nguyên tử oxy ở giữa và hai nguyên tử hydro ở hai đầu. Do cặp electron không liên kết trên nguyên tử oxy trung tâm, cấu trúc của H2O không đối xứng hoàn toàn, dẫn đến tính phân cực cao:
- Độ âm điện của Oxy: 3.44
- Độ âm điện của Hydro: 2.20
- Kết quả là nước là một phân tử phân cực.
4. Phân Tích Tính Phân Cực Của Amoniac (NH3)
Amoniac có cấu trúc hình chóp với nguyên tử nitơ ở đỉnh và ba nguyên tử hydro ở đáy. Do cặp electron không liên kết trên nguyên tử nitơ trung tâm, cấu trúc của NH3 không đối xứng hoàn toàn, dẫn đến tính phân cực:
- Độ âm điện của Nitơ: 3.04
- Độ âm điện của Hydro: 2.20
- Như vậy, NH3 là một phân tử phân cực.
Qua bài tập này, ta đã xác định được tính phân cực của các phân tử O3, CO2, H2O, và NH3. Phân tử O3, H2O và NH3 đều là các phân tử phân cực do cấu trúc không đối xứng của chúng, trong khi CO2 là một phân tử không phân cực do cấu trúc đối xứng của nó.

Bài Tập 2: So Sánh Độ Phân Cực Của O3 Với Các Phân Tử Khác
Để so sánh độ phân cực của phân tử O3 với các phân tử khác, chúng ta cần hiểu rõ về cấu trúc và liên kết hóa học của O3. O3 (ozone) là một phân tử có cấu trúc hình chữ V với góc liên kết khoảng 116,8 độ, tạo ra sự phân bố không đồng đều của mật độ electron trong phân tử, dẫn đến sự phân cực.
Liên kết trong O3 là liên kết cộng hóa trị có cực, do hiệu độ âm điện giữa các nguyên tử oxy không đồng đều. Mặc dù tất cả các nguyên tử trong O3 đều là oxy, nhưng cấu trúc hình học của nó làm cho các cặp electron không chia đều giữa các nguyên tử, dẫn đến phân tử có một đầu dương (ít âm điện hơn) và một đầu âm (nhiều âm điện hơn).
Chúng ta hãy so sánh độ phân cực của O3 với một số phân tử khác:
- CO2 (Cacbon dioxit): CO2 là một phân tử không phân cực vì nó có cấu trúc thẳng với hai liên kết đôi C=O triệt tiêu lẫn nhau. Mặc dù liên kết C=O là phân cực, nhưng do cấu trúc tuyến tính của CO2, tổng thể phân tử này không có mômen lưỡng cực.
- H2O (Nước): Phân tử H2O có cấu trúc hình gấp khúc với góc liên kết khoảng 104,5 độ. Do sự chênh lệch độ âm điện lớn giữa O và H, H2O là một phân tử phân cực mạnh, với mômen lưỡng cực lớn hơn so với O3.
- CH4 (Metan): CH4 là một phân tử không phân cực vì nó có cấu trúc tứ diện đối xứng, mặc dù C-H là liên kết có cực nhưng do cấu trúc đối xứng nên các mômen lưỡng cực triệt tiêu lẫn nhau.
- N2 (Nitơ): N2 là một phân tử không phân cực với liên kết cộng hóa trị không cực, vì hai nguyên tử N có độ âm điện bằng nhau và chia sẻ đều cặp electron.
Tóm lại, O3 có độ phân cực nhỏ hơn H2O nhưng lớn hơn CO2, CH4 và N2. Điều này do cấu trúc hình học của O3 không hoàn toàn đối xứng, dẫn đến một mômen lưỡng cực nhỏ trong phân tử.
Bài Tập 3: Phân Tích Cấu Trúc Cộng Hưởng Của Ozone
Phân tử ozone (O3) có cấu trúc hình học bẻ cong với góc liên kết O-O-O khoảng 116,8 độ. Một trong những điểm đặc biệt của O3 là nó có cấu trúc cộng hưởng, tức là các liên kết trong phân tử không thể được mô tả đầy đủ bằng một cấu trúc Lewis duy nhất. Thay vào đó, cấu trúc thực của ozone là một sự kết hợp trung bình của hai cấu trúc cộng hưởng, trong đó một liên kết đôi và một liên kết đơn xen kẽ nhau giữa ba nguyên tử oxy.
Trong mỗi cấu trúc cộng hưởng, một trong các liên kết O-O là liên kết đôi, trong khi liên kết còn lại là liên kết đơn. Do đó, thực tế, các liên kết O-O trong phân tử ozone có độ dài trung gian giữa liên kết đơn và đôi, cụ thể là khoảng 1,28 Å (so với 1,21 Å của liên kết đôi O=O và 1,49 Å của liên kết đơn O-O).
Sự tồn tại của các cấu trúc cộng hưởng làm cho phân tử O3 trở nên ổn định hơn so với trường hợp nếu nó chỉ có một cấu trúc duy nhất. Cấu trúc cộng hưởng cũng giải thích tại sao tất cả các liên kết O-O trong ozone đều có độ dài và năng lượng tương đương, mặc dù chúng là kết quả của các loại liên kết khác nhau trong từng cấu trúc cộng hưởng riêng lẻ.
Dưới đây là sự phân tích cấu trúc cộng hưởng của O3:
- Cấu trúc cộng hưởng thứ nhất:
- Cấu trúc cộng hưởng thứ hai:
\[
\text{O=O-O}
\]
\[
\text{O-O=O}
\]
Cả hai cấu trúc này đóng góp vào cấu trúc thực của ozone, làm cho phân tử này có tính ổn định và đặc tính cộng hưởng đáng chú ý.
Bài Tập 4: Tính Năng Lượng Liên Kết Trong Phân Tử Ozone
Phân tử ozone (O3) là một ví dụ điển hình cho cấu trúc cộng hưởng trong hóa học, nơi các điện tử được phân bố đồng đều giữa các liên kết trong phân tử. Điều này dẫn đến sự ổn định hóa của phân tử thông qua việc chia sẻ năng lượng liên kết giữa các cấu trúc cộng hưởng.
Để tính toán năng lượng liên kết của phân tử ozone, chúng ta có thể sử dụng các bước sau:
- Phân tích cấu trúc cộng hưởng của Ozone: Phân tử ozone có hai cấu trúc cộng hưởng chính, trong đó một nguyên tử oxy trung tâm chia sẻ liên kết đôi với một trong hai nguyên tử oxy khác, và liên kết đơn với nguyên tử oxy còn lại. Các liên kết này không cố định mà liên tục dao động giữa hai cấu trúc cộng hưởng.
- Xác định độ dài và năng lượng liên kết: Độ dài của liên kết O-O trong ozone là trung gian giữa liên kết đơn và liên kết đôi do cộng hưởng. Năng lượng liên kết được chia đều giữa các liên kết, dẫn đến độ bền tổng thể của phân tử.
- Tính toán năng lượng liên kết trung bình: Sử dụng giá trị năng lượng của liên kết O-O trong các hợp chất tương tự, chúng ta có thể ước tính năng lượng liên kết trung bình trong ozone. Cụ thể, năng lượng liên kết của một liên kết đơn O-O và một liên kết đôi O=O sẽ được tính toán và chia trung bình.
Về mặt toán học, năng lượng liên kết trung bình \( E \) của Ozone có thể được biểu diễn như sau:
Trong đó:
- \( E_{O-O} \) là năng lượng của liên kết đơn O-O.
- \( E_{O=O} \) là năng lượng của liên kết đôi O=O.
Như vậy, năng lượng liên kết trong phân tử ozone thể hiện sự ổn định hóa của phân tử qua cấu trúc cộng hưởng, giúp duy trì hình dạng và tính chất đặc trưng của nó trong môi trường hóa học.
Bài Tập 5: Tính Toán Độ Phân Cực Sử Dụng Phương Pháp Lý Thuyết
Để tính toán độ phân cực của phân tử Ozone (\(\text{O}_3\)) bằng phương pháp lý thuyết, chúng ta cần xem xét cấu trúc hình học và các đặc tính điện tử của phân tử này. Phân tử \(\text{O}_3\) có cấu trúc uốn cong với góc liên kết khoảng 116.8° giữa các nguyên tử oxy, điều này tạo ra một độ phân cực nhất định do sự chênh lệch về độ âm điện giữa các nguyên tử oxy.
Để bắt đầu, ta cần sử dụng phương pháp lý thuyết, chẳng hạn như lý thuyết trường tự hợp (Hartree-Fock) hoặc phương pháp phiếm hàm mật độ (DFT), để tính toán hàm sóng và mật độ điện tích của phân tử \(\text{O}_3\). Sau khi tính toán, chúng ta có thể xác định mômen lưỡng cực của phân tử bằng công thức:
Trong đó:
- \(\mu\) là mômen lưỡng cực của phân tử.
- \(q_i\) là điện tích của các hạt mang điện (electron hoặc hạt nhân).
- \(r_i\) là vị trí tương đối của các hạt mang điện đó trong phân tử.
Mômen lưỡng cực của \(\text{O}_3\) thường được tính toán ở khoảng 0.53 D (Debye), cho thấy rằng phân tử này có độ phân cực mặc dù nó là một phân tử không đối xứng.
Sau đó, để so sánh độ phân cực của \(\text{O}_3\) với các phân tử khác, ta cần sử dụng các giá trị mômen lưỡng cực tương ứng của chúng. Ví dụ:
- \(\text{CO}_2\) có mômen lưỡng cực bằng 0 D (không phân cực).
- \(\text{H}_2\text{O}\) có mômen lưỡng cực khoảng 1.85 D (phân cực mạnh).
Vì vậy, dựa trên các tính toán lý thuyết, \(\text{O}_3\) có độ phân cực trung bình, lớn hơn \(\text{CO}_2\) nhưng nhỏ hơn \(\text{H}_2\text{O}\).
Các phương pháp tính toán này cho phép chúng ta đánh giá một cách chi tiết hơn về sự phân cực của các phân tử khác nhau và so sánh chúng trong cùng một điều kiện tính toán.
Bài Tập 6: Đánh Giá Tác Động Của Ozone Đến Sức Khỏe
Ozone (O3) là một chất có tính oxi hóa mạnh và có vai trò quan trọng trong việc bảo vệ trái đất khỏi tia cực tím. Tuy nhiên, khi tồn tại ở tầng khí quyển gần mặt đất, ozone trở thành một chất gây ô nhiễm nguy hiểm, có thể gây ra nhiều vấn đề sức khỏe nghiêm trọng.
Dưới đây là một số tác động của ozone đến sức khỏe con người:
- Ozone có khả năng thâm nhập sâu vào hệ hô hấp, đặc biệt là khi chúng ta hít thở mạnh hoặc sâu.
- Khi tiếp xúc với ozone, các tế bào biểu mô lót đường hô hấp bị tổn thương, dẫn đến viêm phổi và các triệu chứng như ho, viêm họng, và khó thở.
- Ozone cũng gây kích ứng mắt, đau đầu, và có thể làm giảm khả năng phổi ở những người có bệnh lý nền về hô hấp.
Ngoài ra, mức độ ảnh hưởng của ozone còn phụ thuộc vào thời gian và nồng độ tiếp xúc, cũng như tình trạng sức khỏe và độ tuổi của từng người. Những người già, trẻ em, và những người có bệnh nền là những đối tượng dễ bị ảnh hưởng nặng nề nhất.
Việc đánh giá tác động của ozone đến sức khỏe có thể được thực hiện bằng cách tính toán mức độ phơi nhiễm và so sánh với các chỉ số an toàn được quy định bởi các tổ chức y tế. Một số chỉ số thường được sử dụng bao gồm:
- DALYs (Disability-Adjusted Life Years): Số năm sống khỏe mạnh bị mất do bệnh tật hoặc tàn tật gây ra bởi ozone.
- YLL (Years of Life Lost): Số năm sống bị mất do tử vong sớm liên quan đến ô nhiễm ozone.
- YLD (Years Lived with Disability): Số năm sống chung với bệnh tật do tiếp xúc với ozone.
Để giảm thiểu tác động của ozone đến sức khỏe, cần thực hiện các biện pháp bảo vệ như:
- Hạn chế tiếp xúc với môi trường ô nhiễm, đặc biệt là trong các ngày có nồng độ ozone cao.
- Sử dụng máy lọc không khí trong nhà để giảm thiểu sự phơi nhiễm với ozone.
- Thực hiện các biện pháp quản lý môi trường ở cấp độ cá nhân và cộng đồng nhằm giảm lượng ozone phát sinh từ các hoạt động hàng ngày.

Bài Tập 7: Xác Định Ứng Dụng Của Ozone Trong Công Nghiệp
Ozone (O3) là một chất có nhiều ứng dụng quan trọng trong công nghiệp nhờ tính chất oxy hóa mạnh mẽ của nó. Dưới đây là một số ứng dụng chính của ozone trong các ngành công nghiệp:
- Xử lý nước: Ozone được sử dụng rộng rãi trong việc khử trùng nước uống và nước thải. Nhờ khả năng diệt khuẩn hiệu quả mà không để lại cặn bã có hại, ozone giúp đảm bảo an toàn vệ sinh nước.
- Xử lý không khí: Trong các hệ thống lọc không khí, ozone giúp loại bỏ mùi hôi, khói, và các chất ô nhiễm, tạo ra môi trường trong lành và an toàn hơn.
- Bảo quản thực phẩm: Ozone được ứng dụng trong bảo quản thực phẩm bằng cách khử trùng bề mặt, loại bỏ vi khuẩn và nấm mốc, kéo dài thời gian bảo quản và đảm bảo chất lượng thực phẩm.
- Khử trùng dụng cụ y tế: Ozone được sử dụng để khử trùng thiết bị y tế, giúp loại bỏ các vi khuẩn và virus có thể gây nhiễm trùng. Tính năng khử trùng này hiệu quả hơn nhiều so với các phương pháp truyền thống.
- Sản xuất hóa chất: Ozone cũng được dùng trong quá trình sản xuất một số hóa chất, đặc biệt là các sản phẩm cần sự oxy hóa mạnh như ozonide.
Các ứng dụng này chứng minh rằng ozone không chỉ là một chất khí thông thường mà còn là một công cụ hữu ích trong nhiều lĩnh vực công nghiệp, giúp nâng cao hiệu quả và đảm bảo chất lượng trong các quy trình sản xuất và xử lý.
Bài Tập 8: Nghiên Cứu Biện Pháp Giảm Thiểu Ô Nhiễm Ozone
Ô nhiễm ozone là một vấn đề môi trường nghiêm trọng, gây ảnh hưởng xấu đến sức khỏe con người và môi trường. Do đó, việc nghiên cứu và triển khai các biện pháp giảm thiểu ô nhiễm ozone là cực kỳ cần thiết.
Dưới đây là một số biện pháp quan trọng nhằm giảm thiểu ô nhiễm ozone:
- Kiểm soát nguồn phát thải: Hạn chế và kiểm soát nghiêm ngặt các nguồn phát thải khí NOx và VOCs (các hợp chất hữu cơ dễ bay hơi), là những chất tiền thân chính gây ra ô nhiễm ozone. Các nguồn này bao gồm xe cộ, nhà máy công nghiệp, và các hoạt động đốt cháy nhiên liệu hóa thạch.
- Ứng dụng công nghệ xanh: Sử dụng các công nghệ tiên tiến như hệ thống lọc khí, các thiết bị giảm khí thải, và phát triển năng lượng tái tạo (gió, mặt trời) nhằm giảm thiểu sự phát thải khí NOx và VOCs.
- Tăng cường phủ xanh đô thị: Trồng cây xanh, tạo ra các không gian xanh trong đô thị giúp hấp thụ khí CO2, cải thiện chất lượng không khí và giảm thiểu tác động của ozone.
- Nâng cao nhận thức cộng đồng: Tuyên truyền và giáo dục cộng đồng về tác hại của ô nhiễm ozone, khuyến khích việc sử dụng các phương tiện giao thông công cộng, giảm thiểu việc sử dụng xe cá nhân, và tăng cường thực hiện các hành động bảo vệ môi trường.
Các biện pháp này không chỉ giúp giảm thiểu ô nhiễm ozone mà còn đóng góp vào việc cải thiện chất lượng không khí, bảo vệ sức khỏe cộng đồng và duy trì sự phát triển bền vững của môi trường.
Bài Tập 9: Thực Hành Xác Định Độ Phân Cực Qua Thí Nghiệm
Trong bài tập này, chúng ta sẽ thực hiện một loạt các thí nghiệm để xác định độ phân cực của phân tử ozone (O3). Việc thực hành này không chỉ giúp bạn hiểu rõ hơn về cấu trúc phân tử và sự phân cực mà còn mở rộng kiến thức về cách các yếu tố này ảnh hưởng đến tính chất và ứng dụng của ozone trong các lĩnh vực khác nhau.
- Bước 1: Chuẩn bị dụng cụ và hóa chất cần thiết
- Bước 2: Tiến hành thí nghiệm
- Bước 3: Ghi nhận và phân tích dữ liệu
- Bước 4: Kết luận
Đầu tiên, bạn cần chuẩn bị một số dụng cụ thí nghiệm cơ bản như bình phản ứng, ống nghiệm, và dung dịch chứa ozone. Bên cạnh đó, các thiết bị đo lường như máy quang phổ hay điện cực phân cực cũng cần được chuẩn bị sẵn sàng.
Thực hiện việc tạo ra ozone trong điều kiện kiểm soát và sau đó tiến hành đo lường độ phân cực bằng cách sử dụng các thiết bị đo đã chuẩn bị. Đảm bảo rằng các thông số như nhiệt độ và áp suất được ghi lại cẩn thận.
Sau khi thu thập đủ dữ liệu, bạn cần phân tích các giá trị độ phân cực đã đo được. Sử dụng các công thức toán học và lý thuyết hóa học để xác định mối quan hệ giữa độ phân cực và cấu trúc phân tử của ozone.
Dựa trên các kết quả thu được, bạn có thể đưa ra kết luận về mức độ phân cực của phân tử O3 và so sánh với các giá trị lý thuyết. Đồng thời, thảo luận về ứng dụng của các phát hiện này trong thực tế, như trong công nghiệp sản xuất hoặc trong lĩnh vực y tế.
Thông qua thí nghiệm này, bạn sẽ thấy rằng phân tử O3 có đặc tính phân cực do cấu trúc hình tam giác của nó, nơi có sự phân bố không đều của điện tích, dẫn đến sự tạo ra một dipole moment trong phân tử. Điều này góp phần vào các ứng dụng đa dạng của ozone, từ việc khử trùng đến xử lý nước và không khí.

Bài Tập 10: Tính Toán Và Mô Phỏng Sự Phân Cực Của Ozone
Trong bài tập này, chúng ta sẽ tìm hiểu về sự phân cực của phân tử Ozone (O3) thông qua việc tính toán và mô phỏng. Phân tử Ozone có cấu trúc hình chữ V với ba nguyên tử oxy, trong đó một liên kết đôi và một liên kết đơn. Điều này tạo nên sự phân bố không đều của mật độ electron, dẫn đến một mức độ phân cực nhất định trong phân tử.
Bước 1: Phân tích cấu trúc của O3
- Cấu trúc phân tử O3 bao gồm ba nguyên tử Oxy với liên kết đôi và liên kết đơn xen kẽ.
- Vì Oxy là nguyên tố có độ âm điện cao, nên sự chênh lệch độ âm điện giữa các nguyên tử Oxy dẫn đến sự phân cực của các liên kết.
- Cấu trúc hình học của phân tử là một hình chữ V, với góc liên kết khoảng 116.8°, tạo ra một mômen lưỡng cực không bằng không.
Bước 2: Tính toán độ phân cực của O3
- Sử dụng phương trình của dipole moment: \(\mu = q \times d\), trong đó \(q\) là điện tích và \(d\) là khoảng cách giữa các điện tích.
- Do phân tử O3 có dạng phi đối xứng, nên tổng các mômen lưỡng cực của các liên kết không triệt tiêu nhau, dẫn đến phân tử có mômen lưỡng cực ròng.
Bước 3: Mô phỏng sự phân cực của O3
- Sử dụng phần mềm mô phỏng hóa học để tạo dựng cấu trúc phân tử O3 và mô phỏng sự phân bố mật độ electron.
- Phân tích kết quả mô phỏng để xác định vùng có mật độ electron cao và vùng có mật độ electron thấp, từ đó xác định độ phân cực của phân tử.
Kết quả:
Kết quả tính toán và mô phỏng cho thấy phân tử Ozone có một mức độ phân cực nhất định do cấu trúc không đối xứng và sự chênh lệch độ âm điện giữa các nguyên tử Oxy. Tuy nhiên, sự phân cực này không quá lớn do liên kết trong O3 là liên kết cộng hóa trị với sự chia sẻ electron khá đều.
Kết luận:
Sự phân cực của O3 là yếu tố quan trọng cần xem xét trong các phản ứng hóa học liên quan đến Ozone, đặc biệt là trong các phản ứng oxy hóa khử. Việc hiểu rõ tính chất này của O3 giúp chúng ta có thể áp dụng nó một cách hiệu quả trong các ứng dụng thực tế như xử lý môi trường và khử trùng.