Chủ đề độ phân cực là gì: Độ phân cực là một yếu tố quan trọng quyết định đến tính chất của các phân tử trong hóa học. Bài viết này sẽ giúp bạn hiểu rõ hơn về khái niệm độ phân cực, các loại liên kết phân cực và tác động của nó trong đời sống và công nghiệp.
Mục lục
Độ Phân Cực Là Gì?
Độ phân cực là một khái niệm quan trọng trong hóa học, biểu thị sự chênh lệch về điện tích giữa các nguyên tử trong một phân tử. Khi các nguyên tử trong một phân tử có sự chênh lệch về độ âm điện lớn, chúng tạo ra các cặp cực với điện tích dương và âm đối lập nhau, gọi là phân cực.
Phân Loại Liên Kết Dựa Trên Độ Phân Cực
- Liên kết không phân cực: Xảy ra khi sự chênh lệch về độ âm điện giữa các nguyên tử là rất nhỏ, khiến các electron được chia sẻ đồng đều. Ví dụ: Liên kết trong phân tử H2, O2.
- Liên kết có phân cực: Xảy ra khi có sự chênh lệch lớn về độ âm điện giữa các nguyên tử, dẫn đến sự dịch chuyển electron về phía nguyên tử có độ âm điện lớn hơn. Ví dụ: Liên kết trong phân tử HCl.
Cách Đo Độ Phân Cực
Độ phân cực của một phân tử được xác định thông qua mômen lưỡng cực, ký hiệu là \(\mu\). Mômen lưỡng cực được tính bằng công thức:
\[
\mu = q \times d
\]
Trong đó:
- \(q\): Độ lớn của điện tích
- \(d\): Khoảng cách giữa hai điện tích đối lập
Tác Động Của Độ Phân Cực Trong Hóa Học
Độ phân cực ảnh hưởng mạnh mẽ đến tính chất vật lý và hóa học của phân tử. Các phân tử phân cực thường có nhiệt độ sôi và nhiệt độ nóng chảy cao hơn so với các phân tử không phân cực, do lực hút giữa các phân tử phân cực mạnh hơn.
Ứng Dụng Của Độ Phân Cực
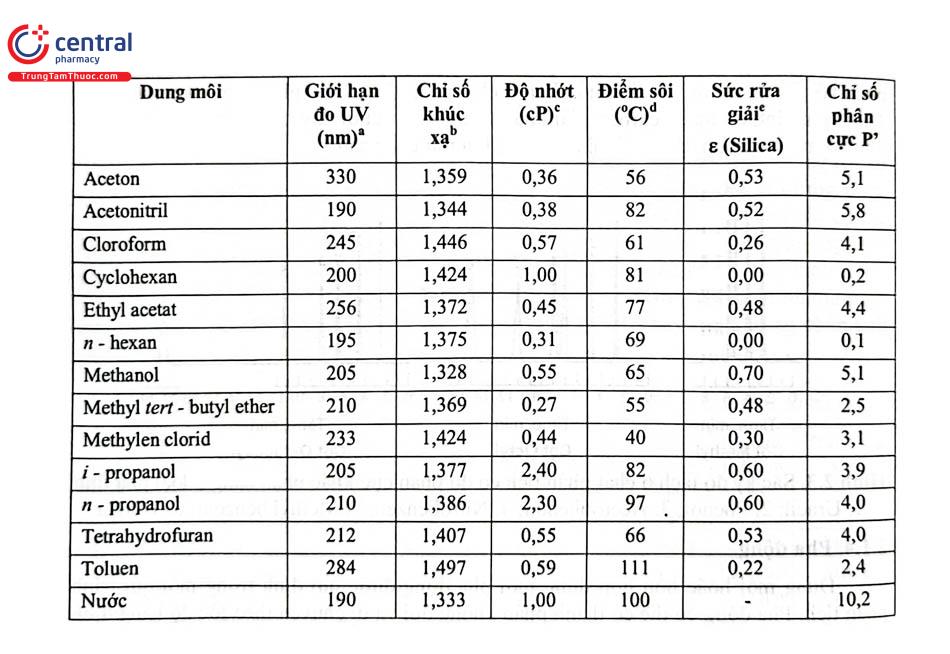
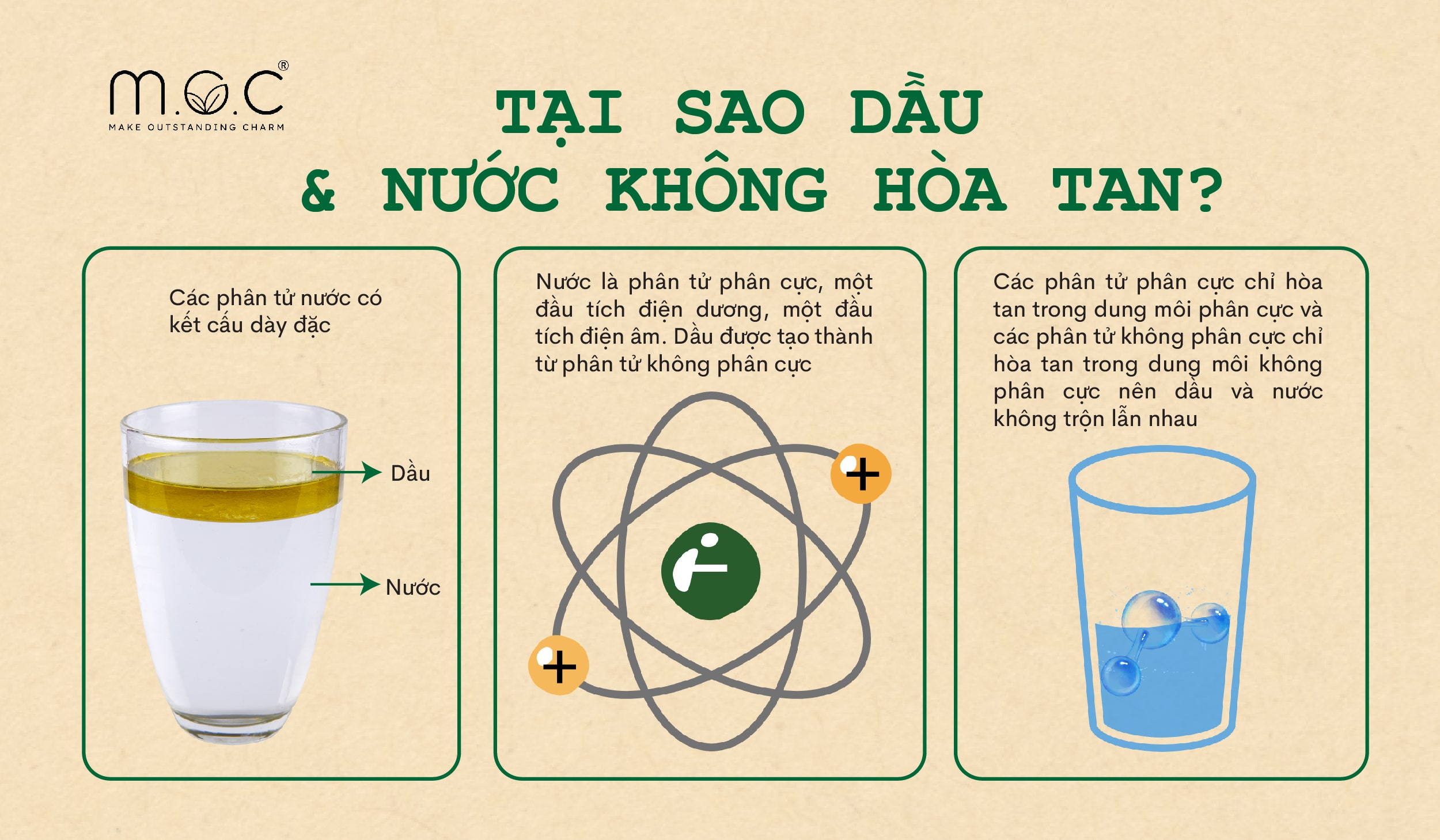
Trong thực tiễn, độ phân cực của các phân tử được ứng dụng rộng rãi trong công nghiệp, chẳng hạn như trong sản xuất dung môi. Các dung môi phân cực, như nước, có khả năng hòa tan tốt các chất phân cực khác. Ngược lại, các dung môi không phân cực như hexan thường được sử dụng để hòa tan các chất không phân cực như dầu và mỡ.
Một Số Ví Dụ Về Độ Phân Cực
- Nước (H2O): Là một phân tử phân cực, với mômen lưỡng cực lớn do sự chênh lệch độ âm điện giữa oxy và hydro.
- Carbon dioxide (CO2): Mặc dù có các liên kết phân cực giữa carbon và oxy, nhưng do cấu trúc hình học đối xứng, CO2 là một phân tử không phân cực.

.png)
1. Định Nghĩa Độ Phân Cực
Độ phân cực là một khái niệm quan trọng trong hóa học và vật lý, liên quan đến sự phân bố không đều của các điện tích trong một phân tử hay một liên kết hóa học. Khi các nguyên tử trong một phân tử có độ âm điện khác nhau, cặp electron chung sẽ bị hút về phía nguyên tử có độ âm điện lớn hơn, tạo ra một mô men lưỡng cực. Mô men lưỡng cực này xác định mức độ phân cực của phân tử.
Mức độ phân cực của một liên kết phụ thuộc vào sự chênh lệch độ âm điện giữa các nguyên tử tham gia liên kết. Nếu chênh lệch này nhỏ, liên kết sẽ là liên kết cộng hóa trị không phân cực; nếu chênh lệch lớn hơn, liên kết sẽ trở nên phân cực hơn, và trong một số trường hợp, có thể hình thành liên kết ion.
- Liên kết cộng hóa trị không phân cực: Chênh lệch độ âm điện nhỏ hơn 0,4.
- Liên kết cộng hóa trị phân cực: Chênh lệch độ âm điện từ 0,4 đến 1,7.
- Liên kết ion: Chênh lệch độ âm điện lớn hơn 1,7.
Mô men lưỡng cực (\(\mu\)) của một liên kết là một đại lượng vật lý được xác định bởi công thức:
\[
\mu = q \times d
\]
Trong đó:
- \(q\) là độ lớn của điện tích dương hoặc âm.
- \(d\) là khoảng cách giữa hai điện tích.
Đơn vị của mô men lưỡng cực là Debye (D), và nó được sử dụng để mô tả mức độ phân cực của một phân tử. Phân tử có mô men lưỡng cực càng lớn thì càng phân cực.
2. Phân Loại Liên Kết Theo Độ Phân Cực
Liên kết hóa học giữa các nguyên tử có thể được phân loại dựa trên mức độ phân cực, dựa vào sự chênh lệch độ âm điện giữa các nguyên tử. Sự phân loại này giúp hiểu rõ hơn về tính chất của các phân tử và cách chúng tương tác trong môi trường khác nhau.
- Liên kết cộng hóa trị không phân cực: Loại liên kết này xảy ra khi hai nguyên tử có độ âm điện gần như tương đương, dẫn đến cặp electron chung được chia đều giữa hai nguyên tử. Ví dụ: phân tử hydro \(H_2\), oxy \(O_2\).
- Liên kết cộng hóa trị phân cực: Xảy ra khi có sự chênh lệch độ âm điện từ 0,4 đến 1,7. Trong trường hợp này, cặp electron chung bị hút về phía nguyên tử có độ âm điện lớn hơn, tạo ra sự phân cực. Ví dụ: phân tử nước \(H_2O\), nơi nguyên tử oxy có độ âm điện cao hơn hydrogen, dẫn đến sự phân cực.
- Liên kết ion: Khi chênh lệch độ âm điện giữa các nguyên tử lớn hơn 1,7, liên kết ion hình thành. Ở đây, một nguyên tử hoàn toàn chuyển giao electron của nó cho nguyên tử kia, dẫn đến sự hình thành của ion dương và ion âm. Ví dụ: \(NaCl\) (muối ăn), nơi natri chuyển electron cho clo, tạo thành ion \(Na^+\) và \(Cl^-\).
Bảng dưới đây tóm tắt các loại liên kết dựa trên độ phân cực:
| Loại Liên Kết | Chênh Lệch Độ Âm Điện | Ví Dụ |
|---|---|---|
| Cộng Hóa Trị Không Phân Cực | 0 - 0,4 | \(H_2\), \(O_2\) |
| Cộng Hóa Trị Phân Cực | 0,4 - 1,7 | \(H_2O\), \(HF\) |
| Liên Kết Ion | > 1,7 | \(NaCl\), \(KBr\) |
Qua việc phân loại này, ta có thể dự đoán được tính chất hóa học của các phân tử, chẳng hạn như độ tan, độ bền liên kết, và khả năng tương tác với các phân tử khác.

3. Ảnh Hưởng Của Độ Phân Cực Trong Hóa Học
Độ phân cực của một phân tử hoặc một liên kết hóa học có ảnh hưởng lớn đến nhiều tính chất và hành vi của các chất trong hóa học. Các đặc điểm này không chỉ ảnh hưởng đến tính chất vật lý mà còn ảnh hưởng đến cách các phân tử tương tác với nhau trong các phản ứng hóa học.
- Độ tan của các chất: Độ phân cực quyết định khả năng tan của các chất trong dung môi. Theo nguyên tắc "like dissolves like" (cùng phân cực thì tan lẫn nhau), các chất phân cực thường tan tốt trong dung môi phân cực như nước, trong khi các chất không phân cực tan tốt trong dung môi không phân cực như hexane.
- Nhiệt độ nóng chảy và nhiệt độ sôi: Các phân tử phân cực thường có lực tương tác mạnh hơn giữa các phân tử (ví dụ như lực liên kết hydrogen), dẫn đến nhiệt độ nóng chảy và nhiệt độ sôi cao hơn so với các phân tử không phân cực có khối lượng phân tử tương đương.
- Hoạt tính hóa học: Các phân tử phân cực có xu hướng phản ứng mạnh mẽ hơn trong các phản ứng hóa học do sự phân bố không đều của mật độ electron, dẫn đến khả năng tạo thành các liên kết mới với các phân tử khác.
- Khả năng tương tác với điện trường: Phân tử phân cực sẽ phản ứng mạnh với điện trường ngoài, dẫn đến sự sắp xếp lại các phân tử theo hướng của điện trường, tạo ra hiện tượng gọi là phân cực điện.
Vì vậy, độ phân cực không chỉ là một khái niệm trừu tượng mà còn có ảnh hưởng trực tiếp đến cách các chất hóa học biểu hiện và tương tác trong môi trường xung quanh. Hiểu rõ về độ phân cực giúp ta giải thích được nhiều hiện tượng hóa học trong thực tế.

4. Đo Lường Độ Phân Cực
Độ phân cực của một phân tử hoặc một liên kết hóa học có thể được đo lường thông qua nhiều phương pháp khác nhau, dựa trên sự phân bố của điện tích trong phân tử. Các phương pháp đo lường này giúp xác định mức độ không đối xứng trong phân bố electron giữa các nguyên tử, từ đó đánh giá tính chất phân cực của chúng.
- Mômen lưỡng cực: Đo lường độ phân cực thường được thực hiện thông qua việc xác định mômen lưỡng cực \(\mu\). Mômen lưỡng cực được tính bằng công thức: \[ \mu = q \times d \] Trong đó, \(q\) là điện tích và \(d\) là khoảng cách giữa các điện tích. Mômen lưỡng cực càng lớn, phân tử càng phân cực.
- Quang phổ hồng ngoại (IR): Phương pháp quang phổ hồng ngoại cũng được sử dụng để đo lường độ phân cực. Các phân tử phân cực sẽ hấp thụ ánh sáng ở một số tần số cụ thể, từ đó tạo ra một phổ đặc trưng giúp xác định độ phân cực của liên kết.
- Độ điện di (Dielectric constant): Độ điện di là một chỉ số quan trọng khác cho độ phân cực, đo lường khả năng của một chất trong việc lưu giữ năng lượng điện trong một điện trường. Chất phân cực có độ điện di cao hơn do khả năng tương tác mạnh với điện trường.
- Thí nghiệm X-ray: Thí nghiệm nhiễu xạ tia X có thể được sử dụng để đo lường phân bố electron trong các tinh thể, từ đó suy ra độ phân cực của các liên kết trong phân tử.
Nhờ các phương pháp đo lường này, chúng ta có thể xác định chính xác độ phân cực của các phân tử, giúp dự đoán và giải thích các tính chất hóa học và vật lý liên quan.

5. Ứng Dụng Của Độ Phân Cực
Độ phân cực của các phân tử và liên kết có rất nhiều ứng dụng trong nhiều lĩnh vực khác nhau của hóa học và khoa học vật liệu. Sự khác biệt trong độ phân cực giúp chúng ta hiểu rõ hơn về tính chất của các chất và ứng dụng của chúng trong đời sống hàng ngày cũng như trong công nghiệp.
- Ứng dụng trong tổng hợp hóa học: Độ phân cực ảnh hưởng đến cách các phân tử tương tác với nhau, đặc biệt là trong các phản ứng tổng hợp hữu cơ. Các nhóm phân cực trong phân tử có thể tạo điều kiện cho phản ứng xảy ra tại các vị trí cụ thể, giúp kiểm soát sản phẩm cuối cùng.
- Ứng dụng trong dược phẩm: Độ phân cực của các phân tử thuốc ảnh hưởng đến khả năng hấp thu của chúng trong cơ thể. Các phân tử phân cực thường dễ hòa tan trong nước, giúp chúng dễ dàng di chuyển trong máu và đến các cơ quan mục tiêu.
- Ứng dụng trong chất liệu polymer: Độ phân cực ảnh hưởng đến tính chất cơ học và nhiệt độ chảy của polymer. Các polymer phân cực có xu hướng có tính chất cơ học đặc biệt, được ứng dụng trong sản xuất nhựa chịu nhiệt và cao su.
- Ứng dụng trong công nghệ môi trường: Các chất hấp phụ dựa trên độ phân cực được sử dụng để loại bỏ các chất gây ô nhiễm từ nước và không khí. Chúng có khả năng liên kết với các chất gây ô nhiễm phân cực, giúp làm sạch môi trường.
- Ứng dụng trong thiết bị điện tử: Độ phân cực của các vật liệu bán dẫn được sử dụng trong việc chế tạo các linh kiện điện tử như diode, transistor và cảm biến. Điều này giúp tăng cường hiệu suất và độ nhạy của các thiết bị điện tử.
Các ứng dụng trên cho thấy độ phân cực là một yếu tố quan trọng trong việc phát triển và cải tiến các công nghệ mới, từ công nghiệp hóa chất đến y học và điện tử.
XEM THÊM:
6. Các Dạng Bài Tập Toán, Lý Liên Quan Đến Độ Phân Cực
Các dạng bài tập liên quan đến độ phân cực thường tập trung vào việc áp dụng các khái niệm toán học và vật lý để giải quyết các vấn đề về độ phân cực của phân tử, điện trường và các hiện tượng tương tự. Dưới đây là một số dạng bài tập tiêu biểu:
- Bài Tập 1: Tính toán mômen lưỡng cực của phân tử \( \text{AB} \) với khoảng cách \( r \) giữa hai nguyên tử và điện tích \( q \) của mỗi nguyên tử.
- Bài Tập 2: Xác định độ phân cực của một liên kết dựa trên độ âm điện của các nguyên tố tham gia liên kết.
- Bài Tập 3: Tính toán độ phân cực của phân tử \( \text{XYZ} \) có cấu trúc hình học khác nhau như hình tam giác, hình tứ diện.
- Bài Tập 4: Phân tích mối quan hệ giữa độ phân cực và hằng số điện môi của một chất trong một hệ điện trường ngoài.
- Bài Tập 5: Xác định lực tĩnh điện giữa hai phân tử phân cực dựa trên mômen lưỡng cực và khoảng cách giữa chúng.
- Bài Tập 6: Tính toán giá trị cường độ điện trường tại một điểm xác định do một mômen lưỡng cực tạo ra.
- Bài Tập 7: Xác định sự thay đổi trong độ phân cực khi nhiệt độ của hệ thống tăng lên.
- Bài Tập 8: Tính toán năng lượng tương tác giữa hai mômen lưỡng cực trong một hệ điện trường đồng nhất.
- Bài Tập 9: Giải bài toán về sự lệch hướng của phân tử phân cực trong điện trường không đồng nhất.
- Bài Tập 10: Xác định độ phân cực của một chuỗi phân tử trong trường hợp liên kết cộng hóa trị với mức độ phân cực khác nhau.
Mỗi bài tập trên đều giúp củng cố hiểu biết của người học về các khái niệm toán học và vật lý liên quan đến độ phân cực, đồng thời phát triển kỹ năng giải quyết các vấn đề phức tạp.