Chủ đề tính phân cực của nước: Tính phân cực của nước là yếu tố cốt lõi tạo nên nhiều hiện tượng tự nhiên và sinh học. Bài viết này sẽ cung cấp cho bạn kiến thức chuyên sâu, từ cơ chế hình thành đến ứng dụng thực tiễn của tính phân cực, giúp bạn hiểu rõ hơn về sự độc đáo của phân tử nước.
Mục lục
Tính Phân Cực của Nước
Phân tử nước (H2O) có tính phân cực do cấu trúc hóa học và sự phân bố không đồng đều của điện tích giữa các nguyên tử trong phân tử. Dưới đây là các thông tin chi tiết liên quan đến tính phân cực của nước:
Cấu trúc của phân tử nước
Phân tử nước gồm hai nguyên tử hydro liên kết với một nguyên tử oxy thông qua liên kết cộng hóa trị. Góc giữa hai liên kết O-H là khoảng 104,5 độ. Điều này tạo ra một cấu trúc phân tử hình chữ V thay vì thẳng hàng.
Sự phân bố điện tích
Nguyên tử oxy có độ âm điện cao hơn nguyên tử hydro, điều này khiến các cặp electron trong liên kết O-H bị kéo về phía nguyên tử oxy nhiều hơn. Kết quả là, phần của phân tử gần oxy tích điện âm một phần (\(\delta^-\)), trong khi phần gần hydro tích điện dương một phần (\(\delta^+\)).
Tính lưỡng cực
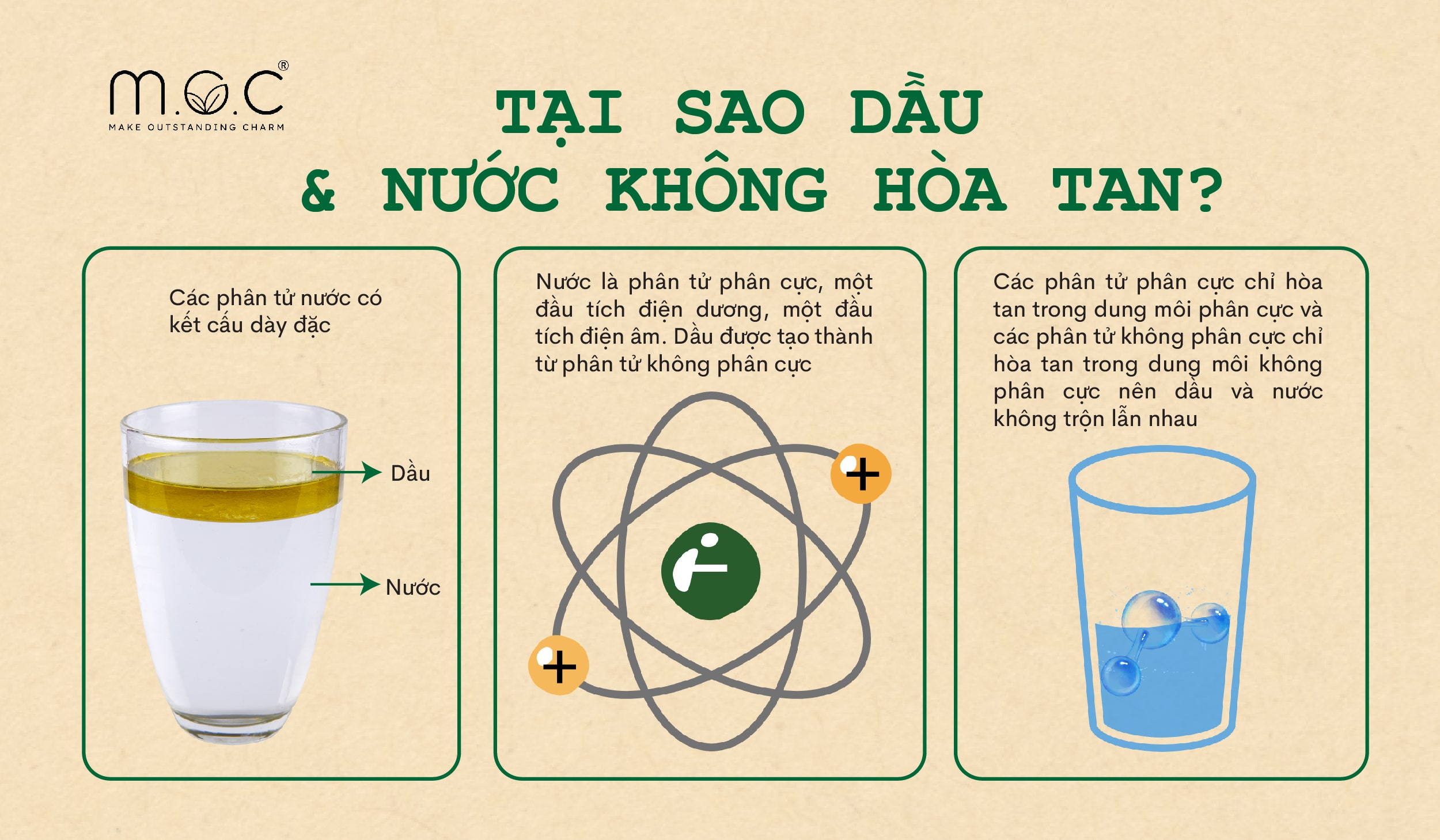
Tính phân cực của nước dẫn đến việc phân tử nước có hai cực: một cực dương (ở phía các nguyên tử hydro) và một cực âm (ở phía nguyên tử oxy). Tính lưỡng cực này giúp nước có khả năng hòa tan nhiều chất khác nhau, đặc biệt là các chất ion và phân cực.
Hệ quả của tính phân cực
- Khả năng hòa tan: Nước là dung môi tuyệt vời, có thể hòa tan nhiều loại chất, từ muối đến đường, nhờ tính phân cực.
- Liên kết hydro: Tính phân cực cho phép các phân tử nước tạo thành liên kết hydro với nhau, điều này góp phần vào các đặc tính đặc biệt của nước như nhiệt độ sôi cao, nhiệt dung riêng cao, và sự mở rộng khi đóng băng.
- Tương tác với các chất khác: Nước có thể tương tác mạnh mẽ với các phân tử và ion phân cực khác, điều này rất quan trọng trong các quá trình sinh hóa học và công nghệ.
Kết luận
Tính phân cực là một đặc tính quan trọng của nước, ảnh hưởng đến nhiều quá trình tự nhiên và ứng dụng công nghệ. Nó giúp nước trở thành một dung môi đa năng và là nền tảng cho nhiều hiện tượng hóa học và sinh học trong tự nhiên.

.png)
1. Tính Phân Cực Của Phân Tử Nước
Phân tử nước \((H_2O)\) có cấu trúc hình học góc với góc liên kết khoảng \(104.5^\circ\). Nguyên tử oxy trong phân tử nước có độ âm điện cao hơn đáng kể so với các nguyên tử hydro, dẫn đến việc đôi electron trong liên kết bị kéo lệch về phía oxy.
Điều này làm cho oxy mang điện tích âm một phần \(\delta^-\) và hydro mang điện tích dương một phần \(\delta^+\). Từ đó, phân tử nước trở thành một lưỡng cực với hai cực trái dấu, tạo ra tính phân cực mạnh mẽ.
Các đặc điểm chính của tính phân cực trong phân tử nước bao gồm:
- Liên kết hydro: Nhờ tính phân cực, các phân tử nước dễ dàng hình thành liên kết hydro với nhau, góp phần tạo nên nhiều tính chất độc đáo của nước như nhiệt độ sôi cao và sức căng bề mặt lớn.
- Sự hòa tan: Tính phân cực của nước làm cho nó trở thành dung môi tốt cho các chất có cực như muối và các hợp chất ion.
- Sự dẫn nhiệt và điện: Do sự hiện diện của liên kết hydro và các cực trong phân tử, nước có khả năng dẫn nhiệt và điện nhất định.
Tóm lại, tính phân cực của nước là một yếu tố quan trọng không chỉ ảnh hưởng đến cấu trúc và tính chất của nước mà còn đóng vai trò thiết yếu trong nhiều hiện tượng sinh học và hóa học.
2. Các Hiện Tượng Liên Quan Đến Tính Phân Cực Của Nước
Tính phân cực của phân tử nước dẫn đến nhiều hiện tượng quan trọng và đặc biệt trong tự nhiên, đóng vai trò thiết yếu trong các quá trình sinh học và hóa học. Dưới đây là một số hiện tượng chính liên quan đến tính phân cực của nước:
- Sự liên kết hydrogen: Do tính phân cực, các phân tử nước hình thành liên kết hydrogen với nhau, tạo nên mạng lưới liên kết bền vững. Đây là lý do tại sao nước có nhiệt độ sôi và nhiệt độ nóng chảy cao so với các phân tử có khối lượng tương đương.
- Hiện tượng mao dẫn: Nước có thể leo lên trong các ống nhỏ nhờ lực kết dính giữa các phân tử nước và lực bám dính với bề mặt của ống. Hiện tượng này rất quan trọng trong sự vận chuyển nước từ rễ lên lá ở thực vật.
- Sức căng bề mặt: Sức căng bề mặt cao của nước là kết quả của các liên kết hydrogen giữa các phân tử nước. Điều này cho phép các loài côn trùng như bọ nước có thể đi trên mặt nước mà không bị chìm.
- Hòa tan các chất phân cực: Nước được gọi là "dung môi vạn năng" vì nó có khả năng hòa tan nhiều chất khác nhau, đặc biệt là các chất phân cực và các ion, nhờ vào tính phân cực của nó.
Tính phân cực của nước không chỉ là nền tảng cho các hiện tượng tự nhiên mà còn là yếu tố chính giúp duy trì sự sống và các quá trình sinh học trên Trái Đất.

3. Bài Tập Ứng Dụng Về Tính Phân Cực Của Nước
Trong phần này, chúng ta sẽ khám phá một số bài tập thực hành liên quan đến tính phân cực của phân tử nước. Những bài tập này sẽ giúp củng cố kiến thức và hiểu rõ hơn về hiện tượng này thông qua các ví dụ cụ thể.
-
Bài tập 1: Tính toán khối lượng phân tử nước được tạo ra.
Giả sử ta có một lượng khí \(H_2\) và \(O_2\) đủ để tạo ra 18g nước. Tính thể tích khí \(O_2\) và \(H_2\) cần dùng ở điều kiện tiêu chuẩn (đktc).
Hướng dẫn giải:
-
Sử dụng phương trình hóa học:
\[2H_2 + O_2 \rightarrow 2H_2O\]
-
Từ đó, tính toán số mol khí \(H_2\) và \(O_2\) cần thiết:
Số mol của nước được tạo thành: \[n(H_2O) = \dfrac{18}{18} = 1 \, \text{mol}\]
Số mol của khí \(H_2\): \[n(H_2) = n(H_2O) = 1 \, \text{mol}\]
Số mol của khí \(O_2\): \[n(O_2) = \dfrac{1}{2} \times n(H_2O) = 0,5 \, \text{mol}\]
-
Thể tích khí cần thiết:
Thể tích khí \(H_2\): \[V(H_2) = 1 \times 22,4 = 22,4 \, \text{lít}\]
Thể tích khí \(O_2\): \[V(O_2) = 0,5 \times 22,4 = 11,2 \, \text{lít}\]
-
-
Bài tập 2: Tính toán lực liên kết giữa các phân tử nước.
Biết rằng độ âm điện của \(O_2\) là 3,44 và của \(H_2\) là 2,20. Tính toán độ phân cực của liên kết \(OH\) trong phân tử nước và nhận xét về lực liên kết này.
Hướng dẫn giải:
-
Tính hiệu độ âm điện:
\[\Delta \chi = \chi(O) - \chi(H) = 3,44 - 2,20 = 1,24\]
-
Dựa trên hiệu độ âm điện, liên kết \(OH\) là liên kết phân cực mạnh.
-