Chủ đề nước có tính phân cực do: Nước có tính phân cực do đâu? Bài viết này sẽ giúp bạn hiểu rõ nguyên nhân và cơ chế phân cực của nước, từ đó khám phá những ứng dụng thực tế và quan trọng trong đời sống hàng ngày cũng như trong các ngành khoa học. Hãy cùng tìm hiểu về tính chất đặc biệt này của nước.
Mục lục
Thông Tin Chi Tiết Về Tính Phân Cực Của Nước
Nước là một hợp chất vô cơ có công thức hóa học là . Phân tử nước bao gồm hai nguyên tử hydro (H) liên kết với một nguyên tử oxy (O) bằng liên kết cộng hóa trị. Tuy nhiên, đặc điểm đặc trưng của nước chính là tính phân cực của nó, làm cho nước có nhiều tính chất vật lý và hóa học độc đáo.
Nguyên Nhân Gây Ra Tính Phân Cực
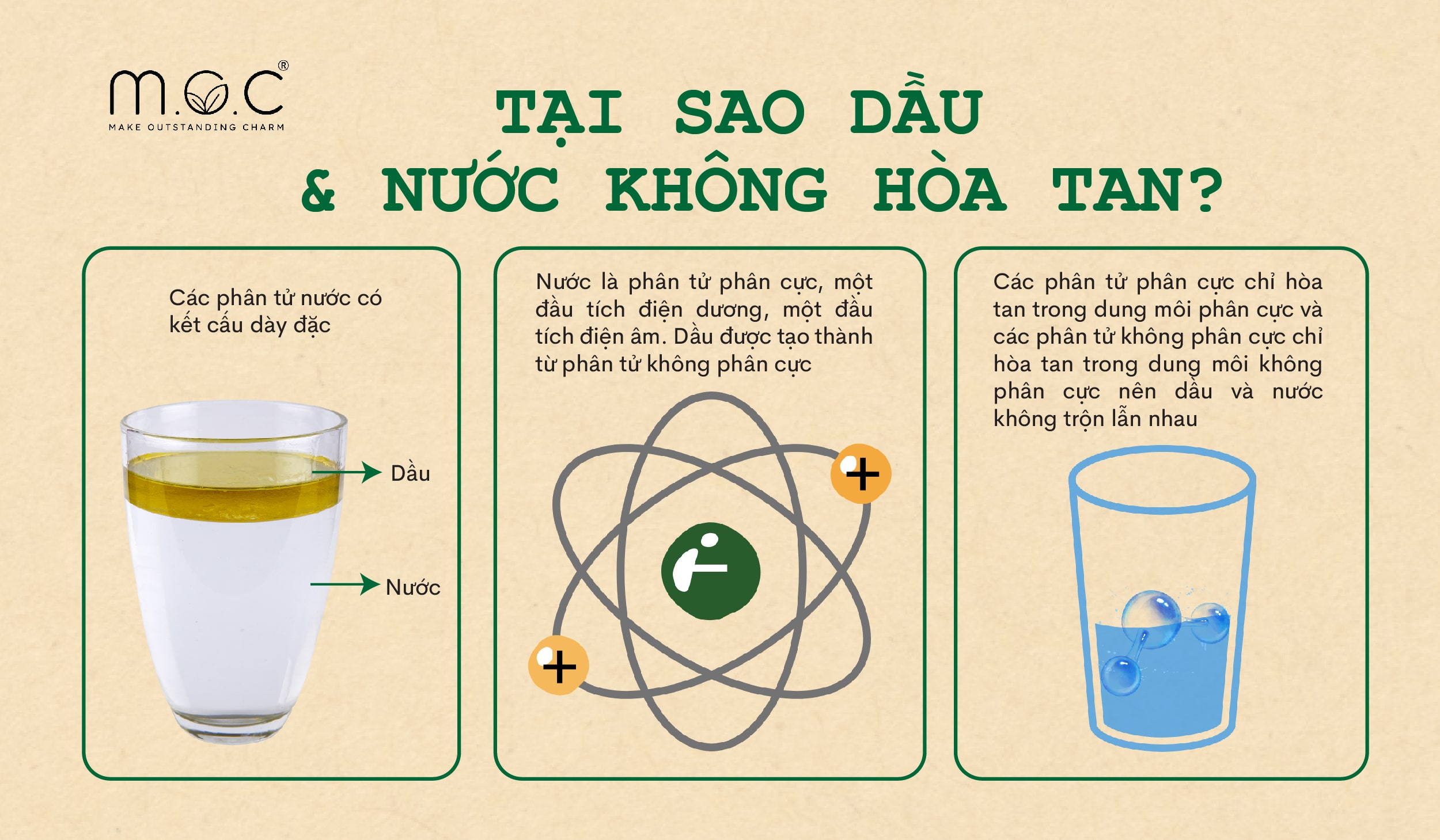
Tính phân cực của nước xuất phát từ sự chênh lệch độ âm điện giữa nguyên tử oxy và nguyên tử hydro. Nguyên tử oxy có độ âm điện lớn hơn, kéo các cặp electron dùng chung trong liên kết cộng hóa trị về phía mình nhiều hơn so với hydro.
Điều này dẫn đến việc nguyên tử oxy mang một phần điện tích âm (\(\delta^-\)), trong khi các nguyên tử hydro mang một phần điện tích dương (\(\delta^+\)). Kết quả là phân tử nước có hai đầu với các điện tích trái dấu nhau, làm cho nó trở thành một phân tử phân cực.
Tính Chất Vật Lý và Hóa Học Của Nước Do Tính Phân Cực
- Khả năng hòa tan: Nước được gọi là "dung môi vạn năng" vì khả năng hòa tan nhiều chất khác nhau, đặc biệt là các chất ion và các phân tử phân cực.
- Liên kết hydro: Do tính phân cực, các phân tử nước có khả năng tạo liên kết hydro với nhau, đóng vai trò quan trọng trong việc điều chỉnh nhiệt độ và duy trì sự sống trên Trái Đất.
- Nhiệt độ sôi và nhiệt độ nóng chảy: Liên kết hydro giữa các phân tử nước làm cho nước có nhiệt độ sôi và nhiệt độ nóng chảy cao so với các hợp chất có khối lượng phân tử tương đương.
- Khả năng điều hòa nhiệt độ: Nước có nhiệt dung riêng cao, giúp điều hòa nhiệt độ môi trường, rất quan trọng trong sinh học và khí hậu học.
Ứng Dụng Của Tính Phân Cực Của Nước
Trong đời sống hàng ngày, tính phân cực của nước giúp cho nó được sử dụng rộng rãi trong nhiều lĩnh vực, từ công nghiệp hóa chất, y học đến nông nghiệp. Khả năng hòa tan nhiều chất làm cho nước trở thành một dung môi lý tưởng trong các phản ứng hóa học và quá trình sinh học.
| Ứng Dụng | Vai Trò |
|---|---|
| Trong công nghiệp | Nước được sử dụng làm dung môi trong sản xuất hóa chất, tẩy rửa và trong các quá trình công nghệ khác. |
| Trong y học | Nước là thành phần chính trong các dung dịch tiêm, dung dịch truyền và các sản phẩm chăm sóc sức khỏe khác. |
| Trong nông nghiệp | Nước giúp hòa tan các chất dinh dưỡng, hỗ trợ quá trình hấp thụ dinh dưỡng của cây trồng. |

.png)
1. Giới Thiệu Về Tính Phân Cực Của Nước
Nước là một hợp chất hóa học thiết yếu cho sự sống, có công thức hóa học là . Một trong những đặc điểm quan trọng của nước là tính phân cực, yếu tố làm nên nhiều tính chất độc đáo và quan trọng của nước.
Phân tử nước được cấu tạo từ hai nguyên tử hydro (H) và một nguyên tử oxy (O). Do sự chênh lệch độ âm điện giữa oxy và hydro, các electron trong liên kết cộng hóa trị bị kéo về phía nguyên tử oxy nhiều hơn. Điều này làm cho nguyên tử oxy mang một phần điện tích âm (\(\delta^-\)), trong khi các nguyên tử hydro mang một phần điện tích dương (\(\delta^+\)).
Kết quả là, phân tử nước có hai đầu tích điện trái dấu nhau, tạo thành một lưỡng cực điện. Tính phân cực này không chỉ ảnh hưởng đến cấu trúc của nước mà còn dẫn đến nhiều tính chất lý hóa đặc biệt của nó, chẳng hạn như khả năng hòa tan nhiều chất, liên kết hydro mạnh mẽ và khả năng điều hòa nhiệt độ môi trường.
Chính tính phân cực của nước đã làm cho nó trở thành một dung môi lý tưởng, có khả năng hòa tan nhiều loại chất khác nhau, đặc biệt là các hợp chất ion và các chất phân cực khác. Đây là lý do nước được mệnh danh là "dung môi vạn năng" trong nhiều quá trình sinh học và hóa học.
2. Tính Chất Vật Lý Do Tính Phân Cực Của Nước
Tính phân cực của nước tạo ra nhiều tính chất vật lý độc đáo, đóng vai trò quan trọng trong các hiện tượng tự nhiên và ứng dụng công nghệ. Dưới đây là một số tính chất vật lý nổi bật do tính phân cực của nước:
- Khả năng hòa tan: Nhờ tính phân cực, nước có khả năng hòa tan nhiều loại chất khác nhau, đặc biệt là các chất ion và các phân tử phân cực khác. Điều này làm cho nước trở thành dung môi lý tưởng trong các phản ứng hóa học và quá trình sinh học.
- Liên kết hydro: Tính phân cực của nước dẫn đến sự hình thành các liên kết hydro giữa các phân tử nước với nhau. Liên kết hydro này không chỉ làm cho nước có độ nhớt cao mà còn góp phần vào việc duy trì cấu trúc của các phân tử sinh học quan trọng như DNA và protein.
- Nhiệt độ sôi và nhiệt độ nóng chảy cao: Do các liên kết hydro, nước có nhiệt độ sôi và nhiệt độ nóng chảy cao hơn nhiều so với các hợp chất khác có khối lượng phân tử tương đương. Điều này giúp nước tồn tại ở dạng lỏng trong phạm vi nhiệt độ rộng, rất quan trọng cho sự sống.
- Sức căng bề mặt cao: Tính phân cực và các liên kết hydro giữa các phân tử nước tạo ra sức căng bề mặt cao, cho phép nước tạo thành các giọt nước và hỗ trợ các hiện tượng như mao dẫn trong thực vật.
- Khả năng điều hòa nhiệt độ: Nước có nhiệt dung riêng cao, nghĩa là nó có khả năng hấp thụ và giải phóng nhiệt mà không thay đổi nhiệt độ quá nhiều. Điều này giúp ổn định nhiệt độ môi trường sống, bảo vệ sinh vật khỏi những biến động nhiệt độ đột ngột.
Những tính chất vật lý này của nước không chỉ đóng vai trò quan trọng trong các hiện tượng tự nhiên mà còn được ứng dụng rộng rãi trong công nghiệp, y học và khoa học môi trường. Sự đặc biệt của nước bắt nguồn từ chính tính phân cực của nó, tạo ra những khả năng mà ít hợp chất nào có thể sánh được.

3. Ứng Dụng Thực Tế Của Tính Phân Cực Của Nước
Tính phân cực của nước là yếu tố quan trọng mang lại nhiều ứng dụng thực tế trong đời sống và các ngành công nghiệp. Dưới đây là một số ứng dụng nổi bật của tính phân cực của nước:
- Trong công nghiệp hóa chất: Nước là dung môi quan trọng trong nhiều quá trình sản xuất hóa chất. Khả năng hòa tan mạnh mẽ đối với các chất ion và phân tử phân cực giúp nước tham gia vào các phản ứng hóa học và là môi trường lý tưởng cho nhiều quá trình tổng hợp và xử lý hóa chất.
- Trong y học: Nước đóng vai trò chủ chốt trong nhiều ứng dụng y tế, từ dung dịch tiêm, truyền dịch đến thuốc uống. Tính phân cực của nước giúp nó hòa tan các dược chất hiệu quả, tạo ra các dung dịch ổn định và dễ dàng hấp thụ vào cơ thể.
- Trong nông nghiệp: Nước là yếu tố không thể thiếu trong quá trình tưới tiêu và chăm sóc cây trồng. Tính phân cực của nước giúp hòa tan các chất dinh dưỡng trong đất, giúp cây trồng dễ dàng hấp thụ các dưỡng chất cần thiết cho sự phát triển.
- Trong sinh học và hóa sinh: Tính phân cực của nước tạo điều kiện thuận lợi cho các quá trình sinh hóa trong cơ thể sống. Các phân tử sinh học như protein, axit nucleic, và enzyme đều tương tác tốt trong môi trường nước nhờ tính phân cực, hỗ trợ cho quá trình trao đổi chất và duy trì sự sống.
- Trong môi trường: Tính phân cực của nước ảnh hưởng lớn đến chu trình nước và khí hậu trên Trái Đất. Khả năng hấp thụ nhiệt cao và giữ nhiệt giúp nước điều hòa nhiệt độ toàn cầu, duy trì sự ổn định của hệ sinh thái.
Từ những ứng dụng này, có thể thấy rằng tính phân cực của nước không chỉ là một tính chất hóa học đơn thuần, mà nó còn có ý nghĩa to lớn trong nhiều lĩnh vực của đời sống và khoa học, từ công nghiệp, y học, nông nghiệp cho đến sinh học và môi trường.

4. Các Bài Tập Về Tính Phân Cực Của Nước
Dưới đây là một số bài tập về tính phân cực của nước, giúp bạn củng cố kiến thức và hiểu sâu hơn về tính chất đặc biệt này.
-
Bài Tập 1: Phân Tích Tính Phân Cực Của Phân Tử Nước
Giải thích tại sao phân tử nước có tính phân cực. Sử dụng lý thuyết về độ âm điện và cấu trúc phân tử để hỗ trợ giải thích của bạn.
-
Bài Tập 2: Xác Định Các Chất Có Thể Hòa Tan Trong Nước
Liệt kê các chất có thể hòa tan trong nước do tính phân cực của nó. Giải thích lý do tại sao các chất này có khả năng hòa tan trong nước.
-
Bài Tập 3: Tính Toán Liên Kết Hydro Trong Nước
Cho biết số lượng liên kết hydro mà một phân tử nước có thể tạo ra trong môi trường nước lỏng. Sử dụng mô hình liên kết hydro để minh họa.
-
Bài Tập 4: So Sánh Tính Phân Cực Của Nước Với Các Hợp Chất Khác
Chọn một hợp chất khác (ví dụ: metanol) và so sánh tính phân cực của nó với nước. Giải thích sự khác biệt và ảnh hưởng của chúng đến tính chất của từng chất.
-
Bài Tập 5: Nghiên Cứu Ảnh Hưởng Của Tính Phân Cực Đến Sức Căng Bề Mặt
Phân tích cách tính phân cực của nước ảnh hưởng đến sức căng bề mặt của nó. Thực hiện thí nghiệm đơn giản để đo sức căng bề mặt của nước.
-
Bài Tập 6: Ứng Dụng Tính Phân Cực Trong Các Quá Trình Sinh Học
Giải thích vai trò của tính phân cực của nước trong quá trình vận chuyển chất dinh dưỡng qua màng tế bào. Minh họa với ví dụ cụ thể.
-
Bài Tập 7: Tính Năng Lượng Cần Thiết Để Phá Vỡ Liên Kết Hydro Trong Nước
Tính toán năng lượng cần thiết để phá vỡ các liên kết hydro giữa các phân tử nước trong 1 mol nước. Sử dụng các giá trị năng lượng liên kết được cho trước.
-
Bài Tập 8: Mô Phỏng Sự Thay Đổi Nhiệt Độ Của Nước
Sử dụng phần mềm mô phỏng để nghiên cứu sự thay đổi nhiệt độ của nước khi áp dụng một nguồn nhiệt. Phân tích vai trò của tính phân cực trong việc điều hòa nhiệt độ.
-
Bài Tập 9: Khảo Sát Khả Năng Hòa Tan Của Nước Với Các Chất Khác Nhau
Thực hiện thí nghiệm hòa tan các chất khác nhau trong nước (muối, đường, dầu,...) và giải thích kết quả dựa trên tính phân cực của nước.
-
Bài Tập 10: Nghiên Cứu Sự Ổn Định Của Các Hợp Chất Trong Dung Dịch Nước
Chọn một hợp chất hữu cơ và một hợp chất vô cơ, và nghiên cứu độ ổn định của chúng trong dung dịch nước. Giải thích cách tính phân cực của nước ảnh hưởng đến sự ổn định của các hợp chất này.