Chủ đề ch4 có phân cực không: CH4, hay metan, là một hợp chất hóa học quan trọng trong cuộc sống hàng ngày. Vậy CH4 có phân cực không? Bài viết này sẽ giải thích chi tiết về cấu trúc phân tử của CH4, lý do tại sao nó không có tính phân cực và ảnh hưởng của đặc điểm này đến các ứng dụng công nghiệp và nghiên cứu khoa học. Khám phá ngay để hiểu rõ hơn về metan!
Mục lục
- CH4 Có Phân Cực Không?
- Mục Lục
- Bài Tập
- Bài Tập 1: Tính Chất Phân Cực của CH4
- Bài Tập 2: So Sánh Tính Phân Cực giữa CH4 và CO2
- Bài Tập 3: Giải Thích Đặc Điểm Cấu Trúc Tứ Diện của CH4
- Bài Tập 4: Phân Tích Tính Chất Vật Lý của CH4
- Bài Tập 5: Tính Phân Cực trong Các Phân Tử Hóa Học Khác
- Bài Tập 6: Ứng Dụng Của CH4 Trong Công Nghiệp
- Bài Tập 7: So Sánh Các Phân Tử Phân Cực và Không Phân Cực
- Bài Tập 8: Tính Phân Cực và Đặc Điểm Hóa Học của H2O
- Bài Tập 9: Phân Tích Các Ứng Dụng Của Các Phân Tử Phân Cực
- Bài Tập 10: Giải Quyết Vấn Đề Tính Phân Cực Trong Các Tình Huống Thực Tế
CH4 Có Phân Cực Không?
Metan (CH4) là một hợp chất hóa học đơn giản với công thức phân tử C1H4. Đây là một trong những hợp chất hữu cơ phổ biến và là thành phần chính của khí tự nhiên. Vậy, CH4 có phân cực không? Dưới đây là thông tin chi tiết về vấn đề này:
1. Đặc Điểm Cấu Trúc của CH4
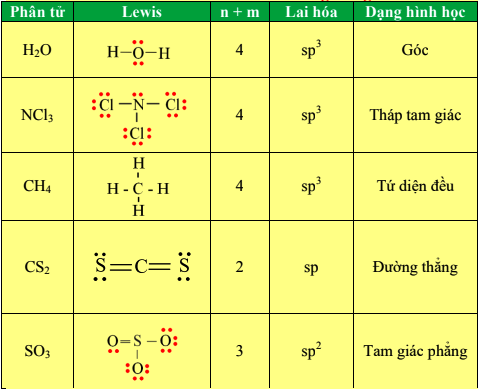
CH4 có cấu trúc phân tử hình tứ diện với carbon ở trung tâm và bốn nguyên tử hydro ở các đỉnh của hình tứ diện. Góc liên kết giữa các liên kết C-H là khoảng 109.5°.
2. Tính Chất Phân Cực của CH4
- CH4 không phải là một phân tử phân cực. Điều này do các liên kết C-H trong CH4 là không phân cực và đối xứng.
- Trong phân tử CH4, các liên kết C-H có độ âm điện tương đối giống nhau, và cấu trúc tứ diện làm cho các lực đẩy giữa các liên kết được phân bố đều.
- Nhờ vào cấu trúc tứ diện đều, lực đẩy giữa các liên kết C-H triệt tiêu lẫn nhau, dẫn đến sự phân phối điện tích đều trong phân tử.
3. Ứng Dụng và Tính Chất
| Thuộc Tính | Chi Tiết |
|---|---|
| Điểm Nóng | -164 °C |
| Điểm Sôi | -89 °C |
| Khối Lượng Phân Tử | 16.04 g/mol |
| Tính Tan Trong Nước | Không tan |
4. Kết Luận
Với cấu trúc tứ diện đều và các liên kết C-H không phân cực, CH4 không có tính phân cực. Đây là một đặc điểm quan trọng trong việc xác định các tính chất hóa học và vật lý của metan.
.png)
Mục Lục
Giới Thiệu
Khám phá thông tin cơ bản về CH4 và tại sao câu hỏi về tính phân cực của nó lại quan trọng trong hóa học.
Cấu Trúc Phân Tử của CH4
Chi tiết về cấu trúc hình tứ diện của phân tử metan và ảnh hưởng của cấu trúc này đến tính chất của nó.
Tính Chất Phân Cực của CH4
Giải thích lý do tại sao CH4 không phải là phân tử phân cực dựa trên cấu trúc và liên kết của nó.
Phân Tích Chi Tiết
Phân tích sâu về cấu trúc phân tử và cách tính chất phân cực được xác định.
Ứng Dụng và Tính Chất
Những ứng dụng thực tiễn của CH4 và các tính chất quan trọng của nó trong công nghiệp.
So Sánh với Các Phân Tử Khác
So sánh CH4 với các phân tử khác như CO2 và H2O về tính phân cực và đặc điểm cấu trúc.
Bài Tập Về CH4
Các bài tập và câu hỏi liên quan đến tính phân cực của CH4 để làm rõ kiến thức và áp dụng vào thực tế.
Kết Luận
Tóm tắt các điểm chính về tính phân cực của CH4 và ảnh hưởng của nó trong các lĩnh vực khác nhau.
Bài Tập
Dưới đây là một số bài tập để giúp bạn hiểu rõ hơn về tính phân cực của CH4 và các khái niệm liên quan:
-
Bài Tập 1: Xác Định Tính Phân Cực của CH4
Vẽ cấu trúc phân tử của CH4 và giải thích lý do tại sao phân tử này không có tính phân cực.
-
Bài Tập 2: So Sánh Tính Phân Cực giữa CH4 và CO2
So sánh cấu trúc phân tử và tính phân cực của CH4 và CO2. Nêu rõ sự khác biệt về tính phân cực giữa hai phân tử này.
-
Bài Tập 3: Tính Chất Phân Cực trong Các Phân Tử
Chọn ba phân tử khác ngoài CH4 và phân tích tính phân cực của chúng. So sánh với CH4.
-
Bài Tập 4: Phân Tích Đặc Điểm Cấu Trúc Tứ Diện của CH4
Giải thích tại sao cấu trúc hình tứ diện của CH4 dẫn đến tính chất không phân cực. Vẽ sơ đồ và mô tả chi tiết.
-
Bài Tập 5: Ứng Dụng Tính Phân Cực trong Công Nghiệp
Trình bày một ứng dụng công nghiệp của CH4. Giải thích làm thế nào tính chất không phân cực của nó ảnh hưởng đến ứng dụng này.
-
Bài Tập 6: Phân Tích Tính Phân Cực của H2O
So sánh tính phân cực của CH4 với H2O. Phân tích cấu trúc phân tử và giải thích lý do tại sao H2O có tính phân cực.
-
Bài Tập 7: Ảnh Hưởng của Tính Phân Cực Đến Tính Chất Hóa Học
Phân tích cách tính phân cực của một phân tử ảnh hưởng đến các tính chất hóa học của nó. Sử dụng ví dụ từ CH4 và các phân tử khác.
-
Bài Tập 8: Xác Định Tính Phân Cực Dựa Trên Góc Liên Kết
Tính toán góc liên kết trong phân tử CH4 và giải thích ảnh hưởng của góc liên kết đến tính phân cực của phân tử.
-
Bài Tập 9: Sự Khác Biệt Về Tính Phân Cực Trong Các Hợp Chất Hữu Cơ
Chọn ba hợp chất hữu cơ khác và phân tích sự khác biệt về tính phân cực giữa chúng và CH4.
-
Bài Tập 10: Tính Toán và Vẽ Cấu Trúc Phân Tử
Vẽ cấu trúc phân tử của CH4 và một số phân tử phân cực khác. Sử dụng các công thức hóa học để tính toán các đặc điểm cấu trúc.

Bài Tập 1: Tính Chất Phân Cực của CH4
Trong bài tập này, chúng ta sẽ khám phá tính chất phân cực của phân tử metan (CH4). Đây là một bài tập quan trọng giúp bạn hiểu rõ hơn về cấu trúc và tính chất của các phân tử trong hóa học.
1. Xác Định Cấu Trúc Phân Tử của CH4
Metan (CH4) là một phân tử có cấu trúc hình tứ diện. Để xác định cấu trúc này, hãy làm theo các bước sau:
- Xác định số lượng liên kết giữa nguyên tử carbon và các nguyên tử hydro.
- Vẽ cấu trúc Lewis của CH4 với các liên kết đơn giữa carbon và hydro.
- Chỉ ra rằng phân tử có hình dạng tứ diện với góc liên kết khoảng 109.5 độ.
2. Phân Tích Tính Phân Cực của CH4
Để phân tích tính phân cực của CH4, thực hiện các bước sau:
- Xác định điện tích của các nguyên tử trong phân tử.
- Kiểm tra sự đối xứng của phân tử. Với CH4, cấu trúc đối xứng dẫn đến sự phân phối điện tích đều.
- Giải thích lý do tại sao mặc dù có sự hiện diện của liên kết C-H, nhưng phân tử CH4 không có tính phân cực do cấu trúc đối xứng.
3. So Sánh với Các Phân Tử Khác
So sánh CH4 với một số phân tử khác như H2O (nước) để hiểu sự khác biệt về tính phân cực:
- CH4: Phân tử không phân cực do cấu trúc tứ diện đối xứng.
- H2O: Phân tử phân cực do cấu trúc góc và sự phân phối điện tích không đều.
4. Vẽ Cấu Trúc và Xác Định Tính Phân Cực
Vẽ cấu trúc phân tử của CH4 và chỉ ra các yếu tố ảnh hưởng đến tính phân cực:
| Phân Tử | Cấu Trúc | Tính Phân Cực |
|---|---|---|
| CH4 | Hình tứ diện | Không phân cực |
| H2O | Góc | Phân cực |
Hoàn thành bài tập này sẽ giúp bạn hiểu rõ hơn về các yếu tố ảnh hưởng đến tính phân cực của các phân tử và ứng dụng của chúng trong các lĩnh vực khác nhau.

Bài Tập 2: So Sánh Tính Phân Cực giữa CH4 và CO2
Trong bài tập này, chúng ta sẽ so sánh tính phân cực của hai phân tử: metan (CH4) và cacbon dioxide (CO2). Việc so sánh này sẽ giúp hiểu rõ hơn về sự ảnh hưởng của cấu trúc phân tử đến tính phân cực.
1. Cấu Trúc Phân Tử
Hãy phân tích cấu trúc của từng phân tử như sau:
-
CH4 (Metan):
- Cấu trúc phân tử là hình tứ diện với góc liên kết khoảng 109.5 độ.
- Phân tử có cấu trúc đối xứng với các liên kết C-H.
-
CO2 (Cacbon Dioxide):
- Cấu trúc phân tử là hình học tuyến tính với góc liên kết 180 độ.
- Phân tử có cấu trúc đối xứng với hai liên kết C=O.
2. Phân Tích Tính Phân Cực
Để hiểu tính phân cực của mỗi phân tử, thực hiện các bước sau:
-
CH4:
- Vì phân tử có cấu trúc tứ diện đối xứng, nên sự phân phối điện tích đều, dẫn đến tính không phân cực.
-
CO2:
- Dù có liên kết phân cực C=O, cấu trúc phân tử đối xứng tuyến tính dẫn đến phân phối điện tích đều, làm cho CO2 không phân cực.
3. So Sánh Chi Tiết
So sánh chi tiết giữa CH4 và CO2 dựa trên cấu trúc và tính phân cực:
| Phân Tử | Cấu Trúc | Tính Phân Cực |
|---|---|---|
| CH4 | Hình tứ diện | Không phân cực |
| CO2 | Tuyến tính | Không phân cực |
Qua bài tập này, bạn có thể thấy rằng tính phân cực của một phân tử không chỉ phụ thuộc vào sự phân cực của các liên kết mà còn bị ảnh hưởng mạnh mẽ bởi cấu trúc không gian của phân tử.

Bài Tập 3: Giải Thích Đặc Điểm Cấu Trúc Tứ Diện của CH4
Trong bài tập này, chúng ta sẽ phân tích cấu trúc tứ diện của phân tử metan (CH4) và giải thích các đặc điểm quan trọng của cấu trúc này. Đây là một bước quan trọng để hiểu về hình dạng phân tử và các liên kết hóa học.
1. Cấu Trúc Tứ Diện của CH4
Metan (CH4) có cấu trúc tứ diện, nghĩa là nguyên tử carbon nằm ở trung tâm và các nguyên tử hydro nằm ở các đỉnh của hình tứ diện. Cấu trúc này được đặc trưng bởi:
- Các liên kết C-H đều có độ dài bằng nhau.
- Góc liên kết giữa các liên kết C-H là khoảng 109.5 độ.
2. Cách Xây Dựng Cấu Trúc Tứ Diện
Để xây dựng cấu trúc tứ diện của CH4, thực hiện các bước sau:
- Xác định số lượng cặp electron liên kết của nguyên tử carbon với các nguyên tử hydro.
- Vẽ cấu trúc Lewis với bốn liên kết đơn C-H xung quanh nguyên tử carbon.
- Đặt nguyên tử carbon ở trung tâm và các nguyên tử hydro ở các đỉnh của hình tứ diện sao cho các liên kết có góc 109.5 độ.
3. Đặc Điểm Cấu Trúc Tứ Diện
Đặc điểm chính của cấu trúc tứ diện bao gồm:
- Đối Xứng: Cấu trúc đối xứng giúp phân phối đều điện tích và không tạo ra tính phân cực trong phân tử.
- Góc Liên Kết: Góc liên kết gần 109.5 độ giúp giảm sự va chạm giữa các cặp electron, tạo ra cấu trúc tứ diện ổn định.
4. Vẽ Mô Hình Cấu Trúc Tứ Diện
Vẽ mô hình cấu trúc tứ diện của CH4 để hiểu rõ hơn về hình dạng phân tử:
| Đặc Điểm | Thông Tin |
|---|---|
| Cấu Trúc | Tứ diện |
| Góc Liên Kết | 109.5 độ |
| Loại Liên Kết | Liên kết đơn C-H |
Bằng cách hiểu rõ về cấu trúc tứ diện của CH4, bạn có thể nắm bắt được các yếu tố ảnh hưởng đến hình dạng và tính chất của phân tử, từ đó ứng dụng kiến thức vào các bài tập hóa học khác.
XEM THÊM:
Bài Tập 4: Phân Tích Tính Chất Vật Lý của CH4
Trong bài tập này, chúng ta sẽ phân tích các tính chất vật lý của metan (CH4) để hiểu rõ hơn về các đặc điểm của phân tử này. Đây là bước quan trọng để đánh giá ảnh hưởng của cấu trúc phân tử đến tính chất vật lý của nó.
1. Tính Chất Vật Lý Cơ Bản của CH4
Metan là một khí không màu, không mùi, và không vị ở điều kiện thường. Dưới đây là các tính chất vật lý cơ bản của nó:
- Điểm Sôi: -161.5°C
- Điểm Nóng Chảy: -182.5°C
- Khối Lượng Phân Tử: 16.04 g/mol
- Mật Độ: 0.656 kg/m³ (ở 0°C và 1 atm)
- Khả Năng Tan: Metan không tan trong nước, nhưng tan trong một số dung môi hữu cơ như etanol và acetone.
2. Phân Tích Tính Chất Vật Lý Dựa Trên Cấu Trúc Phân Tử
Tính chất vật lý của CH4 có thể được giải thích dựa trên cấu trúc phân tử và liên kết hóa học:
- Khả Năng Bay Hơi: Do lực liên phân tử yếu (lực Van der Waals) trong metan, nó dễ dàng bay hơi ở nhiệt độ phòng.
- Tính Chất Khí: Vì phân tử metan không có tính phân cực và các lực liên phân tử yếu, nó tồn tại dưới dạng khí ở điều kiện tiêu chuẩn.
- Khả Năng Cháy: Metan dễ dàng cháy trong không khí và tạo ra khí carbon dioxide và nước, là một nguồn năng lượng quan trọng trong công nghiệp.
3. So Sánh Tính Chất Vật Lý của CH4 với Các Hydrocarbon Khác
So sánh metan với các hydrocarbon khác giúp làm rõ sự khác biệt về tính chất vật lý:
| Chất | Điểm Sôi (°C) | Điểm Nóng Chảy (°C) | Mật Độ (kg/m³) |
|---|---|---|---|
| Metan (CH4) | -161.5 | -182.5 | 0.656 |
| Etan (C2H6) | -88.6 | -183.3 | 1.356 |
| Propane (C3H8) | -42.1 | -187.7 | 1.882 |
Việc phân tích các tính chất vật lý của CH4 giúp chúng ta hiểu rõ hơn về sự tương tác của nó với môi trường và ứng dụng của nó trong thực tiễn.
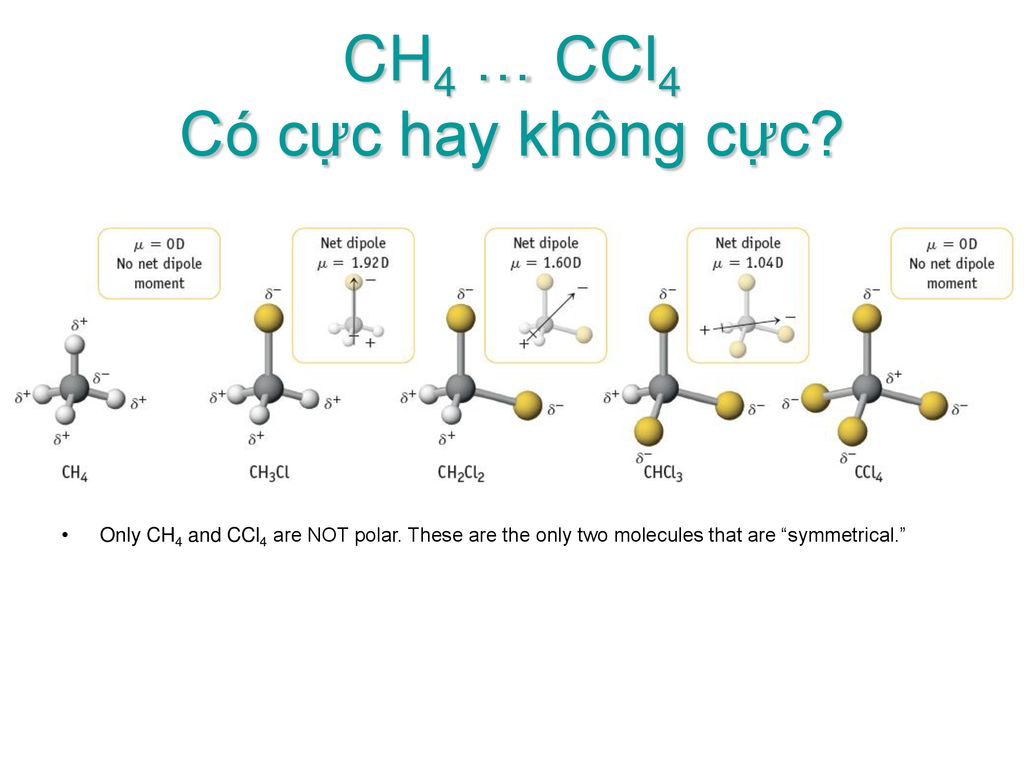
Bài Tập 5: Tính Phân Cực trong Các Phân Tử Hóa Học Khác
Trong bài tập này, chúng ta sẽ nghiên cứu tính phân cực của các phân tử hóa học khác để hiểu rõ hơn về sự khác biệt và tương đồng giữa chúng với metan (CH4). Tính phân cực của phân tử phụ thuộc vào cấu trúc phân tử và sự phân bố của các liên kết hóa học.
1. Xác Định Tính Phân Cực
Tính phân cực của một phân tử phụ thuộc vào sự phân bố của điện tích trong phân tử. Dưới đây là hướng dẫn từng bước để xác định tính phân cực của phân tử:
- Xác Định Hình Dạng Phân Tử: Sử dụng lý thuyết VSEPR để dự đoán hình dạng của phân tử.
- Xác Định Các Liên Kết: Xác định các liên kết trong phân tử và độ phân cực của từng liên kết.
- Đánh Giá Tính Phân Cực: Xem xét các yếu tố như độ phân cực của các liên kết và sự phân bố không đối xứng của các liên kết trong phân tử.
2. Các Ví Dụ Phân Tử
Dưới đây là một số ví dụ về các phân tử và tính phân cực của chúng:
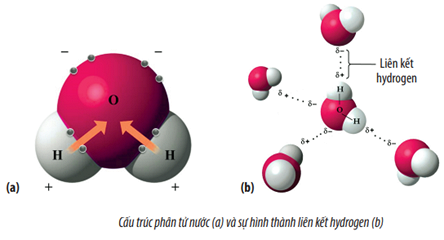
- Nước (H2O): Phân tử nước có hình dạng chữ V với góc liên kết khoảng 104.5°, dẫn đến tính phân cực cao do sự phân bố không đối xứng của các liên kết O-H.
- Carbon Dioxide (CO2): Dù có các liên kết phân cực, CO2 không phân cực vì phân tử có cấu trúc tuyến tính, khiến các lực phân cực đối xứng và triệt tiêu nhau.
- Ammonia (NH3): Phân tử ammonia có hình dạng hình chóp với góc liên kết khoảng 107°, dẫn đến tính phân cực cao do sự phân bố không đối xứng của các liên kết N-H.
3. So Sánh Tính Phân Cực
So sánh tính phân cực giữa các phân tử giúp chúng ta hiểu rõ hơn về ảnh hưởng của cấu trúc phân tử đến tính chất của nó:
| Phân Tử | Hình Dạng | Tính Phân Cực |
|---|---|---|
| H2O | Chữ V | Có |
| CO2 | Tuyến Tính | Không |
| NH3 | Hình Chóp | Có |
Việc phân tích tính phân cực của các phân tử giúp chúng ta hiểu được sự ảnh hưởng của cấu trúc phân tử đến các đặc điểm hóa học và vật lý của chúng.

Bài Tập 6: Ứng Dụng Của CH4 Trong Công Nghiệp
Metan (CH4) là một hợp chất quan trọng trong ngành công nghiệp nhờ vào nhiều ứng dụng đa dạng của nó. Dưới đây là các ứng dụng chính của CH4 trong công nghiệp:
1. Sản Xuất Nhiên Liệu
Metan chủ yếu được sử dụng làm nhiên liệu trong các hệ thống sưởi ấm, nấu ăn, và phát điện. Nó là thành phần chính của khí tự nhiên, được sử dụng rộng rãi do tính hiệu quả và dễ dàng sử dụng:
- Sưởi Ấm: CH4 được đốt để tạo ra nhiệt lượng trong hệ thống sưởi ấm trung tâm.
- Nấu Ăn: Metan được sử dụng trong bếp gas và các thiết bị nấu ăn khác.
- Phát Điện: CH4 được sử dụng trong các nhà máy điện để sản xuất điện năng.
2. Sản Xuất Hóa Chất
Metan là nguyên liệu quan trọng trong ngành công nghiệp hóa chất, đặc biệt trong sản xuất amoniac và metanol:
- Sản Xuất Amoniac: CH4 được sử dụng trong quá trình sản xuất amoniac (NH3) qua phản ứng Haber-Bosch.
- Sản Xuất Metanol: Metan được chuyển hóa thành metanol (CH3OH) thông qua phản ứng với carbon monoxide và nước.
3. Công Nghiệp Dược Phẩm
Trong ngành dược phẩm, metan có vai trò trong sản xuất các hợp chất hóa học cần thiết cho các loại thuốc và dược phẩm:
- Chế Tạo Hóa Chất: CH4 là nguyên liệu để sản xuất các hóa chất hữu cơ khác như ethylene và propylene, được sử dụng trong sản xuất thuốc.
- Điều Chế Các Hợp Chất Đặc Biệt: Metan được sử dụng để điều chế một số hợp chất đặc biệt cần thiết cho ngành dược phẩm.
4. Sản Xuất Nhựa và Cao Su
Metan cũng đóng vai trò quan trọng trong ngành công nghiệp sản xuất nhựa và cao su:
- Sản Xuất Nhựa: CH4 được sử dụng để sản xuất các loại nhựa tổng hợp như polyethylene và polypropylene.
- Sản Xuất Cao Su: Metan tham gia vào quá trình tổng hợp một số loại cao su tổng hợp dùng trong các ứng dụng công nghiệp.
5. Ứng Dụng Khác
Metan còn có một số ứng dụng khác trong công nghiệp:
- Chế Biến Thực Phẩm: CH4 được sử dụng trong một số quy trình chế biến thực phẩm và bảo quản thực phẩm.
- Ứng Dụng Môi Trường: Metan cũng được nghiên cứu và áp dụng trong các công nghệ xử lý khí thải và bảo vệ môi trường.
Nhờ vào tính chất và ứng dụng đa dạng, CH4 đóng vai trò quan trọng trong nhiều lĩnh vực công nghiệp và tiếp tục là một hợp chất thiết yếu trong sản xuất và công nghiệp hiện đại.
Bài Tập 7: So Sánh Các Phân Tử Phân Cực và Không Phân Cực
Để hiểu rõ hơn về tính phân cực của các phân tử, chúng ta cần so sánh các phân tử phân cực với những phân tử không phân cực. Dưới đây là các bước chi tiết và các ví dụ minh họa:
1. Định Nghĩa Phân Cực và Không Phân Cực
Phân Tử Phân Cực: Là phân tử có sự phân bố không đều của điện tích, dẫn đến việc có các cực âm và dương. Tính phân cực xảy ra khi có sự khác biệt về độ âm điện giữa các nguyên tử trong phân tử.
Phân Tử Không Phân Cực: Là phân tử không có sự phân bố không đều của điện tích, thường do sự đối xứng trong cấu trúc phân tử, dẫn đến việc không có cực âm hoặc dương rõ rệt.
2. Ví Dụ về Các Phân Tử Phân Cực
Các phân tử phân cực thường có cấu trúc bất đối xứng hoặc chứa các nguyên tử có độ âm điện khác nhau:
- H₂O (Nước): Phân tử nước có cấu trúc hình chóp với các nguyên tử oxy và hydro. Sự khác biệt về độ âm điện giữa oxy và hydro dẫn đến tính phân cực của phân tử nước.
- NH₃ (Amoniac): Phân tử amoniac có cấu trúc hình chóp với nguyên tử nitơ ở trung tâm và ba nguyên tử hydro. Tính phân cực của phân tử này cũng do sự khác biệt về độ âm điện giữa nitơ và hydro.
3. Ví Dụ về Các Phân Tử Không Phân Cực
Các phân tử không phân cực thường có cấu trúc đối xứng hoặc các nguyên tử trong phân tử có độ âm điện tương tự nhau:
- CH₄ (Metan): Phân tử metan có cấu trúc tứ diện đều, với các liên kết carbon-hydro phân bố đều. Do tính đối xứng của phân tử, metan không có tính phân cực.
- CO₂ (Carbon Dioxide): Phân tử carbon dioxide có cấu trúc tuyến tính với hai liên kết carbon-oxy. Mặc dù có sự phân cực trong từng liên kết, cấu trúc đối xứng của phân tử làm cho toàn bộ phân tử không phân cực.
4. So Sánh Các Tính Chất
Dưới đây là bảng so sánh giữa các phân tử phân cực và không phân cực:
| Loại Phân Tử | Cấu Trúc | Độ Âm Điện | Tính Phân Cực |
|---|---|---|---|
| Phân Tử Phân Cực | Bất đối xứng | Khác nhau giữa các nguyên tử | Có |
| Phân Tử Không Phân Cực | Đối xứng | Tương tự hoặc cấu trúc cân bằng | Không có |
Việc so sánh các phân tử phân cực và không phân cực giúp chúng ta hiểu rõ hơn về cách cấu trúc phân tử ảnh hưởng đến tính chất hóa học và vật lý của chúng.
Bài Tập 8: Tính Phân Cực và Đặc Điểm Hóa Học của H2O
Phân tử nước (H₂O) là một ví dụ điển hình về phân tử phân cực và có nhiều đặc điểm hóa học đặc biệt. Dưới đây là các bước và thông tin chi tiết về tính phân cực và đặc điểm hóa học của H₂O:
1. Tính Phân Cực của H₂O
Phân tử nước có cấu trúc phân tử hình chóp với góc liên kết khoảng 104.5°. Điều này dẫn đến sự phân bố không đều của điện tích trong phân tử, làm cho phân tử nước phân cực. Các nguyên tử oxy có độ âm điện cao hơn so với các nguyên tử hydro, dẫn đến phân cực trong liên kết O-H.
Công Thức Tính Độ Phân Cực:
Độ phân cực (\(\mu\)) của một phân tử được tính bằng công thức:
Trong đó:
- \( q \) là độ lớn của điện tích,
- \( d \) là khoảng cách giữa các cực.
2. Đặc Điểm Hóa Học của H₂O
Phân tử nước có nhiều đặc điểm hóa học quan trọng:
- Điểm Sôi và Điểm Nóng: Nước có điểm sôi cao (100°C) và điểm nóng chảy thấp (0°C) so với nhiều hợp chất khác có khối lượng phân tử tương tự. Điều này do liên kết hydro mạnh giữa các phân tử nước.
- Khả Năng Hòa Tan: Nước là dung môi phổ biến do khả năng hòa tan nhiều chất, đặc biệt là các chất phân cực và ion.
- Đặc Điểm Axit-Bazơ: Nước có thể hoạt động như một axit hoặc bazơ, theo lý thuyết Brønsted-Lowry. Ví dụ, nước có thể cho hoặc nhận proton trong các phản ứng hóa học.
3. Bảng So Sánh Đặc Điểm Hóa Học
| Đặc Điểm | Mô Tả |
|---|---|
| Điểm Sôi | 100°C |
| Điểm Nóng Chảy | 0°C |
| Khả Năng Hòa Tan | Rất cao đối với chất phân cực và ion |
| Đặc Điểm Axit-Bazơ | Có thể hoạt động như axit hoặc bazơ |
Việc hiểu tính phân cực và đặc điểm hóa học của nước giúp chúng ta hiểu rõ hơn về vai trò của nước trong các phản ứng hóa học và trong môi trường tự nhiên.
Bài Tập 9: Phân Tích Các Ứng Dụng Của Các Phân Tử Phân Cực
Các phân tử phân cực đóng vai trò quan trọng trong nhiều ứng dụng công nghiệp và sinh học. Dưới đây là phân tích chi tiết về ứng dụng của các phân tử phân cực:
1. Ứng Dụng Trong Công Nghiệp
Phân tử phân cực thường được sử dụng trong các quy trình công nghiệp như sau:
- Chất Tẩy Rửa: Các phân tử phân cực, chẳng hạn như các loại xà phòng và chất tẩy rửa, giúp hòa tan và loại bỏ các chất bẩn và dầu mỡ nhờ khả năng hòa tan trong nước và dầu.
- Chất Lỏng Điện Tử: Các dung môi phân cực như nước và dung môi hữu cơ phân cực được sử dụng trong các ứng dụng điện tử để hòa tan các hợp chất và làm mát các linh kiện điện tử.
- Phản Ứng Hóa Học: Trong các phản ứng hóa học, phân tử phân cực có thể hoạt động như chất xúc tác hoặc làm tăng hiệu suất phản ứng nhờ khả năng tương tác với các phân tử khác.
2. Ứng Dụng Trong Sinh Học
Các phân tử phân cực cũng có nhiều ứng dụng trong sinh học và y học:
- Quá Trình Sinh Học: Phân tử nước và các phân tử phân cực khác là thành phần thiết yếu trong nhiều quá trình sinh học, bao gồm enzyme và các quá trình trao đổi chất trong tế bào.
- Thuốc và Dược Phẩm: Nhiều loại thuốc và dược phẩm được thiết kế để tương tác với các phân tử phân cực trong cơ thể, giúp tăng cường hiệu quả điều trị.
- Phân Tích Sinh Học: Phân tử phân cực thường được sử dụng trong các kỹ thuật phân tích sinh học như sắc ký và điện di để tách và xác định các hợp chất sinh học.
3. Bảng So Sánh Ứng Dụng
| Loại Ứng Dụng | Phân Tử Phân Cực | Vai Trò |
|---|---|---|
| Công Nghiệp | Xà phòng, dung môi phân cực | Chất tẩy rửa, chất lỏng điện tử, xúc tác phản ứng |
| Sinh Học | Nước, thuốc, enzyme | Tham gia vào quá trình sinh học, điều trị bệnh, phân tích sinh học |
Nhờ tính chất phân cực của các phân tử, chúng có thể thực hiện nhiều chức năng quan trọng trong công nghiệp và sinh học. Hiểu biết về ứng dụng của chúng giúp tối ưu hóa quy trình và cải thiện hiệu quả trong nhiều lĩnh vực khác nhau.
Bài Tập 10: Giải Quyết Vấn Đề Tính Phân Cực Trong Các Tình Huống Thực Tế
Tính phân cực của các phân tử có ảnh hưởng sâu rộng đến nhiều ứng dụng thực tế. Dưới đây là cách giải quyết các vấn đề liên quan đến tính phân cực trong các tình huống thực tế:
1. Xử Lý Vấn Đề Trong Sản Xuất Chất Tẩy Rửa
Trong ngành sản xuất chất tẩy rửa, việc chọn lựa phân tử phân cực phù hợp là rất quan trọng để đạt được hiệu quả tối ưu:
- Chọn Lựa Thành Phần: Sử dụng các hợp chất phân cực để tạo ra sản phẩm có khả năng hòa tan tốt các chất bẩn và dầu mỡ.
- Thực Hiện Thử Nghiệm: Kiểm tra khả năng hòa tan của các phân tử trong nước và dung môi để đảm bảo hiệu quả tẩy rửa.
- Điều Chỉnh Công Thức: Tinh chỉnh tỷ lệ các thành phần để tối ưu hóa khả năng tẩy rửa và bảo vệ bề mặt.
2. Giải Quyết Vấn Đề Trong Phản Ứng Hóa Học
Khi làm việc với các phản ứng hóa học, tính phân cực có thể ảnh hưởng đến kết quả phản ứng:
- Chọn Dung Môi: Sử dụng dung môi phân cực hoặc không phân cực tùy thuộc vào loại phản ứng và các chất phản ứng.
- Điều Chỉnh Điều Kiện Phản Ứng: Tinh chỉnh nhiệt độ, áp suất và nồng độ để đạt được kết quả phản ứng mong muốn.
- Theo Dõi Kết Quả: Theo dõi và phân tích sản phẩm phản ứng để đảm bảo chất lượng và hiệu suất phản ứng.
3. Ứng Dụng Trong Công Nghiệp Thực Phẩm
Tính phân cực cũng ảnh hưởng đến việc lựa chọn thành phần trong ngành công nghiệp thực phẩm:
- Chọn Thành Phần: Sử dụng các phân tử phân cực trong các sản phẩm thực phẩm để cải thiện độ hòa tan và tính chất của thực phẩm.
- Kiểm Tra Độ Hòa Tan: Đảm bảo các thành phần phân cực hòa tan tốt trong các dung môi thực phẩm.
- Đảm Bảo An Toàn: Xác minh rằng các thành phần không gây phản ứng phụ hoặc ảnh hưởng đến chất lượng thực phẩm.
4. Bảng So Sánh Ứng Dụng
| Tình Huống | Ứng Dụng | Giải Quyết |
|---|---|---|
| Sản Xuất Chất Tẩy Rửa | Chất tẩy rửa | Chọn lựa thành phần phân cực, thử nghiệm và điều chỉnh công thức |
| Phản Ứng Hóa Học | Phản ứng hóa học | Chọn dung môi, điều chỉnh điều kiện phản ứng và theo dõi kết quả |
| Công Nghiệp Thực Phẩm | Thực phẩm và chế phẩm | Chọn thành phần, kiểm tra độ hòa tan và đảm bảo an toàn thực phẩm |
Việc hiểu rõ và áp dụng tính phân cực một cách chính xác trong các tình huống thực tế giúp cải thiện hiệu quả và chất lượng trong nhiều lĩnh vực khác nhau. Tinh thần chủ động và giải quyết vấn đề chính xác sẽ mang lại kết quả tốt nhất.