Chủ đề nước là dung môi phân cực hay không phân cực: Nước là dung môi phân cực hay không phân cực? Câu hỏi này không chỉ liên quan đến kiến thức hóa học cơ bản mà còn mở ra nhiều ứng dụng trong đời sống và công nghiệp. Bài viết sẽ giúp bạn hiểu rõ hơn về tính chất phân cực của nước và vai trò quan trọng của nó trong tự nhiên.
Mục lục
- Nước là dung môi phân cực hay không phân cực?
- Mục lục
- Bài tập Toán và Lý liên quan đến dung môi phân cực
- Bài tập 1: Tính độ phân cực của nước dựa trên mô hình tĩnh điện
- Bài tập 2: So sánh khả năng hòa tan của nước với các dung môi khác
- Bài tập 3: Tính toán nhiệt độ sôi của nước so với dung môi phân cực khác
- Bài tập 4: Ảnh hưởng của liên kết hydro đến nhiệt độ sôi của nước
- Bài tập 5: Xác định độ phân cực của các dung môi khác nhau bằng phương pháp thực nghiệm
- Bài tập 6: Giải thích hiện tượng mao dẫn của nước trong ống nhỏ
- Bài tập 7: Tính năng lượng cần thiết để phá vỡ liên kết hydro trong nước
- Bài tập 8: Tính toán độ nhớt của nước và các dung môi phân cực khác
- Bài tập 9: Tính toán năng lượng tương tác giữa các phân tử nước
- Bài tập 10: Phân tích tính chất nhiệt động lực học của nước
- Bài tập 1: Tính độ phân cực của nước dựa trên mô hình tĩnh điện
- Bài tập 2: So sánh khả năng hòa tan của nước với các dung môi khác
- Bài tập 3: Tính toán nhiệt độ sôi của nước so với dung môi phân cực khác
- Bài tập 4: Ảnh hưởng của liên kết hydro đến nhiệt độ sôi của nước
- Bài tập 5: Xác định độ phân cực của các dung môi khác nhau bằng phương pháp thực nghiệm
- Bài tập 6: Giải thích hiện tượng mao dẫn của nước trong ống nhỏ
- Bài tập 7: Tính năng lượng cần thiết để phá vỡ liên kết hydro trong nước
- Bài tập 8: Tính toán độ nhớt của nước và các dung môi phân cực khác
- Bài tập 9: Tính toán năng lượng tương tác giữa các phân tử nước
- Bài tập 10: Phân tích tính chất nhiệt động lực học của nước
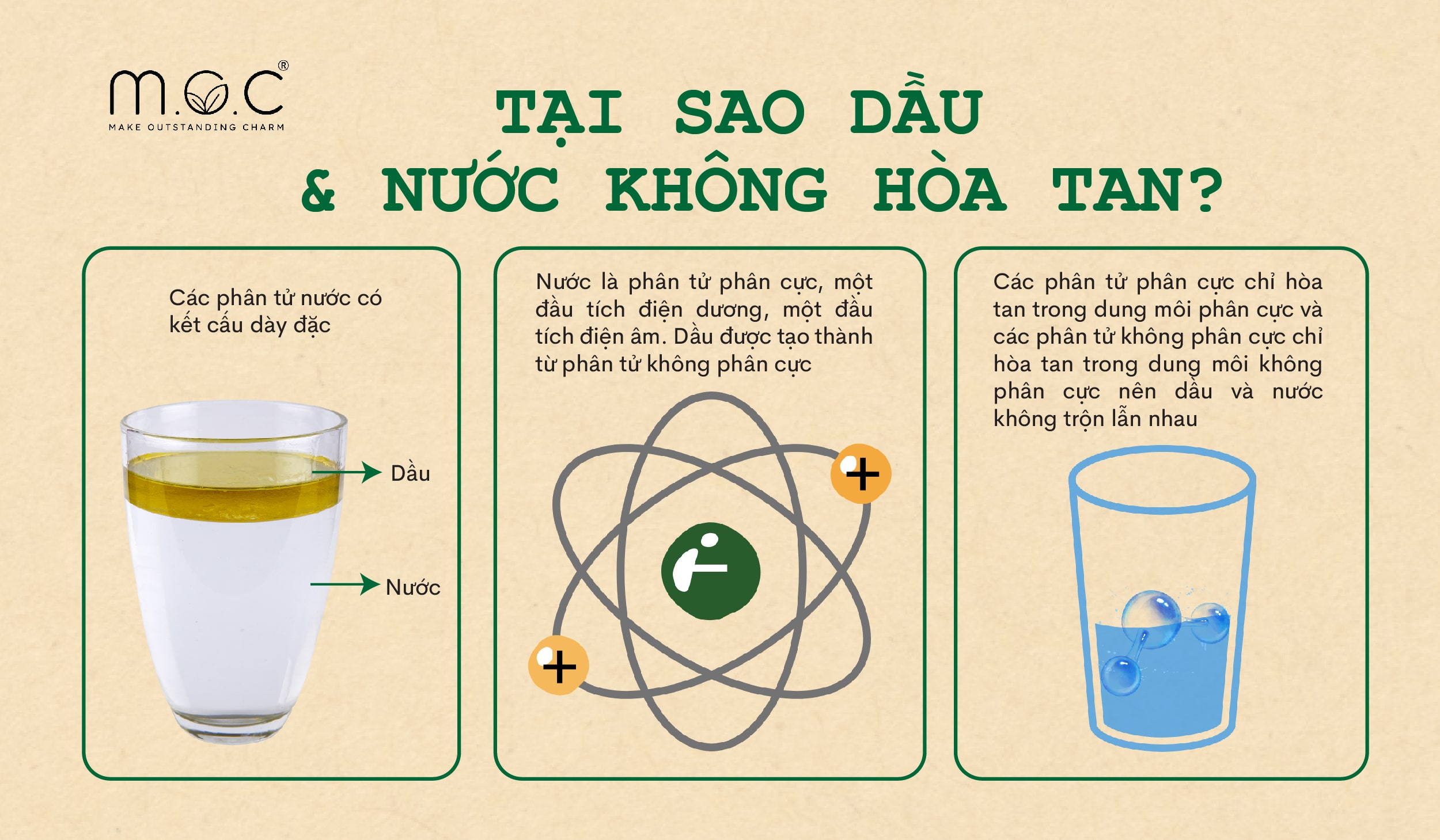
Nước là dung môi phân cực hay không phân cực?
Nước là một dung môi phân cực. Điều này là do cấu trúc phân tử của nước, trong đó nguyên tử oxy mang điện tích âm nhiều hơn so với hai nguyên tử hydro, tạo ra một sự phân bố không đều của điện tích. Tính chất phân cực này khiến nước có khả năng hòa tan nhiều chất khác nhau, đặc biệt là các hợp chất ion và các phân tử phân cực khác.
Phân cực của nước
Cấu trúc phân tử của nước có thể được biểu diễn dưới dạng ký hiệu hóa học \(\text{H}_2\text{O}\), với nguyên tử oxy liên kết với hai nguyên tử hydro. Nguyên tử oxy có độ âm điện cao hơn so với hydro, dẫn đến việc cặp electron dùng chung bị kéo về phía nguyên tử oxy, tạo ra một điện tích âm dọc theo oxy và một điện tích dương dọc theo các nguyên tử hydro.
- Tính phân cực này làm cho nước trở thành dung môi lý tưởng để hòa tan các chất ion và các hợp chất phân cực.
- Nước cũng có khả năng tạo ra các liên kết hydro, đóng vai trò quan trọng trong nhiều phản ứng sinh hóa.
Ví dụ về dung môi phân cực
Các dung môi phân cực phổ biến bao gồm:
- Nước \(\text{H}_2\text{O}\)
- Acetone \(\text{CH}_3\text{COCH}_3\)
- Methanol \(\text{CH}_3\text{OH}\)
- Ethanol \(\text{C}_2\text{H}_5\text{OH}\)
Ứng dụng của nước làm dung môi
- Nước là dung môi quan trọng trong các quá trình sinh học như trao đổi chất và vận chuyển chất dinh dưỡng trong cơ thể.
- Trong công nghiệp, nước được sử dụng làm dung môi trong các quá trình phản ứng hóa học và làm mát.
- Nước còn được dùng trong nông nghiệp để pha trộn các loại phân bón và thuốc trừ sâu.
Kết luận
Nước là một dung môi phân cực có vai trò vô cùng quan trọng trong cả các quá trình sinh học và công nghiệp. Tính phân cực của nước giúp nó hòa tan được nhiều loại chất khác nhau, hỗ trợ cho các quá trình phản ứng hóa học và sinh học diễn ra hiệu quả.

.png)
Mục lục
Nước là dung môi phân cực hay không phân cực? Giải thích cơ bản
Cấu trúc phân tử nước và tính phân cực
Vai trò của nước trong các phản ứng hóa học
So sánh giữa dung môi phân cực và không phân cực
Ứng dụng của nước trong công nghiệp và đời sống
Cách xác định dung môi phân cực và không phân cực trong phòng thí nghiệm
Nước và liên kết hydro: Tác động đến tính phân cực
Các dung môi phân cực khác ngoài nước
Các yếu tố ảnh hưởng đến tính phân cực của dung môi
Ứng dụng của nước trong nông nghiệp và y tế
Bài tập Toán và Lý liên quan đến dung môi phân cực
Dưới đây là một số bài tập toán và lý liên quan đến dung môi phân cực, đặc biệt là nước, giúp bạn nắm vững kiến thức về tính chất phân cực của các dung môi trong hóa học và vật lý.

Bài tập 1: Tính độ phân cực của nước dựa trên mô hình tĩnh điện
Cho rằng mô hình tĩnh điện của nước được biểu diễn dưới dạng một tam giác cân với góc H-O-H bằng 104.5°. Tính mômen lưỡng cực của phân tử nước khi biết độ dài liên kết O-H là 0.958 Å và độ âm điện của H và O lần lượt là 2.20 và 3.44.
- Xác định độ phân cực từng liên kết O-H.
- Tính tổng hợp vectơ của hai mômen lưỡng cực để tìm mômen lưỡng cực của phân tử nước.
- Biểu diễn kết quả bằng đơn vị Debye.

Bài tập 2: So sánh khả năng hòa tan của nước với các dung môi khác
Cho một số chất hòa tan như muối, đường, dầu và bột mì. Xác định khả năng hòa tan của các chất này trong nước và các dung môi khác như hexane và ethanol.
- Giải thích hiện tượng phân cực trong quá trình hòa tan.
- So sánh độ tan của từng chất trong mỗi dung môi và giải thích kết quả.

Bài tập 3: Tính toán nhiệt độ sôi của nước so với dung môi phân cực khác
So sánh nhiệt độ sôi của nước với các dung môi phân cực khác như methanol, ethanol và propanol.
- Tính toán nhiệt độ sôi lý thuyết của mỗi dung môi dựa trên liên kết hydro và các lực tương tác phân tử khác.
- So sánh các kết quả tính toán với giá trị thực nghiệm và giải thích sự chênh lệch.
XEM THÊM:
Bài tập 4: Ảnh hưởng của liên kết hydro đến nhiệt độ sôi của nước
Xem xét tác động của liên kết hydro đến nhiệt độ sôi của nước và các dung môi phân cực khác.
- Giải thích cách liên kết hydro ảnh hưởng đến lực liên kết giữa các phân tử nước.
- So sánh với các dung môi khác không có liên kết hydro.

Bài tập 5: Xác định độ phân cực của các dung môi khác nhau bằng phương pháp thực nghiệm
Sử dụng phương pháp thực nghiệm để xác định độ phân cực của các dung môi như nước, acetone và chloroform.
- Thiết lập thiết bị đo mômen lưỡng cực.
- Thực hiện thí nghiệm và ghi nhận kết quả.
- Phân tích và so sánh độ phân cực của từng dung môi.

Bài tập 6: Giải thích hiện tượng mao dẫn của nước trong ống nhỏ
Cho một ống mao dẫn có đường kính 0.5 mm đặt trong một bát nước. Tính độ cao mà nước dâng lên trong ống do hiện tượng mao dẫn.
- Sử dụng công thức \[h = \frac{2\gamma \cos{\theta}}{r\rho g}\] trong đó:
- \(h\) là chiều cao cột nước.
- \(\gamma\) là sức căng bề mặt của nước.
- \(\theta\) là góc tiếp xúc giữa nước và thành ống.
- \(r\) là bán kính ống mao dẫn.
- \(\rho\) là khối lượng riêng của nước.
- \(g\) là gia tốc trọng trường.
- Tính giá trị \(\theta\) với điều kiện ống hoàn toàn ướt.
- So sánh kết quả với thí nghiệm thực tế.
Bài tập 7: Tính năng lượng cần thiết để phá vỡ liên kết hydro trong nước
Xác định năng lượng cần thiết để phá vỡ tất cả các liên kết hydro trong 1 mol nước.
- Tính toán dựa trên giá trị năng lượng liên kết hydro là khoảng 21 kJ/mol.
- So sánh với năng lượng cần thiết để phá vỡ liên kết trong các dung môi phân cực khác.

Bài tập 8: Tính toán độ nhớt của nước và các dung môi phân cực khác
Đo và so sánh độ nhớt của nước, ethanol và glycerol ở nhiệt độ phòng.
- Sử dụng phương trình Poiseuille để tính độ nhớt: \[\eta = \frac{\Delta P \cdot \pi \cdot r^4}{8 \cdot L \cdot Q}\]
- Xác định các yếu tố \(\Delta P\) (áp suất chênh lệch), \(r\) (bán kính ống), \(L\) (chiều dài ống), và \(Q\) (tốc độ dòng chảy).
- So sánh kết quả đo được với các giá trị thực nghiệm trong tài liệu.
Bài tập 9: Tính toán năng lượng tương tác giữa các phân tử nước
Sử dụng mô hình Lennard-Jones để tính toán năng lượng tương tác giữa hai phân tử nước.
- Sử dụng công thức Lennard-Jones: \[U(r) = 4\epsilon \left[\left(\frac{\sigma}{r}\right)^{12} - \left(\frac{\sigma}{r}\right)^6\right]\]
- Xác định các hằng số \(\epsilon\) và \(\sigma\) cho phân tử nước.
- So sánh với năng lượng tương tác giữa các phân tử của dung môi khác.
Bài tập 10: Phân tích tính chất nhiệt động lực học của nước
Xác định các thông số nhiệt động lực học của nước như enthalpy, entropy và nhiệt dung riêng.
- Sử dụng các phương trình nhiệt động để tính toán: \[ \Delta H = \Delta U + P\Delta V \] \[ \Delta S = \frac{\Delta Q}{T} \]
- Tính toán các giá trị này ở nhiệt độ phòng.
- So sánh với các giá trị thực nghiệm để kiểm chứng.
Bài tập 1: Tính độ phân cực của nước dựa trên mô hình tĩnh điện
Để tính độ phân cực của nước, chúng ta có thể dựa trên mô hình tĩnh điện của phân tử nước. Phân tử nước (H2O) có cấu trúc gấp khúc, với nguyên tử oxy nằm ở giữa và hai nguyên tử hydro ở hai đầu, tạo thành một góc khoảng 104.5°.
Trong phân tử nước, oxy có độ âm điện cao hơn hydro, nên cặp electron trong liên kết O-H bị kéo lệch về phía oxy, tạo nên một sự phân bố điện tích không đồng đều. Điều này khiến oxy mang điện tích âm (\(\delta^-\)), còn các nguyên tử hydro mang điện tích dương (\(\delta^+\)). Sự phân bố này dẫn đến việc nước trở thành một phân tử phân cực.
Để xác định độ phân cực, chúng ta tính toán momen lưỡng cực (\(\mu\)) của nước bằng công thức:
\[\mu = q \times d\]
Trong đó:
- \(q\) là điện tích của các nguyên tử (điện tích của proton hoặc electron, thường lấy giá trị là \(1.6 \times 10^{-19}\) coulomb).
- \(d\) là khoảng cách giữa tâm của các điện tích (được đo bằng angstrom, 1 angstrom = \(10^{-10}\) mét).
Đối với phân tử nước, giá trị momen lưỡng cực là khoảng \(1.85\) debye, cho thấy mức độ phân cực khá cao. Điều này giải thích tại sao nước có khả năng hòa tan mạnh các chất phân cực khác và là một dung môi rất hiệu quả trong các phản ứng hóa học và sinh học.
Việc tính toán cụ thể momen lưỡng cực có thể thực hiện thông qua việc đo đạc thực nghiệm hoặc sử dụng các phần mềm mô phỏng tĩnh điện, trong đó xem xét các lực tương tác giữa các phân tử và liên kết hydro.
Bài tập 2: So sánh khả năng hòa tan của nước với các dung môi khác
Khi so sánh khả năng hòa tan của nước với các dung môi khác, ta cần xem xét tính chất phân cực của từng dung môi. Nước, với cấu trúc phân cực mạnh, có khả năng hòa tan tốt nhiều chất phân cực khác, đặc biệt là các ion và hợp chất có nhóm hydroxyl (-OH), amin (-NH2), hoặc cacboxyl (-COOH).
Để so sánh chi tiết, ta có thể xét một số ví dụ cụ thể như sau:
- Nước hòa tan muối NaCl rất tốt nhờ vào tính chất phân cực của nó, các phân tử nước tương tác mạnh với ion Na+ và Cl-, giúp phá vỡ liên kết ion trong muối.
- Trong khi đó, hexan (C6H14), một dung môi không phân cực, không thể hòa tan NaCl do thiếu lực tương tác với các ion.
- Cồn etanol (C2H5OH), một dung môi phân cực nhẹ, có khả năng hòa tan một số hợp chất phân cực như đường nhưng không hòa tan được tốt các ion như nước.
Để tính toán khả năng hòa tan, ta có thể sử dụng mô hình tĩnh điện đơn giản, mô tả qua biểu thức:
Trong đó:
- \(E\) là năng lượng tương tác giữa các phân tử dung môi và chất tan.
- \(q_1\) và \(q_2\) là điện tích của các ion hoặc phân tử.
- \(r\) là khoảng cách giữa các phân tử.
Khi giá trị \(E\) lớn, khả năng hòa tan sẽ cao hơn, điều này giải thích vì sao nước có thể hòa tan tốt các hợp chất phân cực và ion.
Bài tập 3: Tính toán nhiệt độ sôi của nước so với dung môi phân cực khác
Trong bài tập này, chúng ta sẽ tính toán và so sánh nhiệt độ sôi của nước với một số dung môi phân cực khác. Nhiệt độ sôi của một chất lỏng phụ thuộc vào lực liên kết giữa các phân tử, mà cụ thể ở đây là các liên kết hydro trong nước và các tương tác phân tử khác trong các dung môi phân cực khác.
Hãy thực hiện các bước sau:
- Xác định các thông số cần thiết:
- Nhiệt độ sôi của nước \((T_{b, H_2O}) = 100^\circ C\).
- Nhiệt độ sôi của một dung môi phân cực khác, ví dụ như ethanol \((T_{b, C_2H_5OH}) = 78.37^\circ C\).
- Các hằng số khác có liên quan như năng lượng liên kết hydro trong nước và ethanol.
- Áp dụng công thức nhiệt động lực học:
Để tính toán nhiệt độ sôi lý thuyết, ta có thể sử dụng phương trình Clausius-Clapeyron:
\[ \frac{dP}{dT} = \frac{\Delta H_{vap}}{T \cdot \Delta V} \]Trong đó:
- \(\Delta H_{vap}\) là enthalpy hóa hơi (nhiệt hóa hơi),
- \(T\) là nhiệt độ tuyệt đối (K),
- \(\Delta V\) là thay đổi thể tích khi chuyển từ pha lỏng sang pha khí.
- So sánh nhiệt độ sôi:
Sau khi tính toán nhiệt độ sôi cho cả hai chất, ta nhận thấy rằng nước có nhiệt độ sôi cao hơn ethanol do liên kết hydro mạnh hơn, yêu cầu nhiều năng lượng hơn để phá vỡ các liên kết này so với ethanol. Điều này lý giải vì sao nước có nhiệt độ sôi cao hơn.
Kết luận: Nước có nhiệt độ sôi cao hơn so với nhiều dung môi phân cực khác như ethanol do các liên kết hydro mạnh mẽ giữa các phân tử nước. Điều này làm cho nước trở thành một dung môi đặc biệt trong nhiều ứng dụng hóa học và công nghiệp.
Bài tập 4: Ảnh hưởng của liên kết hydro đến nhiệt độ sôi của nước
Liên kết hydro là một loại liên kết mạnh mẽ và đặc biệt quan trọng trong cấu trúc của nước. Khi nước chuyển từ trạng thái lỏng sang trạng thái khí, các phân tử nước phải vượt qua lực hút mạnh mẽ của các liên kết hydro giữa các phân tử. Đây chính là lý do tại sao nước có nhiệt độ sôi cao hơn so với nhiều chất lỏng khác.
Trong các bài tập hóa học, việc hiểu rõ về ảnh hưởng của liên kết hydro giúp ta có cái nhìn sâu sắc hơn về đặc tính của nước như nhiệt độ sôi, sức căng bề mặt, và độ nhớt. Để hiểu rõ hơn, hãy xem xét các yếu tố sau đây:
- Cấu trúc phân tử nước: Phân tử nước có cấu trúc góc với góc liên kết H-O-H khoảng 104.5°. Mỗi phân tử nước có thể hình thành bốn liên kết hydro với các phân tử nước lân cận, tạo thành một mạng lưới liên kết phức tạp.
- Liên kết hydro và nhiệt độ sôi: Nước là dung môi phân cực với các nguyên tử hydro liên kết với nguyên tử oxy, tạo nên các liên kết hydro. Khi đun nóng, năng lượng nhiệt được cung cấp để phá vỡ các liên kết hydro này. Vì mỗi phân tử nước liên kết với nhiều phân tử khác qua liên kết hydro, nhiệt độ cần thiết để làm bay hơi nước (đưa phân tử ra khỏi pha lỏng) cao hơn so với các chất lỏng không có liên kết hydro mạnh.
- So sánh với các chất lỏng khác: Nhiều dung môi khác như \(\text{CH}_3\text{OH}\) (methanol) hoặc \(\text{C}_2\text{H}_5\text{OH}\) (ethanol) cũng có liên kết hydro, nhưng nhiệt độ sôi của chúng vẫn thấp hơn so với nước. Điều này là do sự khác biệt trong số lượng và cường độ của các liên kết hydro mà các phân tử có thể hình thành.
Như vậy, liên kết hydro không chỉ đóng vai trò quan trọng trong việc xác định nhiệt độ sôi của nước mà còn ảnh hưởng đến nhiều tính chất vật lý khác của nước. Hiểu biết về điều này giúp chúng ta giải thích được các hiện tượng tự nhiên và ứng dụng của nước trong đời sống và công nghiệp.
Bài tập 5: Xác định độ phân cực của các dung môi khác nhau bằng phương pháp thực nghiệm
Trong bài tập này, chúng ta sẽ tiến hành xác định độ phân cực của một số dung môi khác nhau bằng phương pháp thực nghiệm. Mục tiêu của bài học là hiểu rõ hơn về tính chất phân cực của các dung môi và cách chúng tương tác với các chất tan khác nhau.
- Chuẩn bị dụng cụ và hóa chất:
- Một số dung môi phổ biến như nước, ethanol, acetone, hexane.
- Một vài chất tan như muối ăn (NaCl), đường (C6H12O6).
- Ống nghiệm, pipet, cốc thủy tinh, và cân tiểu ly.
- Tiến hành thí nghiệm:
- Cho một lượng cố định chất tan (ví dụ: muối hoặc đường) vào ống nghiệm.
- Thêm một lượng dung môi vào ống nghiệm (ví dụ: nước).
- Khuấy đều dung dịch và quan sát sự hòa tan của chất tan trong dung môi.
- Lặp lại các bước trên với các dung môi và chất tan khác nhau.
- Ghi chép kết quả:
Ghi lại hiện tượng xảy ra khi hòa tan chất tan trong các dung môi khác nhau. Ví dụ:
Dung môi Chất tan Kết quả Nước Muối ăn Hoàn toàn hòa tan Hexane Muối ăn Không hòa tan Ethanol Đường Hoàn toàn hòa tan - Kết luận:
Qua thí nghiệm, chúng ta có thể rút ra kết luận rằng các dung môi phân cực như nước dễ dàng hòa tan các chất phân cực như muối ăn do các lực tương tác giữa các phân tử mạnh. Trong khi đó, các dung môi không phân cực như hexane không hòa tan các chất phân cực, cho thấy sự khác biệt trong tính chất hóa học giữa các loại dung môi.
Bài tập 6: Giải thích hiện tượng mao dẫn của nước trong ống nhỏ
Hiện tượng mao dẫn là một hiện tượng quan trọng trong hóa học và sinh học, đặc biệt liên quan đến sự di chuyển của nước trong các ống nhỏ hoặc trong các cấu trúc tự nhiên như cây cối.
Hiện tượng này xảy ra khi nước di chuyển lên hoặc xuống trong các ống nhỏ dưới tác động của lực hấp dẫn và lực bám giữa các phân tử nước với bề mặt ống. Lực tương tác giữa các phân tử nước với nhau (liên kết hydro) và với bề mặt của ống dẫn đến sự tạo thành một cột nước bên trong ống. Sự tương tác này tạo ra hai lực chính:
- Lực kết dính (Adhesion): Là lực giữa các phân tử nước và bề mặt của ống, lực này giúp nước bám chặt vào thành ống, tạo điều kiện cho nước di chuyển lên hoặc xuống theo ống.
- Lực dính kết (Cohesion): Là lực giữa các phân tử nước với nhau thông qua liên kết hydro, giúp nước duy trì cột nước và không bị đứt đoạn.
Do đó, khi một ống nhỏ được đặt trong nước, lực kết dính giữa các phân tử nước và bề mặt ống sẽ kéo nước lên theo ống, trong khi lực dính kết giữa các phân tử nước giúp duy trì sự liên tục của cột nước. Hiện tượng này đặc biệt rõ rệt trong các ống có đường kính rất nhỏ, chẳng hạn như trong mao mạch của cây, nơi nước được kéo từ rễ lên lá một cách hiệu quả.
Mao dẫn là một hiện tượng minh chứng rõ ràng cho tính phân cực của nước. Nước là một dung môi phân cực mạnh do sự chênh lệch điện tích giữa nguyên tử oxy và hydro trong phân tử nước. Chính tính phân cực này tạo điều kiện cho liên kết hydro và từ đó hiện tượng mao dẫn trở nên khả thi.
Bằng cách sử dụng các ống có kích thước khác nhau, bạn có thể thực hiện các thí nghiệm đơn giản để quan sát hiện tượng mao dẫn và từ đó hiểu rõ hơn về sự phân cực và các lực tương tác trong dung dịch.
Bài tập 7: Tính năng lượng cần thiết để phá vỡ liên kết hydro trong nước
Liên kết hydro trong phân tử nước đóng vai trò quan trọng trong việc duy trì cấu trúc và tính chất của nước. Để phá vỡ liên kết hydro, ta cần cung cấp một lượng năng lượng nhất định.
Liên kết hydro hình thành do sự tương tác giữa nguyên tử hydro có điện tích dương nhỏ và nguyên tử oxy có điện tích âm nhỏ trong phân tử nước. Để phá vỡ liên kết này, năng lượng cần thiết là năng lượng liên kết trung bình của liên kết hydro, thường được đo bằng đơn vị kJ/mol.
Chúng ta có thể tính toán năng lượng cần thiết để phá vỡ tất cả các liên kết hydro trong một lượng nước nhất định bằng cách nhân số mol của nước với năng lượng trung bình cần thiết để phá vỡ một liên kết hydro.
- Giả sử có \(n\) mol nước, và năng lượng trung bình để phá vỡ một liên kết hydro là \(E_{hb}\) kJ/mol.
- Năng lượng tổng cộng cần thiết để phá vỡ tất cả các liên kết hydro trong \(n\) mol nước là:
Vì mỗi phân tử nước có thể hình thành tối đa bốn liên kết hydro, ta cần nhân kết quả trên với hệ số này nếu muốn tính năng lượng cần thiết cho tất cả các liên kết hydro:
Ví dụ, nếu bạn có 1 mol nước và năng lượng để phá vỡ một liên kết hydro là 20 kJ/mol, thì năng lượng cần thiết để phá vỡ tất cả các liên kết hydro trong 1 mol nước là:
Bài tập này giúp chúng ta hiểu rõ hơn về tính chất của liên kết hydro trong nước, cũng như tầm quan trọng của nó trong việc duy trì các tính chất độc đáo của nước.
Bài tập 8: Tính toán độ nhớt của nước và các dung môi phân cực khác
Độ nhớt là một tính chất quan trọng của chất lỏng, thể hiện lực cản của chất lỏng đối với dòng chảy. Nước, một dung môi phân cực mạnh, có độ nhớt tương đối thấp so với nhiều dung môi khác. Để tính toán độ nhớt của nước và các dung môi phân cực khác, chúng ta cần xem xét các yếu tố như nhiệt độ, áp suất, và cấu trúc phân tử.
Một trong những phương trình cơ bản để tính toán độ nhớt là phương trình Hagen-Poiseuille cho dòng chảy qua ống tròn:
Trong đó:
- \(\eta\): Độ nhớt của chất lỏng (Pa·s)
- \(\Delta P\): Sự chênh lệch áp suất giữa hai đầu ống (Pa)
- \(r\): Bán kính ống (m)
- \(L\): Chiều dài ống (m)
- \(Q\): Lưu lượng dòng chảy (m3/s)
Nước, với hằng số điện môi cao (khoảng 80,1 ở nhiệt độ phòng), thể hiện tính phân cực mạnh, làm cho nó có khả năng hòa tan nhiều chất phân cực khác. Điều này ảnh hưởng đến độ nhớt của nước so với các dung môi phân cực khác như methanol hay ethanol, vì cấu trúc phân tử và lực tương tác giữa các phân tử có sự khác biệt.
Ví dụ, ở 20°C, độ nhớt của nước là khoảng 1,002 mPa·s, trong khi độ nhớt của methanol và ethanol lần lượt là 0,544 mPa·s và 1,074 mPa·s. Sự khác biệt này xuất phát từ cấu trúc phân tử của mỗi dung môi và cách các phân tử tương tác với nhau.
Để tính toán cụ thể độ nhớt của một dung môi phân cực khác, ta cần biết các thông số cụ thể như nhiệt độ, áp suất, và các đặc tính vật lý của dung môi đó.
Hãy bắt đầu từ việc đo lường các giá trị thực nghiệm như lưu lượng dòng chảy và áp suất, sau đó áp dụng vào phương trình Hagen-Poiseuille để tính độ nhớt. Bằng cách so sánh độ nhớt của nước với các dung môi phân cực khác, chúng ta có thể hiểu rõ hơn về tính chất và ứng dụng của từng loại dung môi trong các ngành công nghiệp khác nhau.
Bài tập 9: Tính toán năng lượng tương tác giữa các phân tử nước
Nước là một dung môi phân cực, điều này có nghĩa là các phân tử nước có một cực dương và một cực âm, làm cho chúng có khả năng tương tác mạnh mẽ với nhau thông qua các lực tĩnh điện. Để tính toán năng lượng tương tác giữa các phân tử nước, chúng ta cần xem xét các yếu tố sau:
- Hằng số điện môi của nước: Hằng số điện môi của nước ở nhiệt độ phòng là khoảng \( \epsilon_r = 78.5 \). Giá trị này ảnh hưởng đến khả năng tương tác của các phân tử nước, làm tăng cường các lực hút tĩnh điện giữa các phân tử.
- Khoảng cách giữa các phân tử nước: Năng lượng tương tác tĩnh điện giữa hai phân tử nước tỉ lệ nghịch với khoảng cách giữa chúng. Khoảng cách trung bình giữa các phân tử nước có thể ước tính thông qua mật độ của nước.
- Năng lượng liên kết hydro: Nước có khả năng hình thành các liên kết hydro, một trong những lực liên phân tử mạnh mẽ nhất. Năng lượng của một liên kết hydro giữa hai phân tử nước thường được ước tính là khoảng \( 20 \, \text{kJ/mol} \).
- Công thức tính năng lượng tương tác: Năng lượng tương tác giữa hai phân tử nước có thể tính theo công thức:
\[
E = - \frac{q_1 q_2}{4 \pi \epsilon_0 \epsilon_r r}
\]
trong đó:
- \( q_1, q_2 \) là điện tích của các phân tử nước.
- \( r \) là khoảng cách giữa các phân tử.
- \( \epsilon_0 \) là hằng số điện môi trong chân không.
- \( \epsilon_r \) là hằng số điện môi của nước.
- Áp dụng vào thực tế: Để thực hiện bài tập này, bạn cần xác định các thông số như hằng số điện môi, khoảng cách giữa các phân tử nước và điện tích của chúng. Sau đó, áp dụng công thức trên để tính toán năng lượng tương tác.
Kết quả sẽ cho bạn cái nhìn sâu sắc về mức độ tương tác giữa các phân tử nước, giúp hiểu rõ hơn về các tính chất vật lý của nước cũng như vai trò của nó như một dung môi phân cực mạnh.
Bài tập 10: Phân tích tính chất nhiệt động lực học của nước
Nước là một dung môi phân cực, đóng vai trò quan trọng trong nhiều quá trình nhiệt động lực học tự nhiên và nhân tạo. Đặc tính phân cực của nước bắt nguồn từ sự phân bố không đồng đều của các electron trong liên kết O-H, dẫn đến sự phân chia điện tích trong phân tử.
Trong các quá trình nhiệt động lực học, tính chất phân cực của nước ảnh hưởng đến nhiều yếu tố như:
- Khả năng hoà tan: Nhờ tính phân cực, nước có thể hòa tan nhiều chất khác nhau, đặc biệt là các chất có tính phân cực hoặc ion, tạo ra các dung dịch đồng nhất. Điều này rất quan trọng trong các quá trình hóa học và sinh học.
- Liên kết hydrogen: Nước có khả năng tạo liên kết hydrogen mạnh mẽ, điều này ảnh hưởng đến nhiệt độ sôi, nhiệt độ nóng chảy, và nhiệt độ bay hơi của nước. Những tính chất này là những yếu tố quan trọng trong các quá trình nhiệt động lực học.
- Áp suất hơi: Tính phân cực của nước cùng với khả năng tạo liên kết hydrogen dẫn đến áp suất hơi thấp hơn so với các dung môi không phân cực có khối lượng phân tử tương tự.
- Nhiệt dung riêng: Nước có nhiệt dung riêng cao, điều này giúp nước hấp thụ và tỏa nhiệt chậm, ổn định nhiệt độ trong các hệ thống nhiệt động lực học.
Từ các tính chất trên, có thể thấy nước không chỉ là dung môi quan trọng mà còn đóng vai trò điều chỉnh và ổn định trong nhiều hệ thống nhiệt động lực học. Việc hiểu rõ và phân tích các tính chất này sẽ giúp chúng ta ứng dụng nước hiệu quả hơn trong các lĩnh vực công nghệ và khoa học.