Chủ đề cộng hóa trị phân cực là gì: Cộng hóa trị phân cực là một khái niệm quan trọng trong hóa học, ảnh hưởng đến cấu trúc và tính chất của nhiều hợp chất hóa học. Bài viết này sẽ giúp bạn hiểu rõ cộng hóa trị phân cực là gì, cơ chế hình thành, và cách áp dụng kiến thức này vào các lĩnh vực thực tế như dược phẩm, công nghệ vật liệu, và đời sống hàng ngày.
Mục lục
- Khái niệm về Liên Kết Ion trong Hóa Học
- 1. Khái niệm về cộng hóa trị phân cực
- 2. Nguyên nhân và cơ chế hình thành liên kết cộng hóa trị phân cực
- 3. Ứng dụng của liên kết cộng hóa trị phân cực trong đời sống
- 4. Cách nhận biết liên kết cộng hóa trị phân cực trong thực tế
- 5. Mối liên hệ giữa liên kết cộng hóa trị phân cực và độ tan của các chất
- 6. Các dạng bài tập về cộng hóa trị phân cực
Khái niệm về Liên Kết Ion trong Hóa Học
Liên kết ion là một loại liên kết hóa học được hình thành giữa hai nguyên tử khi một nguyên tử nhường electron cho nguyên tử kia, tạo ra hai ion có điện tích trái dấu và chúng hút nhau mạnh mẽ nhờ lực tĩnh điện. Đây là loại liên kết thường thấy trong các hợp chất giữa kim loại và phi kim.
Quá Trình Hình Thành Liên Kết Ion
- Liên kết ion được hình thành khi có sự chuyển giao hoàn toàn electron từ nguyên tử này sang nguyên tử khác. Ví dụ, trong phân tử NaCl (natri clorua), nguyên tử natri (Na) nhường 1 electron cho nguyên tử clo (Cl), tạo ra ion Na+ và Cl-.
- Các ion này có điện tích trái dấu và hút nhau rất mạnh bởi lực hút tĩnh điện, tạo nên liên kết ion bền vững.
Tính Chất của Hợp Chất Ion
- Điểm nóng chảy và điểm sôi cao: Do lực hút tĩnh điện giữa các ion rất mạnh, các hợp chất ion thường có điểm nóng chảy và sôi cao.
- Khả năng dẫn điện: Ở trạng thái lỏng hoặc khi hòa tan trong nước, các hợp chất ion dẫn điện tốt do sự di chuyển của các ion tự do.
- Độ tan: Các hợp chất ion thường tan tốt trong dung môi phân cực như nước.
Ví Dụ về Liên Kết Ion
Một ví dụ điển hình là muối ăn (NaCl). Trong đó, nguyên tử natri (Na) nhường một electron cho nguyên tử clo (Cl), tạo thành Na+ và Cl-. Các ion này liên kết với nhau bằng lực hút tĩnh điện, tạo nên cấu trúc mạng tinh thể bền vững.
\[
\text{Na} + \text{Cl} \rightarrow \text{Na}^+ + \text{Cl}^-
\]
Ứng Dụng của Liên Kết Ion
Liên kết ion có ứng dụng rộng rãi trong nhiều lĩnh vực, từ sản xuất hóa chất công nghiệp, xử lý nước, đến y học. Ví dụ, NaCl được sử dụng rộng rãi trong đời sống hàng ngày, từ gia vị trong thực phẩm đến chất bảo quản.
Trong y học, các hợp chất ion như Na2CO3 (natri cacbonat) được dùng trong điều trị các bệnh liên quan đến dạ dày, như giảm axit.
Kết Luận
Liên kết ion là một trong những loại liên kết hóa học cơ bản, giúp giải thích nhiều tính chất và ứng dụng của các hợp chất ion trong đời sống và công nghiệp. Hiểu rõ về liên kết này giúp chúng ta nắm bắt được cách thức hoạt động của các chất và có thể áp dụng vào nhiều lĩnh vực khác nhau.
.png)
1. Khái niệm về cộng hóa trị phân cực
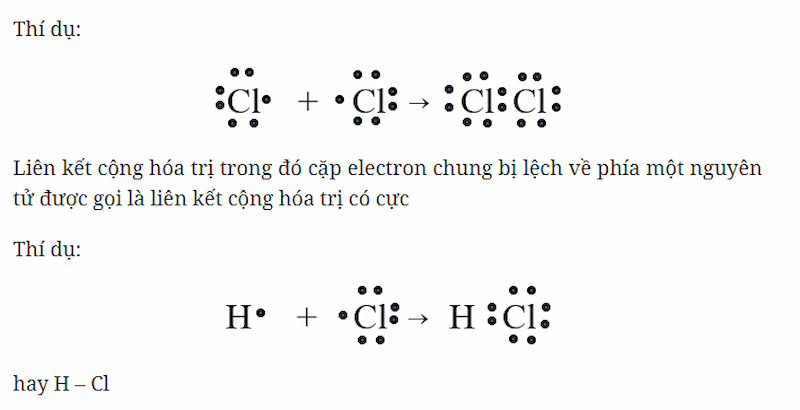
Cộng hóa trị phân cực là một loại liên kết hóa học, trong đó các nguyên tử tham gia liên kết chia sẻ các cặp electron, nhưng các electron này không được chia sẻ đều nhau giữa các nguyên tử. Sự khác biệt này dẫn đến sự phân cực của liên kết, tức là một đầu của liên kết trở nên dương hơn, trong khi đầu kia trở nên âm hơn.
Liên kết cộng hóa trị phân cực thường xảy ra khi hai nguyên tử có độ âm điện khác nhau. Độ âm điện là khả năng của một nguyên tử hút các electron về phía mình trong một liên kết hóa học. Khi có sự chênh lệch độ âm điện giữa hai nguyên tử, nguyên tử có độ âm điện lớn hơn sẽ hút electron mạnh hơn, tạo ra một cực âm, trong khi nguyên tử còn lại tạo ra một cực dương.
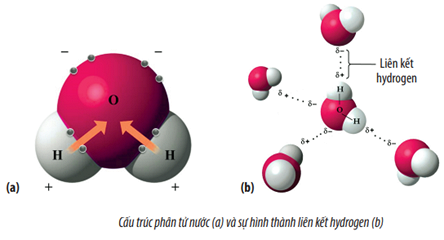
Ví dụ, trong phân tử nước \((H_2O)\), oxy có độ âm điện lớn hơn hydro, vì vậy các electron chung bị hút về phía oxy, tạo nên một liên kết cộng hóa trị phân cực.
- Liên kết phân cực: Xảy ra khi độ âm điện của hai nguyên tử khác nhau đáng kể.
- Liên kết không phân cực: Xảy ra khi hai nguyên tử có độ âm điện tương tự, dẫn đến sự chia sẻ electron đồng đều.
Trong thực tế, liên kết cộng hóa trị phân cực rất quan trọng vì chúng quyết định tính chất hóa học và vật lý của các phân tử, như độ tan trong nước, điểm sôi và nhiệt độ nóng chảy.
| Độ âm điện của nguyên tử | Loại liên kết |
|---|---|
| Chênh lệch lớn | Liên kết ion |
| Chênh lệch vừa phải | Liên kết cộng hóa trị phân cực |
| Chênh lệch nhỏ hoặc không có | Liên kết cộng hóa trị không phân cực |
2. Nguyên nhân và cơ chế hình thành liên kết cộng hóa trị phân cực
Liên kết cộng hóa trị phân cực hình thành do sự khác biệt độ âm điện giữa các nguyên tử tham gia liên kết. Độ âm điện là khả năng hút electron của một nguyên tử trong một liên kết hóa học. Khi hai nguyên tử có độ âm điện khác nhau liên kết với nhau, cặp electron chung bị hút về phía nguyên tử có độ âm điện lớn hơn, tạo ra sự phân cực trong liên kết.
-
Nguyên nhân hình thành liên kết cộng hóa trị phân cực:
- Chênh lệch độ âm điện: Sự khác biệt độ âm điện giữa hai nguyên tử là yếu tố quan trọng nhất. Nguyên tử có độ âm điện lớn hơn sẽ hút cặp electron chung mạnh hơn, dẫn đến sự phân cực của liên kết. Ví dụ, trong phân tử hydrochloric acid \((HCl)\), chlorine có độ âm điện lớn hơn hydro, do đó electron bị hút về phía chlorine, tạo ra cực âm ở phía chlorine và cực dương ở phía hydro.
- Cấu trúc hình học: Hình dạng không đối xứng của phân tử cũng có thể dẫn đến phân cực ngay cả khi các nguyên tử có độ âm điện tương tự. Ví dụ, trong phân tử nước \((H_2O)\), mặc dù hai liên kết O-H có cùng độ âm điện, cấu trúc hình học của nước là hình gấp khúc, tạo ra sự phân cực tổng thể.
-
Cơ chế hình thành liên kết cộng hóa trị phân cực:
- Bước 1: Hai nguyên tử có độ âm điện khác nhau tiến lại gần nhau.
- Bước 2: Cặp electron chung hình thành, nhưng không được chia sẻ đều giữa hai nguyên tử. Electron bị hút về phía nguyên tử có độ âm điện cao hơn.
- Bước 3: Một cực dương và một cực âm hình thành, tạo ra liên kết cộng hóa trị phân cực.
Sự phân cực của liên kết ảnh hưởng đến tính chất hóa học và vật lý của phân tử, như độ tan, độ bay hơi, và tính phản ứng. Các phân tử có liên kết cộng hóa trị phân cực thường tan tốt trong dung môi phân cực như nước, do sự tương tác giữa các cực dương và âm của phân tử.
| Nguyên tử 1 | Nguyên tử 2 | Chênh lệch độ âm điện | Loại liên kết |
|---|---|---|---|
| H | Cl | 0.9 | Cộng hóa trị phân cực |
| C | O | 1.0 | Cộng hóa trị phân cực |
| H | O | 1.4 | Cộng hóa trị phân cực |

3. Ứng dụng của liên kết cộng hóa trị phân cực trong đời sống
Liên kết cộng hóa trị phân cực đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp. Sự phân cực của liên kết ảnh hưởng đến tính chất của các hợp chất và ứng dụng của chúng trong thực tiễn.
-
Hóa học dược phẩm:
- Thuốc và thuốc kháng sinh: Nhiều loại thuốc có liên kết cộng hóa trị phân cực giúp tăng cường khả năng hòa tan trong nước, từ đó dễ dàng được cơ thể hấp thụ. Ví dụ, các loại kháng sinh như penicillin có liên kết phân cực giúp chúng tan trong dịch cơ thể và đạt hiệu quả điều trị.
- Hợp chất điều trị bệnh: Các hợp chất như thuốc giảm đau và thuốc chống viêm thường có tính phân cực để hòa tan tốt trong các môi trường sinh học, cải thiện khả năng phân phối và tác dụng.
-
Công nghệ vật liệu:
- Nhựa và polymer: Nhiều loại nhựa và polymer có liên kết cộng hóa trị phân cực, giúp cải thiện tính chất như độ bền, độ dẻo và khả năng chống thấm nước. Ví dụ, nylon và polycarbonate đều có cấu trúc phân cực, làm cho chúng bền và có tính ứng dụng cao.
- Vật liệu cách điện: Các vật liệu cách điện như teflon sử dụng liên kết phân cực để tạo ra lớp bảo vệ chống lại sự dẫn điện và điện trở cao.
-
Chế biến thực phẩm và công nghiệp:
- Chất tạo hương và phẩm màu: Các hợp chất phân cực được sử dụng làm chất tạo hương và phẩm màu trong thực phẩm để cải thiện khả năng hòa tan và phân phối đồng đều.
- Chất tẩy rửa: Nhiều chất tẩy rửa có liên kết phân cực, giúp chúng hòa tan dễ dàng trong nước và làm sạch các vết bẩn dầu mỡ nhờ khả năng tương tác với cả nước và dầu.
Ứng dụng của liên kết cộng hóa trị phân cực không chỉ giới hạn trong các lĩnh vực trên mà còn mở rộng ra nhiều ngành công nghiệp khác, nhờ vào khả năng điều chỉnh tính chất của các hợp chất và vật liệu.
| Ứng dụng | Liên kết cộng hóa trị phân cực | Ví dụ |
|---|---|---|
| Hóa học dược phẩm | Tăng cường khả năng hòa tan trong nước | Penicillin, thuốc giảm đau |
| Công nghệ vật liệu | Cải thiện độ bền và tính chất vật liệu | Nylon, teflon |
| Chế biến thực phẩm | Cải thiện hòa tan và phân phối phẩm màu | Chất tạo hương, phẩm màu thực phẩm |

4. Cách nhận biết liên kết cộng hóa trị phân cực trong thực tế
Nhận biết liên kết cộng hóa trị phân cực trong thực tế có thể được thực hiện bằng nhiều phương pháp khác nhau, từ phân tích lý thuyết đến thí nghiệm thực tiễn. Dưới đây là các cách phổ biến để nhận biết và xác định liên kết cộng hóa trị phân cực.
-
Phân tích độ âm điện:
- Đo độ âm điện: Sử dụng bảng độ âm điện để xác định độ âm điện của các nguyên tử tham gia liên kết. Sự chênh lệch lớn về độ âm điện giữa hai nguyên tử thường chỉ ra liên kết cộng hóa trị phân cực.
- Công thức tính độ phân cực: Tính toán độ phân cực của liên kết dựa trên độ âm điện của các nguyên tử. Sự phân cực được đo bằng mô men lưỡng cực (\(\mu\)), với công thức \(\mu = q \cdot r\), trong đó \(q\) là điện tích và \(r\) là khoảng cách giữa các cực.
-
Quan sát tính chất vật lý:
- Điểm sôi và điểm nóng chảy: Các chất có liên kết phân cực thường có điểm sôi và điểm nóng chảy cao hơn so với các chất không phân cực do các liên kết phân cực tạo ra các lực tương tác mạnh hơn giữa các phân tử.
- Độ tan trong nước: Các hợp chất có liên kết cộng hóa trị phân cực thường tan tốt trong nước (dung môi phân cực) nhờ sự tương tác giữa các cực âm và dương của phân tử.
-
Sử dụng phương pháp phổ học:
- Phổ hồng ngoại (IR): Phân tích phổ IR để xác định các đỉnh hấp thụ đặc trưng cho liên kết cộng hóa trị phân cực. Các nhóm chức phân cực có thể tạo ra các đỉnh hấp thụ riêng biệt trong phổ IR.
- Phổ hạt nhân từ hóa (NMR): Sử dụng phổ NMR để quan sát sự thay đổi môi trường xung quanh nguyên tử, giúp xác định tính chất phân cực của liên kết.
Những phương pháp này giúp nhận biết liên kết cộng hóa trị phân cực một cách chính xác và hiệu quả, từ đó ứng dụng vào các lĩnh vực nghiên cứu và công nghiệp.
| Phương pháp | Chi tiết |
|---|---|
| Phân tích độ âm điện | Xác định chênh lệch độ âm điện và tính toán mô men lưỡng cực |
| Quan sát tính chất vật lý | Điểm sôi, điểm nóng chảy và độ tan trong nước |
| Phương pháp phổ học | Phổ IR và NMR để phân tích cấu trúc và tính chất phân cực |

5. Mối liên hệ giữa liên kết cộng hóa trị phân cực và độ tan của các chất
Mối liên hệ giữa liên kết cộng hóa trị phân cực và độ tan của các chất là một yếu tố quan trọng trong hóa học. Độ tan của một chất trong một dung môi thường phụ thuộc vào sự phân cực của liên kết trong phân tử của chất đó và sự tương tác giữa các phân tử của chất với dung môi.
-
Nguyên lý cơ bản:
- Nguyên lý phân cực hòa tan: Các chất phân cực thường hòa tan tốt trong dung môi phân cực, ví dụ như nước. Điều này là do lực tương tác giữa các phân tử phân cực trong chất và dung môi phân cực, như nước, là đủ mạnh để làm tan chất. Nguyên lý này được mô tả bởi quy tắc "dễ hòa tan trong dễ hòa tan" (like dissolves like).
- Phân tử không phân cực: Các chất không phân cực, như dầu, không tan tốt trong dung môi phân cực vì sự tương tác giữa các phân tử không phân cực với dung môi phân cực là rất yếu.
-
Ảnh hưởng của liên kết cộng hóa trị phân cực:
- Cấu trúc phân tử: Liên kết cộng hóa trị phân cực tạo ra các vùng tích điện dương và âm trong phân tử. Những vùng này có thể tương tác với các phân tử của dung môi phân cực, giúp tăng độ tan của chất trong dung môi đó.
- Điểm sôi và điểm nóng chảy: Các chất có liên kết phân cực thường có điểm sôi và điểm nóng chảy cao hơn, cho thấy các lực tương tác mạnh giữa các phân tử phân cực.
-
Ví dụ thực tiễn:
- Muối ăn (NaCl): Muối ăn tan tốt trong nước nhờ sự phân cực của nước và sự tương tác ion-dipole giữa ion natri và clo với các phân tử nước.
- Đường (C₁₂H₂₂O₁₁): Đường tan tốt trong nước do liên kết cộng hóa trị phân cực trong phân tử đường tương tác mạnh với phân tử nước.
- Chất béo: Các chất béo và dầu không tan trong nước vì chúng chủ yếu là các phân tử không phân cực, không tương tác tốt với dung môi phân cực như nước.
| Chất | Loại liên kết | Độ tan trong nước |
|---|---|---|
| Muối ăn (NaCl) | Cộng hóa trị phân cực (ion-dipole) | Cao |
| Đường (C₁₂H₂₂O₁₁) | Cộng hóa trị phân cực | Cao |
| Dầu thực vật | Không phân cực | Thấp |
XEM THÊM:
6. Các dạng bài tập về cộng hóa trị phân cực
Việc làm bài tập về cộng hóa trị phân cực giúp củng cố kiến thức và ứng dụng thực tiễn của liên kết cộng hóa trị phân cực. Dưới đây là các dạng bài tập thường gặp cùng với hướng dẫn giải để bạn dễ dàng thực hành và hiểu sâu hơn về chủ đề này.
-
Xác định phân cực của liên kết:
- Bài tập: Xác định xem liên kết giữa các nguyên tử trong các phân tử sau là phân cực hay không: \(\text{HCl}\), \(\text{CO}_2\), \(\text{H}_2\text{O}\).
- Giải:
- HCl: Liên kết giữa H và Cl là phân cực vì Cl có độ âm điện cao hơn H.
- CO₂: Liên kết C=O trong CO₂ là phân cực, nhưng phân tử CO₂ không phân cực do cấu trúc đối xứng.
- H₂O: Liên kết H-O là phân cực và phân tử H₂O cũng phân cực do cấu trúc gấp khúc.
-
Tính toán mô men lưỡng cực:
- Bài tập: Tính toán mô men lưỡng cực của phân tử nước \(\text{H}_2\text{O}\) biết rằng độ phân cực liên kết H-O là 1.85 D và góc liên kết là 104.5°.
- Giải:
- Mô men lưỡng cực \(\mu\) tính bằng công thức \(\mu = q \cdot r \cdot \sin(\theta)\), trong đó \(q\) là độ phân cực của liên kết, \(r\) là khoảng cách giữa các nguyên tử, và \(\theta\) là góc liên kết.
- Áp dụng giá trị cụ thể vào công thức và tính toán để tìm mô men lưỡng cực.
-
So sánh độ tan của các chất:
- Bài tập: So sánh độ tan của muối ăn và dầu thực vật trong nước. Giải thích kết quả dựa trên tính phân cực của các chất.
- Giải:
- Muối ăn tan tốt trong nước do liên kết phân cực của muối và nước tương tác mạnh mẽ.
- Dầu thực vật không tan trong nước vì dầu là chất không phân cực và không tương tác tốt với dung môi phân cực như nước.
-
Phân tích cấu trúc phân tử:
- Bài tập: Vẽ cấu trúc phân tử và xác định tính phân cực của các hợp chất: \(\text{NH}_3\), \(\text{BF}_3\).
- Giải:
- NH₃: Cấu trúc phân tử có hình dạng tam giác đều và phân cực do nguyên tử N có độ âm điện cao hơn H.
- BF₃: Cấu trúc phân tử có hình dạng hình tam giác đều và không phân cực do sự đối xứng của các liên kết.
| Dạng bài tập | Mô tả | Ví dụ |
|---|---|---|
| Xác định phân cực | Xác định xem liên kết có phân cực hay không | HCl, CO₂, H₂O |
| Tính toán mô men lưỡng cực | Tính toán mô men lưỡng cực của phân tử dựa trên độ phân cực và góc liên kết | H₂O |
| So sánh độ tan | So sánh độ tan của các chất trong nước và giải thích kết quả | Muối ăn, dầu thực vật |
| Phân tích cấu trúc | Vẽ cấu trúc phân tử và xác định tính phân cực | NH₃, BF₃ |