Chủ đề nh3 có phân cực không: NH3 có phân cực không? Đây là một câu hỏi thường gặp khi tìm hiểu về tính chất của amoniac. Phân tử NH3 có độ phân cực do cấu trúc hình chóp tam giác và sự tồn tại của cặp electron tự do trên nguyên tử nitơ. Điều này không chỉ ảnh hưởng đến tính chất hóa học của NH3 mà còn giúp nó dễ dàng hòa tan trong nước và các dung môi khác, mở ra nhiều ứng dụng thực tiễn trong đời sống và công nghiệp.
Mục lục
NH3 Có Phân Cực Không?
Khi tìm hiểu về NH3 (Amoniac), một câu hỏi phổ biến là liệu NH3 có phân cực hay không. Để trả lời câu hỏi này, chúng ta cần xem xét cấu trúc phân tử và tính chất hóa học của NH3.
Cấu Trúc Phân Tử của NH3
Phân tử NH3 có cấu trúc hình chóp với nguyên tử Nitơ (N) ở đỉnh và ba nguyên tử Hydro (H) ở các góc đáy tam giác. Góc liên kết H-N-H trong NH3 là khoảng 107 độ, điều này khác so với góc lý tưởng 109.5 độ trong cấu trúc tứ diện hoàn hảo do cặp electron tự do trên nguyên tử Nitơ gây ra lực đẩy lớn hơn đối với các cặp liên kết.
Tính Phân Cực của NH3
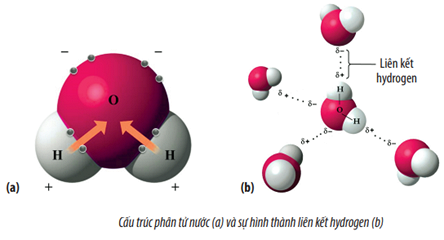
Phân cực là một tính chất của các phân tử mà trong đó có sự chênh lệch về điện tích giữa các đầu phân tử. NH3 là một phân tử phân cực do có cặp electron tự do trên nguyên tử Nitơ tạo ra một mômen lưỡng cực (dipole moment). Điều này làm cho NH3 có cực dương nhẹ ở phía các nguyên tử Hydro và cực âm nhẹ ở phía nguyên tử Nitơ.
Tính Chất Hóa Học và Ứng Dụng của NH3
- Tính bazơ yếu: NH3 có tính bazơ yếu, có khả năng nhận proton (H+) từ các chất khác, hình thành ion amoni \(NH_4^+\).
- Khả năng tạo phức: NH3 có khả năng tạo phức với nhiều ion kim loại, chẳng hạn như \(Cu^{2+}\), \(Ni^{2+}\), \(Ag^+\), làm cho nó hữu ích trong các ứng dụng công nghiệp và hóa học phân tích.
- Ứng dụng trong công nghiệp: NH3 được sử dụng rộng rãi trong sản xuất phân bón, hóa chất tẩy rửa, và trong ngành công nghiệp chế biến thực phẩm.
Cách Điều Chế NH3
NH3 có thể được điều chế bằng nhiều phương pháp khác nhau, bao gồm:
- Trong phòng thí nghiệm: Phản ứng giữa \(NH_4Cl\) và \(Ca(OH)_2\) tạo ra \(NH_3\), \(CaCl_2\), và \(H_2\).
- Trong công nghiệp: Phương pháp Haber-Bosch sử dụng khí \(N_2\) và \(H_2\) với xúc tác sắt ở áp suất và nhiệt độ cao để sản xuất \(NH_3\). Phương trình phản ứng: \[ N_2 + 3H_2 \rightarrow 2NH_3 \]
Những Tác Hại Tiềm Ẩn Của NH3
Mặc dù NH3 có nhiều ứng dụng, nó cũng có thể gây nguy hiểm nếu không được xử lý đúng cách. NH3 là một chất gây kích ứng mạnh, có thể gây ra các vấn đề hô hấp nghiêm trọng nếu tiếp xúc hoặc hít phải lượng lớn. Việc bảo quản và sử dụng NH3 cần được thực hiện cẩn thận để tránh các nguy cơ tiềm ẩn.
Kết Luận
Phân tử NH3 là một ví dụ điển hình của một phân tử phân cực do sự chênh lệch về điện tích gây ra bởi cấu trúc phân tử và cặp electron tự do trên nguyên tử Nitơ. NH3 có nhiều ứng dụng trong đời sống và công nghiệp nhưng cũng cần cẩn trọng khi sử dụng do những tác hại tiềm ẩn mà nó có thể gây ra.
 3 Có Phân Cực Không?" style="object-fit:cover; margin-right: 20px;" width="760px" height="647">
3 Có Phân Cực Không?" style="object-fit:cover; margin-right: 20px;" width="760px" height="647">.png)
Mục Lục
1. Giới thiệu về NH3 và tính chất hóa học
2. NH3 có phân cực không? Phân tích tính chất phân cực
3. Cơ chế phân cực của NH3 và sự tương tác với các dung môi
4. Ứng dụng của NH3 trong công nghiệp và đời sống
5. Tính chất nguy hiểm và biện pháp an toàn khi sử dụng NH3
6. Bài tập và ví dụ minh họa về tính phân cực của NH3
7. So sánh NH3 với các phân tử khác về tính phân cực
8. Kết luận về tính chất phân cực của NH3
Khái quát về phân tử NH3, cấu trúc phân tử và tính chất hóa học cơ bản. Tầm quan trọng của NH3 trong các phản ứng hóa học và ứng dụng thực tế.
Giải thích tính phân cực của phân tử NH3 dựa trên cấu trúc hình học và sự phân bố electron. Ảnh hưởng của tính phân cực đến tính chất vật lý và hóa học của NH3.
Phân tích cách NH3 tương tác với các dung môi khác nhau, đặc biệt là nước, do tính phân cực của nó. Giải thích tại sao NH3 dễ dàng hòa tan trong nước và các dung môi phân cực khác.
Liệt kê các ứng dụng quan trọng của NH3 trong công nghiệp, như sản xuất phân bón, hóa chất, và các sản phẩm gia dụng. Đề cập đến vai trò của NH3 trong quá trình làm mát và sản xuất chất tẩy rửa.
Những rủi ro khi tiếp xúc với NH3 ở nồng độ cao, như tính ăn mòn và độc hại. Biện pháp an toàn khi sử dụng NH3 trong môi trường công nghiệp và gia đình.
Bộ bài tập về tính phân cực của NH3 và các ví dụ minh họa. Hướng dẫn chi tiết cách giải các bài tập này để nắm rõ hơn về khái niệm phân cực.
So sánh NH3 với các phân tử khác như H2O, CH4, và CO2 về tính phân cực và tác động của tính phân cực đến tính chất của các phân tử này.
Nhấn mạnh lại tính chất phân cực của NH3 và tầm quan trọng của nó trong hóa học và đời sống hàng ngày. Tổng kết các điểm chính đã thảo luận trong bài viết.
Định nghĩa NH3 và tính chất phân cực
Amoniac (NH\(_3\)) là một hợp chất vô cơ với công thức hóa học là NH\(_3\). Đây là một khí không màu, có mùi khai và tan nhiều trong nước, tạo thành dung dịch bazo yếu NH\(_4\)OH. Amoniac được biết đến với nhiều tính chất hóa học quan trọng và có vai trò quan trọng trong công nghiệp và đời sống.
1. Cấu trúc phân tử của NH3:
Phân tử NH\(_3\) có cấu trúc hình chóp tam giác với nguyên tử nitơ ở đỉnh và ba nguyên tử hydro ở đáy. Góc liên kết H-N-H trong NH\(_3\) là khoảng 107 độ, nhỏ hơn góc tứ diện (109.5 độ) do cặp electron không liên kết trên nguyên tử nitơ đẩy các liên kết N-H.
2. Tính chất phân cực của NH3:
- Đặc điểm phân cực: NH\(_3\) là một phân tử phân cực do sự khác biệt độ âm điện giữa nitơ (N) và hydro (H). Độ âm điện của nitơ là 3.04, trong khi của hydro là 2.20. Sự chênh lệch này tạo nên một momen lưỡng cực, với đầu âm tập trung ở nguyên tử nitơ và đầu dương tập trung ở các nguyên tử hydro.
- Tương tác phân cực: Momen lưỡng cực của NH\(_3\) tạo ra các lực hấp dẫn phân tử mạnh, làm cho NH\(_3\) tan tốt trong nước và nhiều dung môi phân cực khác. Điều này cũng giải thích cho khả năng tạo liên kết hydro giữa các phân tử NH\(_3\) và nước (H\(_2\)O).
3. Phản ứng hóa học liên quan đến NH3:
- Phản ứng với nước: Khi hòa tan trong nước, NH\(_3\) kết hợp với ion H\(^+\) của nước tạo thành cation amoni (NH\(_4^+\)) và giải phóng anion hydroxit (OH\(^-\)): \[ NH_3 + H_2O \rightarrow NH_4^+ + OH^- \]
- Tính bazơ: Do tính chất bazơ yếu, dung dịch amoniac (NH\(_3\)) có khả năng làm quỳ tím chuyển sang màu xanh và phenolphtalein từ không màu chuyển sang màu hồng. Điều này cho thấy NH\(_3\) có khả năng nhận proton (H\(^+\)) khi tác dụng với các axit.
- Tính khử và tạo phức: NH\(_3\) có thể phản ứng với các ion kim loại chuyển tiếp như bạc (Ag\(^+\)) để tạo thành các ion phức, ví dụ: \[ 2NH_3 + Ag^+ \rightarrow [Ag(NH_3)_2]^+ \]
Với những tính chất đặc biệt này, NH\(_3\) được ứng dụng rộng rãi trong các ngành công nghiệp như sản xuất phân bón, làm chất tẩy rửa và trong các quá trình hóa học khác.

Tương tác hóa học của NH3 với nước và các dung môi khác
Amoniac (NH3) là một hợp chất hóa học có khả năng tương tác mạnh mẽ với nước và một số dung môi khác. Dưới đây là phân tích chi tiết về cách NH3 tương tác với nước và các dung môi khác, dựa trên tính chất phân cực và cấu trúc phân tử của nó.
- 1. Tương tác của NH3 với nước:
NH3 là một bazơ yếu, khi hòa tan trong nước, nó sẽ tạo thành dung dịch amoniac. Phản ứng này bao gồm sự hình thành liên kết hydro giữa các phân tử NH3 và phân tử nước (H2O), giúp NH3 hòa tan tốt trong nước.
Phương trình điện li của NH3 trong nước được biểu diễn như sau:
\[ \text{NH}_3 + \text{H}_2\text{O} \leftrightarrow \text{NH}_4^+ + \text{OH}^- \]Trong đó, ion NH4+ và OH- được tạo ra do NH3 là một chất điện li yếu.
Khả năng tạo liên kết hydro và tính phân cực của NH3 giúp nó tan tốt trong nước và ảnh hưởng đến tính chất hóa học của dung dịch.
- 2. Tương tác của NH3 với các dung môi khác:
NH3 cũng có khả năng hòa tan trong các dung môi khác như ethanol và methanol do tính chất phân cực của nó.
Trong các dung môi hữu cơ, NH3 có thể hoạt động như một chất khử hoặc tạo phức với các ion kim loại, tùy thuộc vào bản chất của dung môi và các chất khác có mặt.
Tóm lại, NH3 có khả năng tương tác đa dạng với nước và các dung môi khác nhờ tính phân cực và khả năng tạo liên kết hydro, giúp nó dễ dàng hòa tan và tham gia vào nhiều phản ứng hóa học khác nhau.

Ứng dụng của NH3 trong công nghiệp và đời sống
Amoniac (NH3) là một hợp chất hóa học có rất nhiều ứng dụng quan trọng trong công nghiệp và đời sống hàng ngày. Dưới đây là một số ứng dụng nổi bật của NH3:
- Phân bón nông nghiệp: NH3 đóng vai trò quan trọng trong sản xuất phân bón hóa học, đặc biệt là phân đạm. Khoảng 83% lượng NH3 được sản xuất trên thế giới được sử dụng để sản xuất phân bón. Nitơ từ NH3 là yếu tố thiết yếu giúp cây trồng phát triển mạnh mẽ, tăng năng suất và chất lượng nông sản.
- Chất tẩy rửa: Trong gia đình, NH3 thường được sử dụng như một chất tẩy rửa mạnh. Dung dịch amoniac có khả năng làm sạch bề mặt thủy tinh, gạch men, và thép không gỉ. Nó còn có thể tẩy vết bẩn và mảng bám trên nhiều bề mặt, giúp đồ dùng gia đình luôn sạch sẽ.
- Xử lý khí thải: Trong công nghiệp, NH3 được sử dụng để xử lý khí thải, đặc biệt là để loại bỏ các chất ô nhiễm như NOx và SOx từ các nhà máy điện và các ngành công nghiệp khác. Quá trình này giúp giảm thiểu tác động của ô nhiễm không khí đến môi trường và sức khỏe con người.
- Sản xuất hóa chất: NH3 là nguyên liệu cơ bản trong sản xuất nhiều loại hóa chất khác nhau như axit nitric (HNO3), ure (NH2CONH2), và nhiều hợp chất hữu cơ khác. Những hóa chất này được sử dụng rộng rãi trong công nghiệp hóa chất, dược phẩm và sản xuất chất nổ.
- Công nghiệp thực phẩm và đồ uống: NH3 được sử dụng trong quy trình làm lạnh và bảo quản thực phẩm. Amoniac là một chất làm lạnh hiệu quả, được sử dụng trong các hệ thống lạnh công nghiệp để bảo quản thực phẩm ở nhiệt độ thấp, đảm bảo chất lượng và an toàn thực phẩm.
- Ngành dệt may: NH3 được sử dụng trong quá trình xử lý vải, giúp làm mềm và bảo vệ các sợi vải, cải thiện độ bền màu và chất lượng sản phẩm.
Với những ứng dụng đa dạng như vậy, NH3 là một hợp chất hóa học không thể thiếu trong nhiều lĩnh vực công nghiệp và đời sống. Tuy nhiên, việc sử dụng NH3 cũng cần được kiểm soát chặt chẽ để đảm bảo an toàn cho con người và môi trường.

Phương pháp điều chế NH3 trong công nghiệp
Trong công nghiệp, NH3 (amoniac) được điều chế thông qua quá trình tổng hợp từ nitơ (N2) và hydro (H2). Các công nghệ sản xuất NH3 phổ biến nhất bao gồm:
- Công nghệ Haldor Topsoe: Đây là công nghệ được sử dụng rộng rãi nhất trên thế giới và cũng được áp dụng tại các nhà máy đạm ở Việt Nam. Công nghệ này sử dụng một hệ thống xúc tác hiệu quả và điều kiện phản ứng tối ưu để tổng hợp amoniac từ N2 và H2.
- Công nghệ M.W. Kellogg: Phương pháp này tập trung vào việc tối ưu hóa quy trình phản ứng và tiết kiệm năng lượng, đảm bảo năng suất sản xuất cao và chi phí thấp.
- Công nghệ Krupp Uhde: Sử dụng công nghệ tiên tiến với hệ thống xúc tác và điều kiện nhiệt độ, áp suất tối ưu để đạt được hiệu quả sản xuất cao.
- Công nghệ ICI: Một trong những công nghệ truyền thống, được sử dụng rộng rãi với hiệu suất sản xuất ổn định.
- Công nghệ Brown & Root: Công nghệ này chú trọng đến việc giảm thiểu chi phí vận hành và tối ưu hóa các quy trình sản xuất amoniac.
Quá trình tổng hợp NH3 thường diễn ra trong điều kiện nhiệt độ cao (400-450°C) và áp suất cao (200-300 atm). Trong điều kiện này, nitơ và hydro phản ứng với nhau trên bề mặt xúc tác, tạo ra NH3 theo phương trình phản ứng:
Trong công nghiệp, việc điều chế NH3 không chỉ dừng lại ở việc sản xuất hóa chất này mà còn phải đảm bảo các tiêu chuẩn an toàn và bảo vệ môi trường. Các nhà máy sản xuất NH3 thường áp dụng các biện pháp để giảm thiểu khí thải và sử dụng năng lượng một cách hiệu quả, góp phần bảo vệ môi trường và duy trì sự phát triển bền vững.
Việc ứng dụng các công nghệ tiên tiến như Haldor Topsoe hay M.W. Kellogg giúp tối ưu hóa quy trình sản xuất, giảm thiểu chi phí và cải thiện chất lượng sản phẩm. Điều này đảm bảo rằng amoniac được sản xuất với hiệu quả cao nhất, phục vụ cho nhu cầu của các ngành công nghiệp khác nhau như sản xuất phân bón, hóa chất, và các ứng dụng trong công nghệ môi trường.
XEM THÊM:
Lưu ý an toàn khi sử dụng NH3
Khi làm việc với amoniac (NH3), cần chú ý đến những biện pháp an toàn để đảm bảo sức khỏe và an toàn cho bản thân cũng như môi trường xung quanh. NH3 là một chất khí không màu, có mùi hăng mạnh và có thể gây kích ứng nặng cho da, mắt và hệ hô hấp. Dưới đây là một số lưu ý quan trọng khi sử dụng NH3:
- Đảm bảo thông gió tốt: Luôn làm việc trong không gian có thông gió tốt hoặc sử dụng hệ thống hút khí chuyên dụng để tránh tích tụ khí NH3 trong không khí, gây nguy hiểm cho người xung quanh.
- Sử dụng thiết bị bảo hộ cá nhân (PPE): Đeo kính bảo hộ, găng tay chịu hóa chất, và khẩu trang hoặc mặt nạ phòng độc để bảo vệ mắt, da và đường hô hấp khỏi tác động của NH3.
- Tránh tiếp xúc trực tiếp: Không để NH3 tiếp xúc trực tiếp với da và mắt. Trong trường hợp tiếp xúc, rửa ngay bằng nước sạch trong ít nhất 15 phút và tìm kiếm sự trợ giúp y tế.
- Xử lý sự cố tràn đổ: Trong trường hợp NH3 bị tràn đổ, sử dụng vật liệu thấm hút hóa chất hoặc cát để hấp thụ, sau đó xử lý theo quy định về chất thải nguy hại. Tránh sử dụng nước để rửa, vì có thể làm tăng sự bay hơi của NH3.
- Quản lý và lưu trữ đúng cách: Lưu trữ NH3 trong các bình chứa chuyên dụng được thiết kế để chịu áp suất cao và có khả năng chống ăn mòn. Đặt các bình chứa ở nơi khô ráo, thoáng mát và tránh xa nguồn nhiệt và các vật liệu dễ cháy.
- Đào tạo và hướng dẫn an toàn: Nhân viên cần được đào tạo đầy đủ về cách xử lý và các biện pháp an toàn liên quan đến NH3. Hướng dẫn cụ thể về quy trình xử lý sự cố và sơ cứu cần được phổ biến rộng rãi.
Việc tuân thủ các biện pháp an toàn này giúp giảm thiểu rủi ro khi sử dụng NH3 và bảo vệ sức khỏe của mọi người xung quanh. Luôn đảm bảo tuân thủ các quy định và hướng dẫn an toàn khi làm việc với hóa chất này.

Bài tập hóa học về NH3
Bài tập 1: Giải thích sự phân cực của phân tử NH3
Dựa trên cấu trúc hình học và độ âm điện của các nguyên tử trong phân tử NH3, giải thích tại sao NH3 có tính chất phân cực. Vẽ sơ đồ phân bố điện tích trong phân tử NH3.
Bài tập 2: Tính toán mômen lưỡng cực của NH3
Sử dụng các giá trị độ âm điện của nitơ (N) và hydro (H), tính toán mômen lưỡng cực của NH3. Giải thích sự phân bố điện tích trong phân tử này.
Bài tập 3: Phản ứng của NH3 với nước
Viết phương trình hóa học cho phản ứng giữa NH3 và nước. Giải thích tính chất kiềm của dung dịch tạo thành và vai trò của NH3 trong phản ứng này.
Bài tập 4: Tính kiềm của dung dịch NH3
Cho biết nồng độ dung dịch NH3 là 0,1 M. Tính pH của dung dịch này và giải thích kết quả.
Bài tập 5: Sự tương tác của NH3 với các ion kim loại
Viết phương trình hóa học cho phản ứng giữa NH3 và Ag+. Giải thích hiện tượng quan sát được và ứng dụng của phản ứng này trong thực tế.
Bài tập 6: Điều chế NH3 từ các nguồn khác nhau
Miêu tả quy trình điều chế NH3 từ nitrua nhôm (AlN). Viết phương trình hóa học liên quan và giải thích các điều kiện cần thiết cho phản ứng này.
Bài tập 7: Phản ứng của NH3 với axit mạnh
Viết phương trình hóa học cho phản ứng giữa NH3 và axit clohidric (HCl). Giải thích hiện tượng xảy ra và vai trò của NH3 trong phản ứng này.
Bài tập 8: Sử dụng NH3 trong công nghiệp thực phẩm
Phân tích vai trò của NH3 trong ngành công nghiệp thực phẩm, đặc biệt là trong quá trình bảo quản và chế biến thực phẩm. Viết các phản ứng hóa học liên quan nếu có.
Bài tập 9: Ứng dụng của NH3 trong sản xuất phân bón
Trình bày quy trình sản xuất phân bón từ NH3. Giải thích tại sao NH3 là một nguồn cung cấp nitơ quan trọng cho cây trồng.
Bài tập 10: Phương pháp Haber-Bosch
Trình bày nguyên lý của phương pháp Haber-Bosch và vai trò của nó trong sản xuất NH3. Viết phương trình hóa học liên quan và giải thích các điều kiện tối ưu cho phản ứng.