Chủ đề chất phân cực là gì: Chất phân cực là một khái niệm quan trọng trong hóa học, liên quan đến sự phân bố không đều của các electron trong phân tử. Bài viết này sẽ giúp bạn hiểu rõ hơn về chất phân cực, đặc điểm của chúng, và các ứng dụng thực tiễn trong đời sống cũng như công nghiệp.
Mục lục
Chất Phân Cực Là Gì?
Trong hóa học, khái niệm "chất phân cực" đề cập đến những phân tử có sự phân bố không đều của các electron, dẫn đến việc hình thành các cực điện tích khác nhau trong phân tử. Các phân tử phân cực thường có một đầu mang điện tích dương và đầu kia mang điện tích âm.
1. Đặc điểm của chất phân cực
- Phân tử chất phân cực có sự chênh lệch đáng kể về độ âm điện giữa các nguyên tử liên kết.
- Chất phân cực có momen lưỡng cực rõ rệt, tức là có hai cực đối lập (dương và âm) trong phân tử.
- Các chất phân cực thường có khả năng hòa tan tốt trong các dung môi phân cực khác, như nước.
2. Liên kết phân cực
Liên kết phân cực xảy ra khi hai nguyên tử trong một phân tử có độ âm điện khác nhau, dẫn đến sự chia sẻ không đồng đều của các electron. Điều này làm cho một phần của phân tử trở nên âm hơn, trong khi phần còn lại trở nên dương hơn.
Ví dụ, trong phân tử nước (\(H_2O\)), nguyên tử oxy có độ âm điện cao hơn so với nguyên tử hydro, do đó, liên kết \(O-H\) trong phân tử nước là một liên kết phân cực. Nguyên tử oxy thu hút các electron mạnh hơn, khiến nó mang một phần điện tích âm, trong khi hai nguyên tử hydro mang một phần điện tích dương.
3. Dung môi phân cực và không phân cực
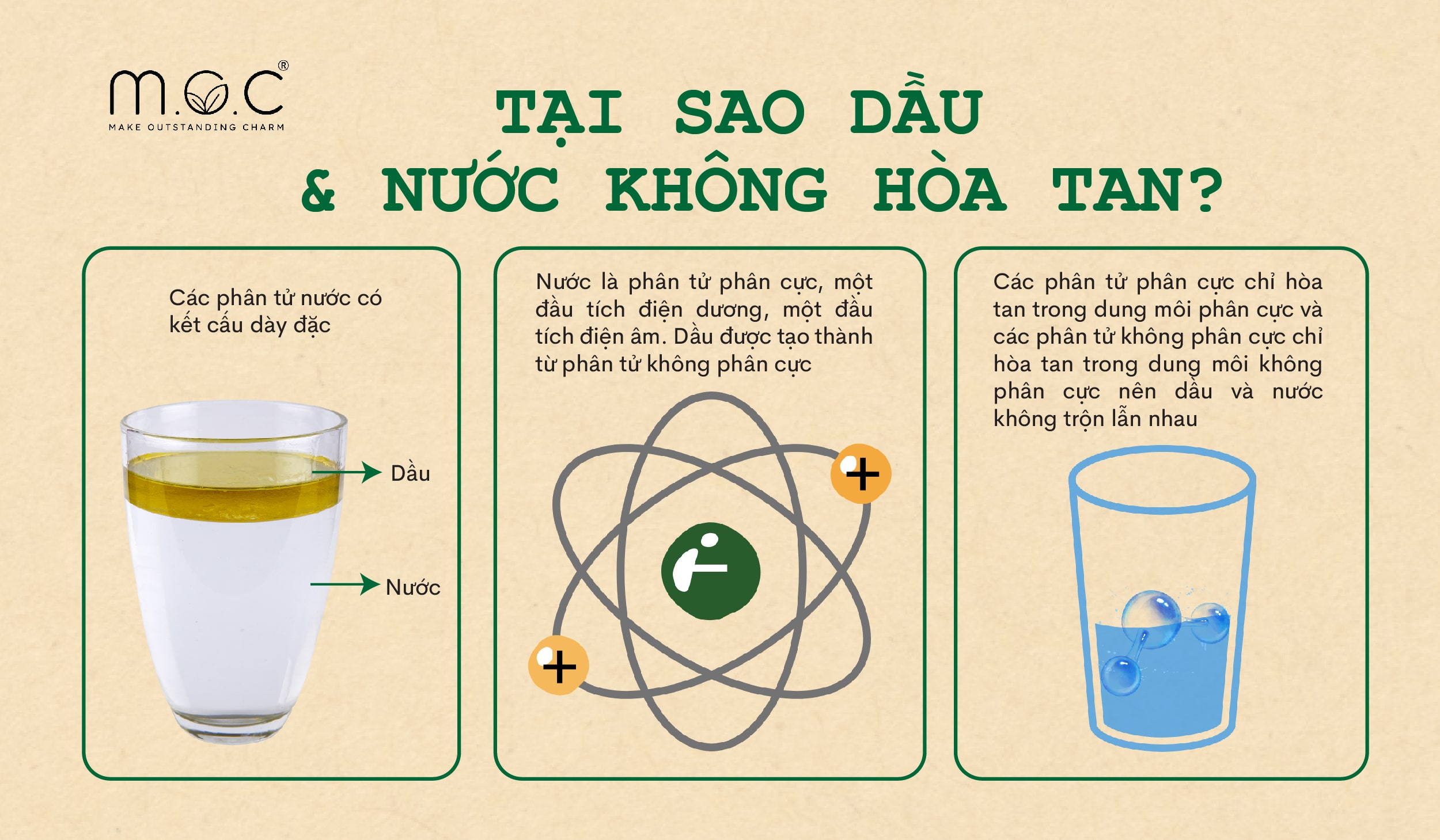
Chất phân cực thường hòa tan trong dung môi phân cực. Điều này xảy ra vì các phân tử phân cực tương tác mạnh với nhau thông qua các lực hút điện tích đối lập.
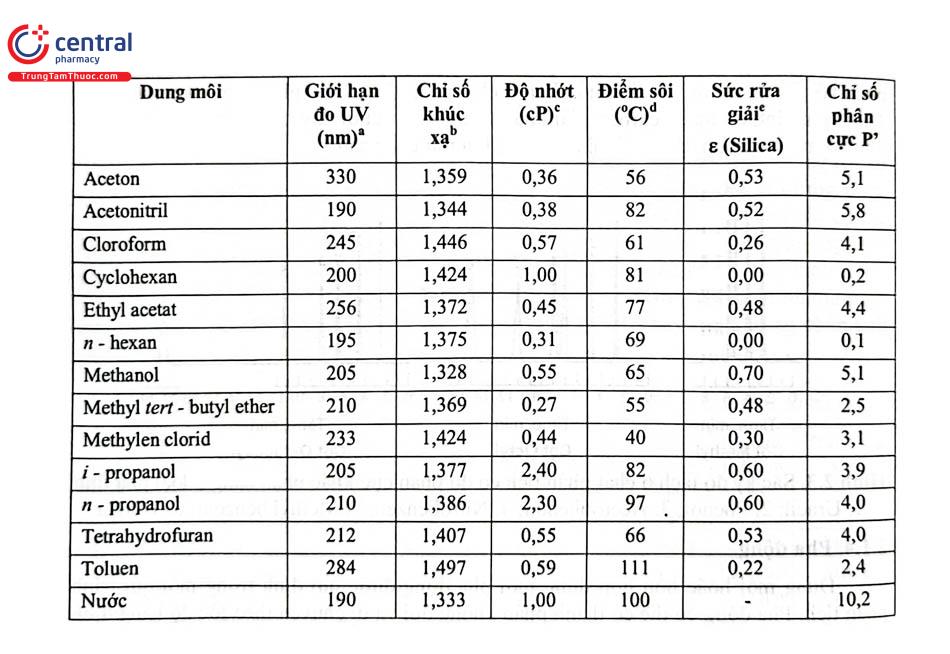
- Dung môi phân cực: Các ví dụ về dung môi phân cực bao gồm nước, methanol, và ethanol. Các dung môi này có khả năng hòa tan tốt các chất phân cực khác.
- Dung môi không phân cực: Các dung môi không phân cực như hexane, toluene, và benzen không thể hòa tan tốt các chất phân cực vì chúng thiếu các điện tích đối lập để tương tác với các chất phân cực.
4. Phân cực kế và ứng dụng
Phân cực kế là một thiết bị được sử dụng để đo mức độ phân cực của ánh sáng khi nó đi qua một chất. Điều này rất hữu ích trong việc xác định nồng độ của các dung dịch hoặc xác định đặc tính quang học của các hợp chất.
| Yếu tố ảnh hưởng | Góc quay quang học (\(\alpha\)) |
| Nồng độ mẫu | Càng cao, góc quay càng lớn |
| Chiều dài ống chứa mẫu | Càng dài, góc quay càng lớn |
| Nhiệt độ | Ảnh hưởng đến cấu trúc và mật độ phân tử |

.png)
Tổng Quan Về Chất Phân Cực
Chất phân cực là các hợp chất hóa học có sự phân bố không đồng đều của điện tích trong phân tử. Điều này xảy ra khi các nguyên tử trong phân tử có độ âm điện khác nhau, dẫn đến sự hình thành các momen lưỡng cực. Khi đó, một đầu của phân tử sẽ mang điện tích dương và đầu kia mang điện tích âm.
Các yếu tố chính ảnh hưởng đến tính phân cực của một chất bao gồm:
- Độ âm điện: Độ âm điện càng cao thì tính phân cực càng lớn. Nguyên tử có độ âm điện cao sẽ hút các electron về phía mình, tạo ra sự phân cực trong liên kết.
- Hình dạng phân tử: Cấu trúc không đối xứng của phân tử cũng góp phần làm tăng tính phân cực, do sự phân bố không đồng đều của các cặp electron.
- Momen lưỡng cực: Momen lưỡng cực \(\mu\) của phân tử được xác định bằng công thức \(\mu = q \times d\), trong đó \(q\) là điện tích và \(d\) là khoảng cách giữa các điện tích.
Tính phân cực của các chất có ảnh hưởng lớn đến các tính chất vật lý và hóa học của chúng, chẳng hạn như nhiệt độ sôi, nhiệt độ nóng chảy, độ hòa tan và khả năng phản ứng. Ví dụ, các chất phân cực thường dễ tan trong dung môi phân cực như nước, trong khi các chất không phân cực thường tan trong dung môi không phân cực như dầu.
Trong thực tế, chất phân cực được ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau như hóa học, sinh học, và công nghệ vật liệu. Chúng được sử dụng trong việc chế tạo các dung dịch, chất tẩy rửa, và các sản phẩm công nghiệp khác.
Các Liên Kết Phân Cực Và Không Phân Cực
Trong hóa học, các liên kết giữa các nguyên tử có thể được phân loại thành liên kết phân cực và không phân cực, tùy thuộc vào sự phân bố của các electron trong liên kết. Dưới đây là sự khác biệt giữa hai loại liên kết này:
1. Liên Kết Phân Cực
Liên kết phân cực hình thành khi hai nguyên tử có độ âm điện khác nhau đáng kể, dẫn đến sự phân bố không đều của các electron trong liên kết. Điều này tạo ra một đầu của phân tử mang điện tích âm và đầu kia mang điện tích dương, hình thành một momen lưỡng cực.
- Ví dụ: Liên kết giữa nguyên tử oxy và hydro trong phân tử nước \(\left(\text{H}_2\text{O}\right)\) là liên kết phân cực. Oxy có độ âm điện cao hơn hydro, do đó, các electron bị kéo về phía oxy nhiều hơn, tạo ra một đầu phân tử có điện tích âm và đầu kia có điện tích dương.
- Momen lưỡng cực: Momen lưỡng cực \(\mu\) được tính bằng công thức \(\mu = q \times d\), với \(q\) là điện tích và \(d\) là khoảng cách giữa các điện tích. Momen lưỡng cực càng lớn thì tính phân cực càng cao.
2. Liên Kết Không Phân Cực
Liên kết không phân cực xảy ra khi các nguyên tử có độ âm điện bằng nhau hoặc chênh lệch không đáng kể, dẫn đến sự phân bố đều của các electron. Trong loại liên kết này, không có sự hình thành momen lưỡng cực do không có sự phân bố điện tích không đồng đều.
- Ví dụ: Liên kết giữa hai nguyên tử hydro trong phân tử khí hidro \(\left(\text{H}_2\right)\) là liên kết không phân cực, vì cả hai nguyên tử đều có độ âm điện bằng nhau, dẫn đến sự chia sẻ electron đồng đều.
- Tính chất: Các phân tử có liên kết không phân cực thường không tan trong các dung môi phân cực như nước, nhưng tan trong các dung môi không phân cực như dầu.
Hiểu rõ sự khác biệt giữa liên kết phân cực và không phân cực giúp chúng ta giải thích được nhiều tính chất vật lý và hóa học của các chất, từ đó ứng dụng chúng trong các lĩnh vực khoa học và công nghiệp.

Dung Môi Phân Cực Và Không Phân Cực
Dung môi là một chất lỏng có khả năng hòa tan các chất khác để tạo thành dung dịch. Dung môi được phân loại thành hai loại chính: dung môi phân cực và dung môi không phân cực, dựa trên tính chất phân cực của chúng.
1. Dung Môi Phân Cực
Dung môi phân cực có các phân tử với momen lưỡng cực mạnh do sự chênh lệch độ âm điện giữa các nguyên tử trong phân tử. Các dung môi này thường có khả năng hòa tan tốt các chất phân cực khác và các ion.
- Ví dụ: Nước \(\left(\text{H}_2\text{O}\right)\) là một dung môi phân cực phổ biến. Nước có khả năng hòa tan nhiều chất khác nhau, từ muối \(\left(\text{NaCl}\right)\) đến các hợp chất hữu cơ như cồn \(\left(\text{C}_2\text{H}_5\text{OH}\right)\).
- Liên kết hydro: Dung môi phân cực như nước có thể tạo liên kết hydro với các phân tử khác, làm tăng khả năng hòa tan của chúng đối với các chất phân cực.
- Ứng dụng: Dung môi phân cực thường được sử dụng trong các phản ứng hóa học, trong công nghệ sinh học và trong công nghiệp sản xuất thực phẩm.
2. Dung Môi Không Phân Cực
Dung môi không phân cực có các phân tử mà momen lưỡng cực rất nhỏ hoặc không có. Chúng có khả năng hòa tan tốt các chất không phân cực khác như dầu mỡ, nhưng không hòa tan tốt các chất phân cực.
- Ví dụ: Hexan \(\left(\text{C}_6\text{H}_{14}\right)\) là một dung môi không phân cực phổ biến. Nó thường được sử dụng để chiết xuất dầu từ thực vật và các ứng dụng công nghiệp khác.
- Đặc điểm: Dung môi không phân cực không thể tạo liên kết hydro với các chất phân cực, do đó chúng không hòa tan tốt trong nước hoặc các dung môi phân cực.
- Ứng dụng: Dung môi không phân cực được sử dụng rộng rãi trong công nghiệp hóa dầu, sản xuất nhựa, và tẩy rửa công nghiệp.
Hiểu biết về dung môi phân cực và không phân cực là rất quan trọng trong hóa học và nhiều lĩnh vực khác, giúp chúng ta lựa chọn dung môi phù hợp cho các ứng dụng cụ thể.
Phân Cực Kế Và Ứng Dụng Trong Phân Tích Hóa Học
Phân cực kế là một thiết bị được sử dụng trong phân tích hóa học để đo độ quay của mặt phẳng ánh sáng phân cực khi nó đi qua một chất có khả năng quay ánh sáng. Độ quay này phụ thuộc vào bản chất của chất phân cực, nồng độ, độ dài của ống chứa mẫu và bước sóng của ánh sáng sử dụng.
1. Nguyên Lý Hoạt Động Của Phân Cực Kế
Phân cực kế hoạt động dựa trên nguyên lý ánh sáng phân cực. Khi ánh sáng thông thường đi qua bộ lọc phân cực, nó trở thành ánh sáng phân cực, nghĩa là các dao động của sóng ánh sáng bị giới hạn trong một mặt phẳng nhất định. Khi ánh sáng phân cực đi qua một dung dịch chứa chất quang hoạt, mặt phẳng phân cực của ánh sáng sẽ bị quay một góc nhất định. Góc quay này được đo bằng phân cực kế.
2. Các Loại Phân Cực Kế
- Phân cực kế một nửa bóng: Đây là loại phân cực kế cơ bản, sử dụng hai bộ lọc phân cực và một mắt lưới để xác định góc quay.
- Phân cực kế tự động: Được trang bị cảm biến quang điện tử và máy tính để tự động đo lường và ghi nhận kết quả, cho phép độ chính xác cao và giảm thiểu sai sót từ người sử dụng.
3. Ứng Dụng Của Phân Cực Kế Trong Phân Tích Hóa Học
Phân cực kế có nhiều ứng dụng trong phân tích hóa học, đặc biệt trong việc xác định nồng độ của các chất quang hoạt trong dung dịch, ví dụ như đo nồng độ đường trong ngành công nghiệp thực phẩm.
- Xác định độ tinh khiết: Phân cực kế giúp xác định độ tinh khiết của các hợp chất hữu cơ, như các loại đường và amino acid, thông qua việc đo độ quay quang học.
- Đo nồng độ: Trong ngành công nghiệp dược phẩm, phân cực kế được sử dụng để đo nồng độ của các hợp chất dược phẩm quang hoạt, đảm bảo chất lượng sản phẩm cuối cùng.
- Nghiên cứu cấu trúc phân tử: Phân cực kế còn được sử dụng trong nghiên cứu cấu trúc của các hợp chất hữu cơ, giúp xác định dạng lập thể (enantiomer) của các phân tử.
Phân cực kế là một công cụ quan trọng trong phân tích hóa học, với nhiều ứng dụng đa dạng từ công nghiệp thực phẩm đến dược phẩm, và nghiên cứu khoa học.

Mười Dạng Bài Tập Hoá Học Về Chất Phân Cực
-
Dạng 1: Xác định độ phân cực của các liên kết trong phân tử
Cho các phân tử: \( \text{H}_2\), \( \text{HCl}\), \( \text{CO}_2\),... Hãy xác định loại liên kết trong các phân tử này và giải thích mức độ phân cực của chúng.
-
Dạng 2: So sánh độ âm điện để dự đoán tính phân cực của liên kết
Dùng bảng độ âm điện để so sánh và dự đoán tính phân cực của các liên kết trong các phân tử như \( \text{H_2O} \), \( \text{CH_4} \), \( \text{NH_3} \),...
-
Dạng 3: Phân biệt chất phân cực và không phân cực bằng các tính chất vật lý
So sánh các chất \( \text{H_2O}\), \( \text{CCl_4}\), \( \text{CH_3OH}\),... dựa trên nhiệt độ sôi, độ tan trong nước, và độ nhớt để phân loại chúng thành chất phân cực hoặc không phân cực.
-
Dạng 4: Dự đoán hình dạng phân tử và tính phân cực
Sử dụng thuyết VSEPR để dự đoán hình dạng phân tử của \( \text{BF_3} \), \( \text{NH_3} \), \( \text{H_2O} \),... và xác định xem chúng có phân cực hay không.
-
Dạng 5: Ảnh hưởng của phân cực đến tính chất hóa học
Hãy so sánh tính axit/bazơ của các phân tử như \( \text{HF}\), \( \text{HCl}\), \( \text{HBr}\) dựa trên độ phân cực của liên kết.
-
Dạng 6: Ứng dụng của chất phân cực trong dung môi
Giải thích tại sao \( \text{H_2O} \) là một dung môi tốt cho các chất ion, nhưng không hoà tan được các chất không phân cực như dầu.
-
Dạng 7: Thực nghiệm về độ phân cực và tính tan
Thực hiện thí nghiệm với các chất \( \text{NaCl}\), \( \text{I_2}\), \( \text{C_6H_{14}} \)... trong các dung môi phân cực và không phân cực, và ghi nhận kết quả.
-
Dạng 8: Liên kết hydro và ảnh hưởng đến tính chất của nước
Giải thích cách liên kết hydro giữa các phân tử \( \text{H_2O} \) dẫn đến những tính chất đặc biệt như nhiệt độ sôi cao và độ nhớt.
-
Dạng 9: Phân cực và tương tác giữa các phân tử
Phân tích cách phân cực của phân tử \( \text{H_2O} \) ảnh hưởng đến sự hòa tan của các chất như \( \text{NaCl}\) trong nước.
-
Dạng 10: Tính toán độ phân cực của phân tử
Dùng mô hình cộng độ phân cực của các liên kết để tính toán tổng độ phân cực của các phân tử như \( \text{CO_2} \), \( \text{CH_4} \), \( \text{H_2O} \).