Chủ đề nacl có phân cực không: NaCl, hay còn gọi là muối ăn, là một hợp chất hóa học phổ biến với nhiều ứng dụng trong đời sống và công nghiệp. Vậy NaCl có phân cực không? Bài viết này sẽ giải đáp câu hỏi này và khám phá chi tiết về cấu trúc phân tử, tính chất hóa học, và ứng dụng thực tế của NaCl trong cuộc sống hàng ngày.
Mục lục
- Tính Phân Cực của NaCl
- Mục Lục
- 10 Dạng Bài Tập Toán Học, Vật Lý hoặc Tiếng Anh
- Bài Tập 1: Tính Toán Độ Tan Của NaCl Trong Nước Ở Các Nhiệt Độ Khác Nhau
- Bài Tập 2: Phân Tích Quá Trình Điện Phân NaCl Trong Phòng Thí Nghiệm
- Bài Tập 3: Bài Tập Về Cân Bằng Phương Trình Hóa Học Có Sự Tham Gia Của NaCl
- Bài Tập 4: Bài Tập Vật Lý Về Điện Dung và Điện Trở Liên Quan Đến Dung Dịch NaCl
- Bài Tập 5: Giải Thích Tính Phân Cực Trong Các Hợp Chất Khác và So Sánh Với NaCl
- Bài Tập 6: Ứng Dụng Của NaCl Trong Các Thí Nghiệm Hóa Học Thực Tế
- Bài Tập 7: Bài Tập Hóa Học Liên Quan Đến Phản Ứng Trao Đổi Có NaCl
- Bài Tập 8: Tính Toán Nồng Độ Dung Dịch NaCl Trong Các Hỗn Hợp Khác Nhau
- Bài Tập 9: Bài Tập Tiếng Anh Về Các Thuật Ngữ Liên Quan Đến NaCl
- Bài Tập 10: Xác Định Các Ứng Dụng Khác Nhau Của NaCl Trong Công Nghệ Mới
Tính Phân Cực của NaCl
NaCl (Natri Clorua) là một hợp chất ion được tạo thành từ các ion natri \((Na^+)\) và clorua \((Cl^-)\). Tính chất của NaCl phụ thuộc vào cấu trúc ion của nó.
1. NaCl có phân cực hay không?
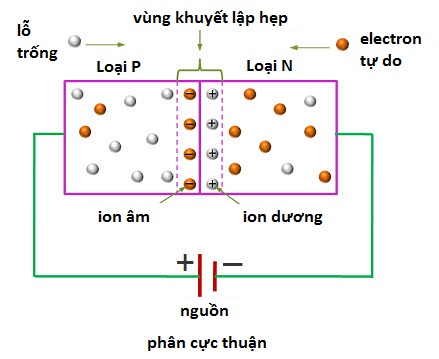
NaCl là một hợp chất ion, do đó, nó không có phân cực theo nghĩa thông thường của các phân tử có liên kết cộng hóa trị. Phân cực xảy ra trong các phân tử khi có sự chia sẻ không đều của các electron trong một liên kết cộng hóa trị, dẫn đến một đầu của phân tử có điện tích dương và đầu kia có điện tích âm. Trong trường hợp của NaCl, liên kết giữa natri và clo là liên kết ion, trong đó natri mất một electron để trở thành ion dương \((Na^+)\) và clo nhận một electron để trở thành ion âm \((Cl^-)\). Sự tương tác giữa các ion này là do lực điện tĩnh, chứ không phải là phân cực cộng hóa trị.
2. Tính chất vật lý và hóa học của NaCl
- Trạng thái: NaCl tồn tại dưới dạng tinh thể rắn ở nhiệt độ phòng.
- Độ tan: NaCl tan rất tốt trong nước. Khi hòa tan, nó phân ly thành các ion \((Na^+)\) và \((Cl^-)\).
- Điểm nóng chảy và điểm sôi: NaCl có điểm nóng chảy cao (801°C) và điểm sôi cao (1413°C), điều này cho thấy liên kết ion rất mạnh mẽ.
- Tính dẫn điện: Trong trạng thái rắn, NaCl không dẫn điện vì các ion không thể di chuyển tự do. Tuy nhiên, khi tan trong nước hoặc ở trạng thái nóng chảy, các ion tự do di chuyển và dẫn điện.
3. Ứng dụng của NaCl trong đời sống và công nghiệp
NaCl có nhiều ứng dụng quan trọng trong cả đời sống hàng ngày và công nghiệp:
- Gia vị và bảo quản thực phẩm: NaCl được sử dụng rộng rãi làm gia vị trong nấu ăn và bảo quản thực phẩm nhờ khả năng hút nước và ngăn chặn sự phát triển của vi khuẩn.
- Công nghiệp hóa chất: NaCl là nguyên liệu chính trong sản xuất clo, xút \((NaOH)\), và nhiều hợp chất hóa học khác qua quá trình điện phân dung dịch NaCl.
- Điều chế nước muối: NaCl được dùng để tạo dung dịch nước muối phục vụ cho các quá trình xử lý nước và làm mềm nước trong các hệ thống lọc nước.
4. Điện phân dung dịch NaCl
Trong công nghiệp, quá trình điện phân dung dịch NaCl được thực hiện để sản xuất clo, khí hydro, và dung dịch xút \((NaOH)\). Phản ứng điện phân của dung dịch NaCl có thể được biểu diễn như sau:
\[2NaCl (aq) + 2H_2O (l) \rightarrow Cl_2 (g) + H_2 (g) + 2NaOH (aq)\]
Quá trình này yêu cầu một màng ngăn để tách riêng các sản phẩm khí clo và khí hydro, ngăn chúng phản ứng lại với nhau và tạo ra các phản ứng không mong muốn.
5. Tính an toàn và môi trường
NaCl an toàn khi sử dụng trong điều kiện thông thường và không gây hại cho môi trường với lượng nhỏ. Tuy nhiên, lượng NaCl lớn có thể ảnh hưởng tiêu cực đến các nguồn nước và đất nông nghiệp, do đó cần quản lý hợp lý việc sử dụng và thải bỏ NaCl.
Qua các thông tin trên, có thể thấy rằng NaCl, mặc dù không phân cực như các phân tử liên kết cộng hóa trị, nhưng vẫn đóng vai trò quan trọng trong nhiều lĩnh vực của cuộc sống và công nghiệp nhờ tính chất hóa học và vật lý độc đáo của nó.
.png)
Mục Lục
1. NaCl Là Gì?
Tổng quan về hợp chất NaCl và ứng dụng phổ biến trong đời sống hàng ngày.
2. Cấu Trúc Phân Tử Của NaCl
Giải thích chi tiết về cấu trúc phân tử của NaCl và các liên kết hóa học.
3. NaCl Có Phân Cực Không?
Phân tích các đặc tính phân cực của NaCl và so sánh với các hợp chất khác.
Lý giải tại sao NaCl được xem là một hợp chất ion không phân cực.
4. Tính Chất Hóa Học và Vật Lý Của NaCl
Khám phá tính chất hóa học và vật lý nổi bật của NaCl.
Ứng dụng của NaCl trong các phản ứng hóa học và đời sống.
5. Các Ứng Dụng Của NaCl Trong Đời Sống và Công Nghiệp
Công dụng của NaCl trong thực phẩm, y tế, và công nghiệp.
Ứng dụng NaCl trong quá trình sản xuất và công nghệ hiện đại.
6. NaCl Trong Nước: Hiện Tượng Phân Cực và Sự Hòa Tan
Cách NaCl hòa tan trong nước và tác động của phân cực.
7. So Sánh Tính Phân Cực Của NaCl Với Các Hợp Chất Khác
Sự khác biệt giữa tính phân cực của NaCl và các hợp chất ion khác.
8. Vai Trò Của NaCl Trong Hóa Học và Sinh Học
Tầm quan trọng của NaCl trong các quá trình hóa học và sinh học.
9. Câu Hỏi Thường Gặp Về NaCl và Tính Chất Phân Cực
Những câu hỏi phổ biến và giải đáp về NaCl và tính chất phân cực của nó.
10. Kết Luận: NaCl Có Phân Cực Không?
Tóm tắt và kết luận về tính chất phân cực của NaCl và ứng dụng thực tế.
10 Dạng Bài Tập Toán Học, Vật Lý hoặc Tiếng Anh
Bài Tập 1: Toán Học - Giải Phương Trình Bậc Nhất
Giải phương trình \(2x + 5 = 11\). Tìm giá trị của \(x\).
Bài Tập 2: Toán Học - Tính Giá Trị Biểu Thức
Tính giá trị của biểu thức \((3x^2 - 2x + 1)\) khi \(x = 2\).
Bài Tập 3: Vật Lý - Tính Áp Suất
Một vật có trọng lượng \(200 \, \text{N}\) và diện tích tiếp xúc với mặt đất là \(0.5 \, \text{m}^2\). Tính áp suất mà vật này gây ra lên mặt đất.
Bài Tập 4: Vật Lý - Tính Công Suất Điện
Một thiết bị điện hoạt động với công suất \(150 \, \text{W}\) trong thời gian \(2 \, \text{giờ}\). Tính năng lượng tiêu thụ của thiết bị này.
Bài Tập 5: Vật Lý - Chuyển Động Thẳng Biến Đổi Đều
Một xe chuyển động thẳng với gia tốc \(2 \, \text{m/s}^2\) trong \(10 \, \text{s}\). Tính quãng đường mà xe đã đi được.
Bài Tập 6: Tiếng Anh - Điền Từ Vào Chỗ Trống
Complete the sentence: "She ___ (go) to school every day."
Bài Tập 7: Tiếng Anh - Đổi Câu Trực Tiếp Sang Gián Tiếp
Change the direct speech to reported speech: "John said, 'I am reading a book now.'"
Bài Tập 8: Toán Học - Hình Học
Tính diện tích của tam giác có chiều cao \(h = 5 \, \text{cm}\) và đáy \(b = 8 \, \text{cm}\).
Bài Tập 9: Vật Lý - Định Luật Ohm
Tính cường độ dòng điện chạy qua mạch điện có điện trở \(10 \, \Omega\) và hiệu điện thế \(5 \, \text{V}\).
Bài Tập 10: Tiếng Anh - Viết Lại Câu
Rewrite the sentence without changing its meaning: "Despite the rain, they went for a walk."

Bài Tập 1: Tính Toán Độ Tan Của NaCl Trong Nước Ở Các Nhiệt Độ Khác Nhau
Để tính toán độ tan của muối NaCl (natri clorua) trong nước ở các nhiệt độ khác nhau, chúng ta cần hiểu rõ các yếu tố ảnh hưởng đến quá trình hòa tan và cách tính toán dựa trên dữ liệu thí nghiệm.
1. Độ tan của NaCl trong nước
Độ tan của một chất là lượng chất đó có thể hòa tan trong một lượng dung môi nhất định ở một nhiệt độ cụ thể để tạo thành một dung dịch bão hòa. Đối với NaCl, độ tan thay đổi theo nhiệt độ.
2. Bảng dữ liệu độ tan của NaCl trong nước ở các nhiệt độ khác nhau
| Nhiệt độ (°C) | Độ tan của NaCl (g/100g nước) |
|---|---|
| 0 | 35.7 |
| 20 | 36.0 |
| 40 | 36.6 |
| 60 | 37.3 |
| 80 | 38.0 |
| 100 | 39.2 |
3. Cách tính toán độ tan của NaCl
Để tính toán lượng NaCl cần thiết để tạo dung dịch bão hòa ở một nhiệt độ cụ thể, sử dụng công thức:
Ví dụ: Để tính lượng NaCl cần hòa tan trong 200g nước ở 20°C:
- Độ tan ở 20°C = 36 g/100g nước
- Lượng NaCl cần thiết = \(36 \, \text{g/100g nước} \times 200 \, \text{g nước} = 72 \, \text{g}\)
4. Thực hành bài tập
Sử dụng bảng dữ liệu trên để trả lời các câu hỏi sau:
- Tính lượng NaCl cần hòa tan trong 150g nước ở 40°C.
- So sánh độ tan của NaCl ở 0°C và 100°C và giải thích sự khác biệt.
- Nếu bạn có 50g NaCl và 200g nước, ở nhiệt độ nào thì dung dịch sẽ bão hòa?
Chúc bạn thành công trong việc tính toán và hiểu rõ hơn về quá trình hòa tan của NaCl trong nước!

Bài Tập 2: Phân Tích Quá Trình Điện Phân NaCl Trong Phòng Thí Nghiệm
Điện phân là quá trình sử dụng dòng điện để thúc đẩy một phản ứng hóa học. Trong bài tập này, chúng ta sẽ phân tích quá trình điện phân dung dịch NaCl trong phòng thí nghiệm để hiểu rõ hơn về các sản phẩm tạo thành và các yếu tố ảnh hưởng đến quá trình này.
1. Giới thiệu về quá trình điện phân NaCl
Khi điện phân dung dịch NaCl (natri clorua), các ion trong dung dịch sẽ di chuyển đến các điện cực khác nhau dưới tác dụng của dòng điện. Quá trình này sẽ tạo ra khí clo (Cl2) tại cực dương (anode) và khí hydro (H2) cùng với dung dịch NaOH (natri hydroxide) tại cực âm (cathode).
2. Phương trình điện phân NaCl
Phương trình điện phân dung dịch NaCl có thể được biểu diễn như sau:
Tổng phương trình:
3. Thiết lập thí nghiệm điện phân
- Chuẩn bị dung dịch NaCl trong bình điện phân.
- Sử dụng hai điện cực trơ (thường là graphit hoặc platinum) được nối với nguồn điện một chiều.
- Điện cực dương (anode) sẽ tạo ra khí Cl2, còn điện cực âm (cathode) sẽ tạo ra khí H2 và dung dịch NaOH.
4. Quan sát và phân tích kết quả
Trong quá trình điện phân, cần quan sát sự hình thành khí tại các điện cực. Khí clo có màu vàng lục và có mùi đặc trưng, trong khi khí hydro không màu và không mùi.
5. Các yếu tố ảnh hưởng đến quá trình điện phân
- Nồng độ dung dịch: Nồng độ NaCl ảnh hưởng đến tốc độ tạo ra sản phẩm.
- Dòng điện: Cường độ dòng điện cao hơn sẽ tăng tốc độ điện phân nhưng có thể gây ra hiện tượng phụ.
- Nhiệt độ: Nhiệt độ cao hơn có thể làm tăng tốc độ phản ứng nhưng cũng làm tăng tốc độ bay hơi của nước.
6. Bài tập thực hành
- Tính lượng khí Cl2 và H2 tạo ra khi điện phân 100 ml dung dịch NaCl 0.5M trong 30 phút với dòng điện 1A.
- Giải thích vì sao dung dịch sau khi điện phân có tính bazơ.
- Xác định các yếu tố có thể thay đổi để tối ưu hóa sản lượng khí tạo thành trong quá trình điện phân.
Hãy thực hành và phân tích kỹ lưỡng các kết quả để hiểu rõ hơn về quá trình điện phân NaCl và các ứng dụng thực tế của nó.

Bài Tập 3: Bài Tập Về Cân Bằng Phương Trình Hóa Học Có Sự Tham Gia Của NaCl
Cân bằng phương trình hóa học là một kỹ năng quan trọng trong hóa học, giúp chúng ta hiểu rõ hơn về số lượng chất phản ứng và sản phẩm trong một phản ứng hóa học. Trong bài tập này, chúng ta sẽ thực hành cân bằng các phương trình hóa học có sự tham gia của NaCl (Natri clorua).
1. Phương pháp cân bằng phương trình hóa học
Để cân bằng một phương trình hóa học, chúng ta cần đảm bảo số nguyên tử của mỗi nguyên tố ở bên phản ứng (trái) và bên sản phẩm (phải) phải bằng nhau. Các bước thực hiện như sau:
- Viết công thức hóa học của các chất tham gia và sản phẩm của phản ứng.
- Đếm số nguyên tử của mỗi nguyên tố ở cả hai vế của phương trình.
- Thay đổi hệ số trước các công thức để cân bằng số nguyên tử của mỗi nguyên tố.
- Kiểm tra lại số nguyên tử của mỗi nguyên tố để đảm bảo phương trình đã được cân bằng.
2. Ví dụ bài tập cân bằng phương trình có NaCl
Dưới đây là một số ví dụ về các phương trình hóa học có sự tham gia của NaCl cần cân bằng:
- Phản ứng giữa NaCl và AgNO3 để tạo thành AgCl và NaNO3: \[ \text{NaCl} + \text{AgNO}_3 \rightarrow \text{AgCl} + \text{NaNO}_3 \]
- Phản ứng giữa NaCl và H2SO4 tạo ra NaHSO4 và HCl: \[ \text{NaCl} + \text{H}_2\text{SO}_4 \rightarrow \text{NaHSO}_4 + \text{HCl} \]
- Phản ứng nhiệt phân NaCl với H2O: \[ \text{2NaCl} + \text{H}_2\text{O} \rightarrow \text{Cl}_2 + \text{H}_2 + \text{NaOH} \]
3. Bài tập thực hành cân bằng phương trình
- Cân bằng phương trình: \[ \text{NaCl} + \text{CaCO}_3 \rightarrow \text{CaCl}_2 + \text{Na}_2\text{CO}_3 \]
- Cân bằng phương trình: \[ \text{NaCl} + \text{MnO}_2 + \text{H}_2\text{SO}_4 \rightarrow \text{Cl}_2 + \text{MnSO}_4 + \text{NaHSO}_4 + \text{H}_2\text{O} \]
- Cân bằng phương trình: \[ \text{NaCl} + \text{H}_2\text{O} \rightarrow \text{HCl} + \text{NaOH} \]
Hãy thực hành cân bằng các phương trình trên để nắm vững kỹ năng này. Đảm bảo rằng mỗi nguyên tố có cùng số lượng nguyên tử ở cả hai vế của phương trình. Điều này sẽ giúp bạn hiểu sâu hơn về cách thức và quy tắc cân bằng phương trình hóa học.
XEM THÊM:
Bài Tập 4: Bài Tập Vật Lý Về Điện Dung và Điện Trở Liên Quan Đến Dung Dịch NaCl
Trong phòng thí nghiệm, khi nghiên cứu về các tính chất điện của dung dịch NaCl, chúng ta cần hiểu rõ về điện dung và điện trở của dung dịch này. Dưới đây là các bước phân tích và tính toán:
-
Điện trở suất của dung dịch NaCl:
Dung dịch NaCl có khả năng dẫn điện nhờ vào sự phân ly hoàn toàn của NaCl trong nước thành các ion Na+ và Cl-. Điện trở suất của dung dịch phụ thuộc vào nồng độ của NaCl. Công thức tính điện trở suất \(\rho\) của dung dịch NaCl:
\[ \rho = \frac{1}{\kappa} \]Trong đó, \(\kappa\) là độ dẫn điện của dung dịch.
-
Điện dung của dung dịch NaCl:
Điện dung \(C\) của một hệ điện hoá phụ thuộc vào diện tích các điện cực và khoảng cách giữa chúng trong dung dịch NaCl:
\[ C = \frac{\varepsilon \cdot A}{d} \]Với \(\varepsilon\) là hằng số điện môi của nước, \(A\) là diện tích bề mặt của điện cực, và \(d\) là khoảng cách giữa các điện cực.
-
Tính toán cụ thể:
- Giả sử dung dịch NaCl có nồng độ \(0.1 M\), điện trở suất của dung dịch là \(\rho = 1 \, \Omega \cdot m\).
- Điện cực có diện tích bề mặt \(A = 0.01 \, m^2\) và khoảng cách giữa các điện cực là \(d = 0.01 \, m\).
- Tính độ dẫn điện \(\kappa\) của dung dịch: \[ \kappa = \frac{1}{\rho} = \frac{1}{1 \, \Omega \cdot m} = 1 \, S \cdot m^{-1} \]
- Điện dung \(C\) của hệ điện hóa là: \[ C = \frac{\varepsilon \cdot A}{d} = \frac{8.854 \times 10^{-12} \cdot 0.01}{0.01} = 8.854 \times 10^{-12} \, F \]
-
Kết luận:
Qua bài tập này, chúng ta thấy rằng dung dịch NaCl trong nước có khả năng dẫn điện tốt và đặc trưng điện dung phụ thuộc nhiều vào cấu hình của các điện cực và đặc tính điện môi của môi trường dung dịch. Điều này cung cấp cơ sở cho các ứng dụng thực tế trong phân tích hóa học và vật lý trong phòng thí nghiệm.

Bài Tập 5: Giải Thích Tính Phân Cực Trong Các Hợp Chất Khác và So Sánh Với NaCl
Để hiểu rõ tính phân cực của NaCl, trước tiên chúng ta cần nắm vững khái niệm về phân cực trong các hợp chất hóa học. Phân cực xảy ra khi có sự chênh lệch về độ âm điện giữa các nguyên tử trong một phân tử, dẫn đến sự hình thành một lưỡng cực điện. Trong đó, một đầu của phân tử mang điện tích dương và đầu kia mang điện tích âm.
NaCl là một hợp chất ion, được hình thành từ sự kết hợp giữa nguyên tử natri (Na) và clo (Cl). Natri có độ âm điện thấp hơn clo, do đó, khi hai nguyên tử này kết hợp với nhau, electron từ natri sẽ bị hút về phía clo, tạo ra ion Na+ và Cl-. Tuy nhiên, do NaCl là hợp chất ion, chứ không phải là phân tử cộng hóa trị, nên nó không có phân cực theo nghĩa thông thường mà chúng ta thấy trong các phân tử cộng hóa trị.
Hãy so sánh với một số hợp chất cộng hóa trị khác:
- Nước (H2O): Đây là một hợp chất phân cực với cấu trúc phân tử không đối xứng. Nguyên tử oxy có độ âm điện cao hơn nhiều so với hydro, dẫn đến sự hình thành các lưỡng cực mạnh mẽ.
- Carbon dioxide (CO2): Mặc dù có sự khác biệt về độ âm điện giữa carbon và oxy, nhưng do cấu trúc phân tử đối xứng, các lưỡng cực trong CO2 triệt tiêu lẫn nhau, dẫn đến một phân tử không phân cực.
- Metan (CH4): Đây là một hợp chất không phân cực vì carbon và hydro có sự chênh lệch nhỏ về độ âm điện và cấu trúc của metan cũng đối xứng, nên không tạo ra lưỡng cực.
Từ các ví dụ trên, ta có thể thấy rằng tính phân cực phụ thuộc vào cả độ âm điện của các nguyên tố và cấu trúc hình học của phân tử. Đối với NaCl, do là hợp chất ion, nó tồn tại dưới dạng các ion riêng biệt khi hòa tan trong nước, và không có sự hình thành lưỡng cực như trong các phân tử cộng hóa trị.
Vì vậy, để giải thích tính phân cực của NaCl, cần phải nhấn mạnh rằng NaCl không có tính phân cực như các phân tử cộng hóa trị, mà thay vào đó là sự tách biệt hoàn toàn của các điện tích trong dung dịch.
Về bài tập, học sinh cần thực hiện các bước sau:
- So sánh độ âm điện giữa các nguyên tử trong các hợp chất đã cho (H2O, CO2, CH4, NaCl).
- Phân tích cấu trúc phân tử của từng hợp chất để xác định tính phân cực hoặc không phân cực.
- Trình bày lý do tại sao NaCl, dù có sự khác biệt lớn về độ âm điện, lại không có tính phân cực như các phân tử cộng hóa trị.
Kết quả của bài tập này sẽ giúp học sinh hiểu rõ hơn về sự khác biệt giữa các hợp chất ion và cộng hóa trị, cũng như tính chất phân cực trong hóa học.

Bài Tập 6: Ứng Dụng Của NaCl Trong Các Thí Nghiệm Hóa Học Thực Tế
NaCl (muối ăn) là một hợp chất quan trọng được sử dụng rộng rãi trong các thí nghiệm hóa học thực tế. Dưới đây là một số ứng dụng của NaCl trong các thí nghiệm mà bạn có thể thử nghiệm:
-
1. Điện Phân Dung Dịch NaCl
Trong thí nghiệm này, dung dịch NaCl được điện phân để tạo ra khí clo (\(Cl_2\)) và khí hydro (\(H_2\)). Thí nghiệm này thường được thực hiện để nghiên cứu quá trình điện phân và tạo ra các sản phẩm như NaOH và khí clo. Phương trình phản ứng:
\[ 2NaCl + 2H_2O \rightarrow 2NaOH + Cl_2 + H_2 \]
-
2. Xác Định Điểm Tan Của NaCl
Thí nghiệm này giúp xác định độ tan của NaCl trong nước ở các nhiệt độ khác nhau. Đây là một trong những thí nghiệm cơ bản để hiểu về tính chất hòa tan của muối và ảnh hưởng của nhiệt độ đến quá trình hòa tan.
-
3. Phản Ứng Trao Đổi Ion Với NaCl
NaCl có thể tham gia vào các phản ứng trao đổi ion, đặc biệt là trong các dung dịch điện ly. Thí nghiệm này giúp học sinh hiểu về phản ứng hóa học cơ bản liên quan đến muối và ứng dụng của nó trong việc làm mềm nước.
Phương trình phản ứng:
\[ NaCl + AgNO_3 \rightarrow AgCl + NaNO_3 \]
-
4. Sử Dụng NaCl Trong Phân Tích Lượng Clorua
NaCl thường được sử dụng làm chuẩn để xác định hàm lượng clorua trong mẫu. Điều này có ý nghĩa trong phân tích nước và kiểm tra chất lượng nước uống.
-
5. Thí Nghiệm Tạo Dung Dịch Bão Hòa NaCl
Dung dịch bão hòa của NaCl là một dạng đặc biệt khi NaCl không thể hòa tan thêm trong nước ở nhiệt độ phòng. Thí nghiệm này giúp hiểu rõ hơn về trạng thái cân bằng trong dung dịch.
Bài Tập 7: Bài Tập Hóa Học Liên Quan Đến Phản Ứng Trao Đổi Có NaCl
NaCl (natri clorua) là một hợp chất ion phổ biến được sử dụng trong nhiều thí nghiệm hóa học, đặc biệt là trong các phản ứng trao đổi ion. Dưới đây là một số bài tập hóa học liên quan đến phản ứng trao đổi có NaCl để các em học sinh thực hành và nắm vững kiến thức.
- Bài tập 1: Viết phương trình phản ứng trao đổi giữa dung dịch NaCl và AgNO3. Quan sát hiện tượng xảy ra và giải thích.
- Bài tập 2: Cho dung dịch NaCl tác dụng với BaCl2. Xác định sản phẩm tạo thành và giải thích vì sao lại có hiện tượng đó.
- Bài tập 3: Phân tích kết quả thí nghiệm khi cho NaCl tác dụng với dung dịch H2SO4 loãng. Viết phương trình hóa học và xác định các ion tham gia phản ứng.
- Bài tập 4: Xác định nồng độ mol của ion Cl- trong dung dịch sau khi trộn lẫn 100ml dung dịch NaCl 1M với 100ml dung dịch KNO3 1M.
Để giải các bài tập trên, các em cần nắm vững kiến thức về liên kết ion và các phản ứng trao đổi ion. Đặc biệt, cần hiểu rõ bản chất của các liên kết trong NaCl, một hợp chất ion phân cực, và cách chúng tương tác trong dung dịch.
Ví dụ, trong phản ứng trao đổi giữa NaCl và AgNO3, phương trình hóa học có thể được viết như sau:
Trong phản ứng này, AgCl là một muối không tan, do đó nó kết tủa ra khỏi dung dịch. Đây là một minh chứng cho sự trao đổi ion giữa Na+ và Ag+, cũng như Cl- và NO3-.
Các bài tập này không chỉ giúp củng cố kiến thức về phản ứng trao đổi ion mà còn làm rõ tầm quan trọng của NaCl trong các thí nghiệm hóa học thực tế.

Bài Tập 8: Tính Toán Nồng Độ Dung Dịch NaCl Trong Các Hỗn Hợp Khác Nhau
Trong bài tập này, chúng ta sẽ tìm hiểu cách tính toán nồng độ của dung dịch NaCl trong các hỗn hợp khác nhau. NaCl là một hợp chất ion được tạo thành từ cation Na+ và anion Cl-. Khi hòa tan trong nước, NaCl phân ly hoàn toàn thành các ion riêng rẽ:
\[\text{NaCl (rắn)} \rightarrow \text{Na}^{+} (dung dịch) + \text{Cl}^{-} (dung dịch)\]
Dưới đây là các bước cơ bản để tính toán nồng độ của dung dịch NaCl:
- Xác định khối lượng của NaCl ban đầu có trong hỗn hợp.
- Tính thể tích của dung dịch nước (H2O) mà NaCl được hòa tan vào.
- Sử dụng công thức nồng độ phần trăm khối lượng để tính nồng độ dung dịch:
\[\text{Nồng độ phần trăm khối lượng} = \left( \frac{\text{Khối lượng NaCl}}{\text{Khối lượng dung dịch}} \right) \times 100\%\]
Ví dụ, nếu ta có 5 gam NaCl hòa tan trong 100 ml nước, nồng độ phần trăm khối lượng của NaCl trong dung dịch sẽ được tính như sau:
\[\text{Nồng độ} = \left( \frac{5 \, \text{g NaCl}}{100 \, \text{g dung dịch}} \right) \times 100\% = 5\%\]
Trong trường hợp dung dịch NaCl được pha trộn với các dung dịch khác, chúng ta cần tính toán lại khối lượng và thể tích hỗn hợp mới để xác định nồng độ cuối cùng:
- Xác định khối lượng tổng hợp của các dung dịch sau khi trộn.
- Tính thể tích tổng hợp của hỗn hợp dung dịch mới.
- Sử dụng công thức đã nêu trên để tính toán nồng độ NaCl trong hỗn hợp mới.
Như vậy, thông qua bài tập này, học sinh sẽ có thể áp dụng các kiến thức về tính chất lý hóa của NaCl cũng như các kỹ năng toán học để giải quyết các bài toán thực tế liên quan đến dung dịch muối ăn trong phòng thí nghiệm hoặc trong đời sống.
Bài Tập 9: Bài Tập Tiếng Anh Về Các Thuật Ngữ Liên Quan Đến NaCl
Trong bài tập này, chúng ta sẽ cùng tìm hiểu và áp dụng các thuật ngữ tiếng Anh liên quan đến muối ăn, hay còn gọi là NaCl (Sodium Chloride). Đây là một phần quan trọng trong lĩnh vực hóa học, đặc biệt là khi nghiên cứu về các phản ứng trao đổi ion và tính chất của các hợp chất ion.
Dưới đây là một số thuật ngữ cơ bản bạn cần nắm vững:
- Electrolyte: Chất điện ly, là chất có khả năng dẫn điện khi tan trong nước hoặc khi nóng chảy.
- Polar Compound: Hợp chất phân cực, có sự phân bố không đồng đều của các điện tích trên các nguyên tử.
- Ionic Bond: Liên kết ion, là loại liên kết hóa học được hình thành giữa các ion mang điện tích trái dấu.
- Solubility: Độ tan, chỉ khả năng của một chất hòa tan trong dung môi nhất định, ví dụ như NaCl hòa tan tốt trong nước.
Để kiểm tra hiểu biết của bạn, hãy dịch các câu sau đây sang tiếng Việt và giải thích chúng:
- Sodium chloride is an essential electrolyte in the human body, crucial for maintaining fluid balance and nerve function.
- The ionic bond between sodium (Na+) and chloride (Cl-) makes NaCl a stable compound in various environments.
- When dissolved in water, NaCl dissociates into its ions, which are essential for conducting electricity.
Đáp án của bạn sẽ giúp củng cố kiến thức về cách sử dụng thuật ngữ tiếng Anh trong bối cảnh khoa học, đặc biệt là trong các thí nghiệm và ứng dụng liên quan đến NaCl.
Bài Tập 10: Xác Định Các Ứng Dụng Khác Nhau Của NaCl Trong Công Nghệ Mới
NaCl (Natri clorua) không chỉ là một loại muối ăn quen thuộc mà còn đóng vai trò quan trọng trong nhiều lĩnh vực công nghệ hiện đại. Dưới đây là các ứng dụng khác nhau của NaCl trong công nghệ mới:
- Điện phân để sản xuất hóa chất: NaCl được sử dụng trong quá trình điện phân để sản xuất các hợp chất như Natri Hydroxide (NaOH), Chlorine (Cl₂), và Hydro (H₂). Quá trình này không chỉ hiệu quả mà còn tiết kiệm chi phí và an toàn cho người sử dụng.
- Ứng dụng trong công nghệ năng lượng: NaCl được sử dụng trong các quá trình khai thác năng lượng tái tạo, như pin nhiệt và hệ thống lưu trữ năng lượng, giúp nâng cao hiệu suất và độ bền của các thiết bị.
- Chất xúc tác trong công nghiệp: NaCl được sử dụng như một chất xúc tác trong nhiều phản ứng hóa học, đặc biệt trong các quá trình công nghiệp sản xuất hóa chất và dược phẩm.
- Xử lý nước và bảo vệ môi trường: NaCl đóng vai trò quan trọng trong các quy trình xử lý nước, giúp loại bỏ các chất gây ô nhiễm và bảo vệ môi trường. Ngoài ra, NaCl còn được sử dụng trong việc tạo màng lọc, cải thiện chất lượng nước.
Với các ứng dụng đa dạng này, NaCl không chỉ là một nguyên liệu quan trọng trong cuộc sống hàng ngày mà còn là một yếu tố không thể thiếu trong sự phát triển của công nghệ mới, góp phần vào sự tiến bộ của xã hội.