Chủ đề so sánh độ phân cực: So sánh độ phân cực là một yếu tố quan trọng trong việc hiểu về liên kết hóa học và tính chất vật lý của các phân tử. Bài viết này sẽ giúp bạn tìm hiểu sâu hơn về khái niệm độ phân cực, các yếu tố ảnh hưởng, và cách nó được áp dụng trong hóa học và đời sống hàng ngày.
Mục lục
- So Sánh Độ Phân Cực
- Mục Lục Tổng Hợp
- Bài Tập Thực Hành
- Bài Tập 1: So Sánh Độ Phân Cực của H₂O, H₂S, và H₂Se
- Bài Tập 2: Tính Mô Men Lưỡng Cực của HCl
- Bài Tập 3: So Sánh Liên Kết Cộng Hóa Trị Phân Cực và Liên Kết Ion Phân Cực
- Bài Tập 4: Phân Tích Độ Phân Cực Của Các Chất NH₃, PH₃, AsH₃, SbH₃
- Bài Tập 5: So Sánh Độ Phân Cực Trong Các Phân Tử HF, HCl, HBr, HI
- Bài Tập 6: Đánh Giá Ảnh Hưởng Của Độ Phân Cực Đến Tính Chất Vật Lý Của Phân Tử
- Bài Tập 7: Liên Kết Phân Cực Trong Phân Tử H₂O So Với CH₄
- Bài Tập 8: So Sánh Độ Phân Cực Của CsCl và BaF₂
- Bài Tập 9: Xác Định Độ Phân Cực Trong Phân Tử CO₂
- Bài Tập 10: Ứng Dụng Độ Phân Cực Trong Thiết Kế Thuốc
So Sánh Độ Phân Cực
Độ phân cực của các liên kết hóa học và ánh sáng có thể được so sánh dựa trên các yếu tố như sự khác biệt độ âm điện giữa các nguyên tử trong liên kết và cách ánh sáng tương tác với các bộ lọc phân cực. Độ phân cực trong hóa học thường được thể hiện thông qua momen lưỡng cực, trong khi độ phân cực ánh sáng được xác định qua định luật Malus.
So Sánh Độ Phân Cực Trong Hóa Học
Trong hóa học, độ phân cực của một liên kết được quyết định bởi sự khác biệt về độ âm điện giữa hai nguyên tử liên kết. Nếu sự khác biệt lớn, liên kết sẽ có tính phân cực cao.
- Momen lưỡng cực \(\mu\) được tính bằng công thức: \(\mu = Q \times r\)
- Độ phân cực cao khi giá trị momen lưỡng cực lớn.
- Ví dụ, trong phân tử HCl, momen lưỡng cực được xác định bởi hiệu độ âm điện giữa H và Cl, cùng với khoảng cách giữa chúng.
So Sánh Độ Phân Cực Của Ánh Sáng
Độ phân cực của ánh sáng được đo bằng cường độ ánh sáng truyền qua hai bộ lọc phân cực. Định luật Malus mô tả cường độ ánh sáng truyền qua bộ lọc phụ thuộc vào góc giữa các trục của hai bộ lọc.
- Cường độ ánh sáng sau bộ lọc thứ hai được tính bằng: \[ I = I_0 \cos^2(\theta) \]
- Góc \(\theta\) bằng 0° cho phép ánh sáng truyền qua hoàn toàn, trong khi \(\theta\) bằng 90° sẽ chặn hoàn toàn ánh sáng.
- Độ phân cực của ánh sáng được sử dụng trong nhiều ứng dụng quang học và công nghệ.
Bảng So Sánh Độ Phân Cực
| Yếu Tố | Độ Phân Cực Hóa Học | Độ Phân Cực Ánh Sáng |
|---|---|---|
| Nguyên Nhân | Sự khác biệt độ âm điện | Góc giữa các bộ lọc phân cực |
| Công Thức | \(\mu = Q \times r\) | \(I = I_0 \cos^2(\theta)\) |
| Ứng Dụng | Xác định tính chất phân cực của phân tử | Kiểm soát và đo lường ánh sáng phân cực |

.png)
Mục Lục Tổng Hợp
1. Khái Niệm Độ Phân Cực
2. Các Yếu Tố Ảnh Hưởng Đến Độ Phân Cực
3. So Sánh Độ Phân Cực Giữa Các Loại Liên Kết Hóa Học
4. Phân Biệt Liên Kết Phân Cực và Không Phân Cực
5. Mối Quan Hệ Giữa Độ Phân Cực và Tính Chất Vật Lý của Phân Tử
6. Ứng Dụng của Độ Phân Cực trong Hóa Học và Đời Sống
7. Các Phương Pháp Tính Toán Độ Phân Cực
8. Bài Tập Thực Hành So Sánh Độ Phân Cực
Giới thiệu tổng quan về độ phân cực và tầm quan trọng của nó trong hóa học, bao gồm cách các phân tử phân cực và không phân cực tương tác với nhau.
Phân tích các yếu tố như cấu trúc phân tử, sự khác biệt về độ âm điện và mômen lưỡng cực ảnh hưởng đến độ phân cực của phân tử.
Đánh giá sự khác nhau về độ phân cực giữa các liên kết cộng hóa trị, liên kết ion, và liên kết cộng hóa trị phân cực.
So sánh sự khác biệt giữa liên kết phân cực và không phân cực thông qua ví dụ cụ thể, bao gồm cả ví dụ về dung môi phân cực và không phân cực.
Khám phá cách độ phân cực ảnh hưởng đến các tính chất vật lý như nhiệt độ sôi, độ tan, và sự tương tác giữa các phân tử.
Thảo luận về những ứng dụng thực tế của độ phân cực trong các ngành công nghiệp và trong cuộc sống hàng ngày, bao gồm mỹ phẩm và dược phẩm.
Hướng dẫn các phương pháp đo lường và tính toán độ phân cực, bao gồm sử dụng giá trị độ âm điện và mômen lưỡng cực.
Thực hành thông qua các bài tập cụ thể để so sánh độ phân cực của các phân tử khác nhau, ví dụ như H₂O, H₂S, H₂Se, và các liên kết ion như CsCl và BaF₂.
Bài Tập Thực Hành
Dưới đây là các bài tập thực hành để bạn có thể hiểu rõ hơn về độ phân cực trong các phân tử khác nhau và cách so sánh chúng. Hãy thực hiện các bài tập này để nắm vững kiến thức và áp dụng vào thực tế.
-
Bài Tập 1: So Sánh Độ Phân Cực Của H₂O, H₂S, Và H₂Se
Yêu cầu: Xác định dạng hình học và so sánh độ phân cực của các phân tử này.
Gợi ý: Hãy sử dụng lý thuyết VSEPR để xác định hình dạng phân tử và sau đó so sánh độ phân cực dựa trên độ âm điện của nguyên tố O, S và Se.
-
Bài Tập 2: Tính Mô Men Lưỡng Cực Của HCl
Yêu cầu: Sử dụng công thức tính mô men lưỡng cực \(\mu = Q \times r\) để tính giá trị mô men của HCl.
Gợi ý: Xác định khoảng cách \(r\) giữa các nguyên tử và điện tích \(Q\) để tính mô men lưỡng cực.
-
Bài Tập 3: So Sánh Độ Phân Cực Giữa Liên Kết Cộng Hóa Trị Phân Cực và Liên Kết Ion
Yêu cầu: Giải thích sự khác biệt về độ phân cực giữa hai loại liên kết này.
Gợi ý: Hãy sử dụng độ âm điện và cấu trúc tinh thể để phân tích sự khác biệt.
-
Bài Tập 4: Phân Tích Độ Phân Cực Của NH₃, PH₃, AsH₃, Và SbH₃
Yêu cầu: So sánh độ phân cực và giải thích sự biến đổi.
Gợi ý: Tập trung vào cấu trúc phân tử và sự khác biệt về độ âm điện giữa các nguyên tố nhóm 15.
-
Bài Tập 5: So Sánh Độ Phân Cực Trong Các Phân Tử HF, HCl, HBr, HI
Yêu cầu: Phân tích dựa trên độ âm điện của các nguyên tố.
Gợi ý: Hãy xem xét sự khác biệt về độ âm điện và kích thước nguyên tử của các nguyên tố halogen.
-
Bài Tập 6: Ảnh Hưởng Của Độ Phân Cực Đến Tính Chất Vật Lý Của Phân Tử
Yêu cầu: Thảo luận ảnh hưởng của độ phân cực đến nhiệt độ sôi và độ tan trong nước.
Gợi ý: Xem xét cách các phân tử phân cực tương tác với nhau và với dung môi phân cực.
-
Bài Tập 7: Liên Kết Phân Cực Trong Phân Tử H₂O So Với CH₄
Yêu cầu: Giải thích sự khác biệt về hình dạng phân tử và độ phân cực.
Gợi ý: So sánh góc liên kết và độ âm điện của các nguyên tử trong H₂O và CH₄.
-
Bài Tập 8: So Sánh Độ Phân Cực Của CsCl và BaF₂
Yêu cầu: Phân tích độ phân cực dựa trên cấu trúc tinh thể.
Gợi ý: Hãy xem xét kiểu mạng tinh thể và lực tương tác giữa các ion.
-
Bài Tập 9: Xác Định Độ Phân Cực Trong Phân Tử CO₂
Yêu cầu: Phân tích độ phân cực và dạng hình học của phân tử CO₂.
Gợi ý: CO₂ có dạng tuyến tính, hãy phân tích cách các cặp electron không phân cực cân bằng lẫn nhau.
-
Bài Tập 10: Ứng Dụng Độ Phân Cực Trong Thiết Kế Thuốc
Yêu cầu: Thảo luận ứng dụng của độ phân cực trong việc thiết kế các phân tử thuốc.
Gợi ý: Cân nhắc cách độ phân cực ảnh hưởng đến khả năng hòa tan và tương tác với các mục tiêu sinh học.

Bài Tập 1: So Sánh Độ Phân Cực của H₂O, H₂S, và H₂Se
Để so sánh độ phân cực của các phân tử H₂O, H₂S, và H₂Se, ta cần phân tích dạng hình học và momen lưỡng cực của từng phân tử.
- H₂O (Nước):
- Dạng hình học: Hình góc với góc liên kết khoảng 104,5°.
- Momen lưỡng cực: Khoảng 1,85 D. Điều này cho thấy H₂O có độ phân cực cao do sự khác biệt lớn về độ âm điện giữa O và H.
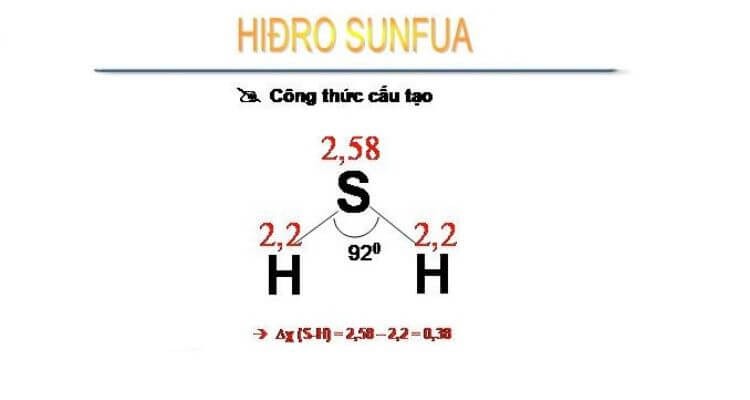
- H₂S (Hydrosulfuric):
- Dạng hình học: Cũng có dạng góc nhưng với góc liên kết khoảng 92°.
- Momen lưỡng cực: Khoảng 0,92 D. Độ phân cực của H₂S thấp hơn H₂O do S ít âm điện hơn O, dẫn đến sự phân cực không lớn bằng.
- H₂Se (Hydroselenic):
- Dạng hình học: Gần giống với H₂S với góc liên kết khoảng 91°.
- Momen lưỡng cực: Khoảng 0,24 D. Đây là phân tử ít phân cực nhất trong ba chất này vì Se có độ âm điện nhỏ hơn S và O.
Từ những dữ liệu trên, ta có thể kết luận rằng độ phân cực giảm dần từ H₂O đến H₂S và thấp nhất ở H₂Se, phản ánh sự giảm dần của độ âm điện của các nguyên tố trung tâm (O > S > Se).

XEM THÊM:
Bài Tập 2: Tính Mô Men Lưỡng Cực của HCl
Mô men lưỡng cực là một đại lượng quan trọng trong hóa học, thể hiện sự phân cực của một phân tử. Đối với phân tử HCl, mô men lưỡng cực được tính dựa trên hiệu điện tích và khoảng cách giữa hai nguyên tử H và Cl. Công thức chung để tính mô men lưỡng cực là:
- Bước 1: Xác định hiệu điện tích \((Q)\). Đối với HCl, hiệu điện tích được tính dựa trên sự khác biệt độ âm điện giữa hai nguyên tử. Độ âm điện của Cl cao hơn H, do đó Cl mang điện tích âm một phần và H mang điện tích dương một phần.
- Bước 2: Xác định khoảng cách \((r)\) giữa hai nguyên tử H và Cl. Khoảng cách này có thể được đo trực tiếp hoặc thông qua các kỹ thuật thực nghiệm như phổ hồng ngoại.
- Bước 3: Sử dụng công thức \(\mu = Q \times r\) để tính mô men lưỡng cực. Đơn vị thường dùng cho mô men lưỡng cực là Debye (D).
Ví dụ, nếu hiệu điện tích \(Q\) là \(4.8 \times 10^{-10}\) esu và khoảng cách \(r\) là \(1.27 \times 10^{-8}\) cm, mô men lưỡng cực của HCl có thể được tính như sau:
Như vậy, mô men lưỡng cực của HCl là 1.03 D, cho thấy phân tử này có sự phân cực đáng kể.

Bài Tập 3: So Sánh Liên Kết Cộng Hóa Trị Phân Cực và Liên Kết Ion Phân Cực
Trong hóa học, việc so sánh giữa liên kết cộng hóa trị phân cực và liên kết ion phân cực rất quan trọng để hiểu rõ về tính chất và hành vi của các hợp chất hóa học. Hai loại liên kết này có những khác biệt cơ bản dựa trên cách thức chia sẻ hoặc chuyển electron.
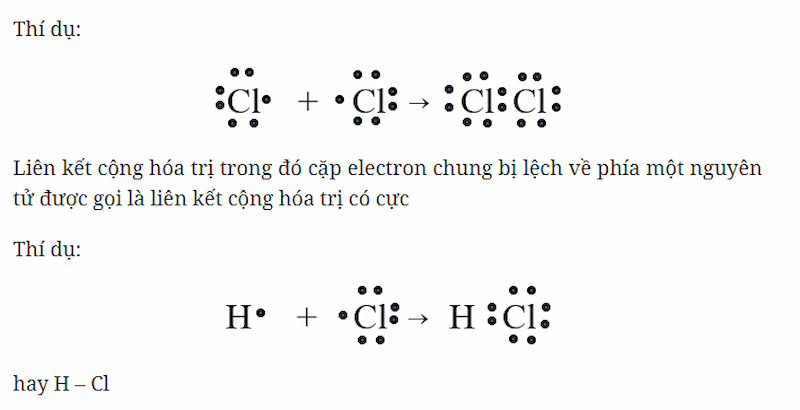
1. Liên Kết Cộng Hóa Trị Phân Cực
Liên kết cộng hóa trị phân cực xảy ra khi cặp electron chung bị hút lệch về phía nguyên tử có độ âm điện lớn hơn. Điều này tạo ra một cặp electron không chia sẻ đều, dẫn đến hình thành các lưỡng cực trong phân tử.
- Ví dụ: Phân tử HCl, với Δχ = 0,96 (3,16 - 2,2), có liên kết cộng hóa trị phân cực.
- Tính chất:
- Có nhiệt độ nóng chảy và sôi thấp hơn liên kết ion.
- Thường là các chất không dẫn điện ở trạng thái rắn.
2. Liên Kết Ion Phân Cực
Liên kết ion phân cực hình thành khi có sự chuyển hoàn toàn electron từ nguyên tử này sang nguyên tử khác, thường giữa kim loại và phi kim. Sự chuyển giao electron này tạo ra các ion có điện tích trái dấu, dẫn đến lực hút tĩnh điện mạnh giữa chúng.
- Ví dụ: Phân tử NaCl, với Δχ = 2,23 (3,16 - 0,93), có liên kết ion.
- Tính chất:
- Có nhiệt độ nóng chảy và sôi cao hơn do lực hút tĩnh điện mạnh mẽ.
- Dẫn điện khi tan trong nước hoặc ở trạng thái lỏng.
3. So Sánh Tổng Quan
| Đặc Điểm | Liên Kết Cộng Hóa Trị Phân Cực | Liên Kết Ion Phân Cực |
|---|---|---|
| Bản chất của liên kết | Cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn. | Electron chuyển hoàn toàn từ nguyên tử này sang nguyên tử khác, tạo ion. |
| Nhiệt độ nóng chảy và sôi | Thấp hơn | Cao hơn |
| Khả năng dẫn điện | Không dẫn điện ở trạng thái rắn | Dẫn điện khi tan hoặc ở trạng thái lỏng |
Bài tập này giúp chúng ta hiểu rõ hơn về cách mà các loại liên kết hóa học ảnh hưởng đến tính chất vật lý và hóa học của các hợp chất. Sự phân cực trong liên kết không chỉ quyết định khả năng tan, dẫn điện mà còn ảnh hưởng đến tính chất hóa học của các chất.
Bài Tập 4: Phân Tích Độ Phân Cực Của Các Chất NH₃, PH₃, AsH₃, SbH₃
Độ phân cực của các phân tử này phụ thuộc vào hình dạng phân tử và độ âm điện của nguyên tố trung tâm (N, P, As, Sb). Hãy thực hiện các bước sau để phân tích:
- Xác định hình dạng phân tử của từng chất. Tất cả các phân tử NH₃, PH₃, AsH₃, và SbH₃ đều có cấu trúc hình chóp tam giác, với một cặp electron tự do trên nguyên tử trung tâm.
- So sánh độ âm điện của các nguyên tố trung tâm:
- \( NH_3 \): Độ âm điện của N là 3.04.
- \( PH_3 \): Độ âm điện của P là 2.19.
- \( AsH_3 \): Độ âm điện của As là 2.18.
- \( SbH_3 \): Độ âm điện của Sb là 2.05.
- Dựa trên độ âm điện, NH₃ có độ phân cực lớn nhất vì chênh lệch độ âm điện giữa N và H cao hơn so với các chất còn lại.
- So sánh momen lưỡng cực:
- \( NH_3 \) có momen lưỡng cực cao do độ phân cực lớn và cấu trúc hình chóp bất đối xứng.
- PH₃, AsH₃, và SbH₃ có momen lưỡng cực nhỏ hơn do chênh lệch độ âm điện nhỏ hơn và lực đẩy giữa các cặp electron không liên kết giảm.
- So sánh nhiệt độ sôi: NH₃ có nhiệt độ sôi cao nhất do có liên kết hydro mạnh, trong khi PH₃, AsH₃, và SbH₃ có nhiệt độ sôi thấp hơn do không có liên kết hydro và lực Van der Waals yếu hơn.

Bài Tập 5: So Sánh Độ Phân Cực Trong Các Phân Tử HF, HCl, HBr, HI
Trong bài tập này, chúng ta sẽ so sánh độ phân cực của bốn phân tử halogen hydro: HF, HCl, HBr, và HI. Độ phân cực phụ thuộc vào sự khác biệt về độ âm điện giữa hai nguyên tử trong liên kết, và chiều dài liên kết.
- HF (Hydro florua):
- Độ âm điện của fluor (F) rất cao (khoảng 3.98 theo thang Pauling).
- Do đó, sự khác biệt độ âm điện giữa H và F là lớn nhất, làm cho HF có độ phân cực cao nhất trong số các phân tử được xét.
- Mô men lưỡng cực của HF là lớn nhất do liên kết H-F rất ngắn và mạnh.
- HCl (Hydro clorua):
- Độ âm điện của chlorine (Cl) thấp hơn F, khoảng 3.16.
- Điều này làm giảm độ phân cực so với HF, nhưng HCl vẫn còn khá phân cực do sự khác biệt độ âm điện đáng kể.
- Mô men lưỡng cực của HCl thấp hơn HF.
- HBr (Hydro bromua):
- Độ âm điện của brom (Br) là 2.96, nhỏ hơn Cl.
- Độ phân cực của HBr giảm so với HCl vì sự khác biệt độ âm điện nhỏ hơn.
- Mô men lưỡng cực của HBr tiếp tục giảm do chiều dài liên kết H-Br lớn hơn H-Cl.
- HI (Hydro iodua):
- Độ âm điện của iodine (I) là 2.66, thấp nhất trong các halogen được xét.
- Do đó, sự khác biệt độ âm điện giữa H và I nhỏ nhất, làm cho HI có độ phân cực thấp nhất.
- Liên kết H-I là dài nhất, và mô men lưỡng cực của HI cũng là nhỏ nhất.
Tóm lại, thứ tự độ phân cực của các phân tử là: \( \text{HF} > \text{HCl} > \text{HBr} > \text{HI} \). Điều này phản ánh sự giảm dần về độ âm điện và sự tăng dần về chiều dài liên kết từ HF đến HI.

Bài Tập 6: Đánh Giá Ảnh Hưởng Của Độ Phân Cực Đến Tính Chất Vật Lý Của Phân Tử
Độ phân cực của một phân tử ảnh hưởng rất lớn đến các tính chất vật lý của nó. Các phân tử có độ phân cực cao thường có lực tương tác mạnh hơn, dẫn đến các tính chất như nhiệt độ sôi và nhiệt độ nóng chảy cao hơn. Dưới đây là một số bài tập để đánh giá ảnh hưởng của độ phân cực đến tính chất vật lý của phân tử.
-
Bài tập 1: Hãy xem xét các phân tử H2O và CO2. Cả hai đều có khối lượng phân tử tương tự nhau, nhưng H2O có nhiệt độ sôi cao hơn nhiều so với CO2. Giải thích điều này dựa trên độ phân cực của chúng.
- H2O: Phân tử nước có hình dạng cong và là một phân tử phân cực do có sự khác biệt lớn về độ âm điện giữa oxy và hydro. Điều này tạo ra các liên kết hydro mạnh mẽ giữa các phân tử nước.
- CO2: Phân tử carbon dioxide có hình dạng tuyến tính và là một phân tử không phân cực do các cặp đôi điện tử cân bằng giữa các nguyên tử oxy và carbon.
-
Bài tập 2: So sánh độ phân cực và nhiệt độ sôi của CH3Cl (chloromethane) và CH4 (methane).
- CH3Cl: Đây là một phân tử phân cực do có nguyên tử chlorine có độ âm điện cao hơn so với carbon, tạo ra một moment lưỡng cực.
- CH4: Methane là một phân tử không phân cực với cấu trúc tứ diện đối xứng, không có moment lưỡng cực.
-
Bài tập 3: Giải thích tại sao NH3 (ammonia) có nhiệt độ sôi cao hơn so với PH3 (phosphine), dù cả hai đều có hình dạng hình chóp ba cạnh.
- NH3: Ammonia có độ phân cực cao do sự khác biệt lớn về độ âm điện giữa nitơ và hydro, cộng với khả năng tạo liên kết hydro mạnh.
- PH3: Phosphine có độ phân cực thấp hơn nhiều so với ammonia, không tạo liên kết hydro hiệu quả như ammonia.
Kết luận: Độ phân cực ảnh hưởng trực tiếp đến tính chất vật lý của phân tử, đặc biệt là nhiệt độ sôi, nhiệt độ nóng chảy, và khả năng hòa tan trong các dung môi phân cực. Các bài tập trên giúp làm rõ sự khác biệt về tính chất này giữa các phân tử phân cực và không phân cực.
Bài Tập 7: Liên Kết Phân Cực Trong Phân Tử H₂O So Với CH₄
Liên kết phân cực và hình dạng phân tử đóng vai trò quan trọng trong việc xác định tính chất hóa học của các phân tử. Trong bài tập này, chúng ta sẽ so sánh liên kết phân cực giữa hai phân tử H₂O (nước) và CH₄ (methane).
1. Cấu trúc phân tử và hình học:
- H₂O: Phân tử nước có hình dạng gấp khúc với góc liên kết O-H khoảng 104,5°. Nguyên tử Oxy có độ âm điện cao hơn đáng kể so với Hydro, dẫn đến sự hình thành hai liên kết phân cực. Điều này tạo ra một mô men lưỡng cực lớn, khiến H₂O trở thành một phân tử có cực.
- CH₄: Phân tử methane có cấu trúc tứ diện với góc liên kết H-C-H khoảng 109,5°. Vì Carbon và Hydro có độ âm điện gần nhau, các liên kết C-H hầu như không phân cực, dẫn đến CH₄ là một phân tử không cực.
2. Độ âm điện và tính phân cực:
- H₂O: Oxy có độ âm điện là 3,44 trong khi Hydro chỉ là 2,20. Sự chênh lệch lớn này khiến các cặp electron liên kết bị kéo về phía Oxy, làm cho H₂O có tính phân cực mạnh.
- CH₄: Độ âm điện của Carbon là 2,55 và của Hydro là 2,20. Sự chênh lệch này khá nhỏ, do đó các liên kết trong CH₄ hầu như không phân cực, và phân tử tổng thể là không phân cực.
3. Ảnh hưởng của phân cực đến tính chất vật lý:
- H₂O: Do tính phân cực cao, các phân tử nước có thể hình thành liên kết hydro mạnh mẽ giữa các phân tử, điều này giải thích tại sao nước có nhiệt độ sôi cao hơn nhiều so với các hợp chất có khối lượng phân tử tương tự, như H₂S hay CH₄.
- CH₄: Vì là phân tử không phân cực, CH₄ chỉ có tương tác Van der Waals yếu, dẫn đến nhiệt độ sôi và nhiệt độ nóng chảy rất thấp so với H₂O.
Như vậy, H₂O là một phân tử phân cực mạnh với khả năng hình thành liên kết hydro, trong khi CH₄ là một phân tử không phân cực. Sự khác biệt này không chỉ ảnh hưởng đến các tính chất vật lý của hai phân tử mà còn quyết định cách chúng tương tác với các chất khác trong môi trường.

Bài Tập 8: So Sánh Độ Phân Cực Của CsCl và BaF₂
Trong bài tập này, chúng ta sẽ so sánh độ phân cực của hai hợp chất ion là CsCl và BaF₂. Độ phân cực của một liên kết phụ thuộc vào sự chênh lệch độ âm điện giữa các nguyên tố tham gia liên kết. Càng chênh lệch lớn, độ phân cực càng cao.
Đầu tiên, hãy xác định độ âm điện của các nguyên tố:
- Cs: \( \chi_{Cs} = 0.79 \)
- Cl: \( \chi_{Cl} = 3.16 \)
- Ba: \( \chi_{Ba} = 0.89 \)
- F: \( \chi_{F} = 3.98 \)
Dựa vào các giá trị trên, chúng ta tính hiệu độ âm điện của từng hợp chất:
- Hiệu độ âm điện của CsCl: \(\Delta \chi_{CsCl} = |3.16 - 0.79| = 2.37\)
- Hiệu độ âm điện của BaF₂: \(\Delta \chi_{BaF₂} = |3.98 - 0.89| = 3.09\)
Từ kết quả trên, chúng ta có thể thấy rằng:
- CsCl có hiệu độ âm điện là 2.37, cho thấy liên kết giữa Cs và Cl có độ phân cực cao.
- BaF₂ có hiệu độ âm điện là 3.09, cho thấy liên kết giữa Ba và F có độ phân cực còn cao hơn.
Kết luận:
Dựa trên so sánh hiệu độ âm điện, BaF₂ có độ phân cực lớn hơn so với CsCl. Điều này có nghĩa là liên kết ion trong BaF₂ mạnh hơn và có xu hướng tạo ra một hợp chất với tính chất ion rõ rệt hơn so với CsCl.
Bài Tập 9: Xác Định Độ Phân Cực Trong Phân Tử CO₂
Để xác định độ phân cực của phân tử CO₂, chúng ta cần xem xét cấu trúc phân tử và sự phân bố điện tích trong các liên kết hóa học.
1. Cấu trúc hình học của phân tử CO₂
Phân tử CO₂ có cấu trúc tuyến tính, trong đó nguyên tử Cacbon (C) nằm ở giữa, liên kết với hai nguyên tử Oxi (O) ở hai bên bằng các liên kết cộng hóa trị đôi. Góc liên kết giữa các nguyên tử trong phân tử CO₂ là 180 độ.
Sơ đồ cấu trúc:
2. Độ âm điện và sự phân cực của liên kết
Độ âm điện của Oxi (O) lớn hơn của Cacbon (C), dẫn đến liên kết C=O có sự phân cực, với Oxi mang một phần điện tích âm và Cacbon mang một phần điện tích dương.
Công thức liên kết phân cực:
Tuy nhiên, do CO₂ có cấu trúc tuyến tính, hai liên kết C=O có sự phân cực bằng nhau nhưng ngược chiều, do đó chúng triệt tiêu lẫn nhau.
3. Kết luận về phân cực của CO₂
Mặc dù các liên kết C=O trong CO₂ là các liên kết phân cực, nhưng do cấu trúc đối xứng của phân tử, tổng thể phân tử CO₂ không có mômen lưỡng cực và là một phân tử không phân cực.
Tóm lại, phân tử CO₂ là một ví dụ về một phân tử có các liên kết phân cực nhưng không có sự phân cực tổng thể.
Bài Tập 10: Ứng Dụng Độ Phân Cực Trong Thiết Kế Thuốc
Độ phân cực của các phân tử là một yếu tố quan trọng trong thiết kế thuốc, ảnh hưởng trực tiếp đến khả năng tương tác của thuốc với các mục tiêu sinh học. Trong quá trình phát triển thuốc, việc xác định và điều chỉnh độ phân cực của các hợp chất có thể cải thiện đáng kể hiệu quả điều trị và giảm thiểu tác dụng phụ.
1. Tầm Quan Trọng Của Độ Phân Cực Trong Dược Động Học và Dược Lực Học
Độ phân cực của thuốc ảnh hưởng đến dược động học (phân phối, hấp thu, chuyển hóa, và thải trừ) và dược lực học (tác động của thuốc lên cơ thể). Một hợp chất với độ phân cực phù hợp có thể dễ dàng đi qua màng tế bào, đạt được nồng độ cần thiết tại vị trí đích mà không bị phân hủy hay bài tiết quá nhanh.
- Độ phân cực cao thường giúp thuốc tương tác mạnh với các mục tiêu sinh học, nhưng cũng có thể khiến chúng khó đi qua màng tế bào.
- Độ phân cực thấp có thể giúp thuốc dễ dàng xâm nhập vào tế bào nhưng lại giảm khả năng tương tác với mục tiêu đích.
2. Ứng Dụng Độ Phân Cực Trong Thiết Kế Thuốc
Trong thực tế, thiết kế thuốc cần phải cân bằng giữa độ phân cực và các đặc tính khác của hợp chất. Phương pháp CADD (Computer-Aided Drug Design) giúp tối ưu hóa quá trình này bằng cách mô phỏng các tương tác giữa thuốc và protein mục tiêu.
- Mô phỏng độ phân cực: Các nhà nghiên cứu sử dụng phần mềm để dự đoán và điều chỉnh độ phân cực của các phân tử thuốc nhằm tối ưu hóa tương tác với mục tiêu sinh học.
- Độ phân cực và khả năng kháng thuốc: Điều chỉnh độ phân cực của thuốc cũng giúp giảm nguy cơ phát triển các chủng vi khuẩn kháng thuốc bằng cách duy trì nồng độ hiệu quả của thuốc trong cơ thể.
3. Ví Dụ Thực Tế Trong Thiết Kế Thuốc
Một ví dụ cụ thể là việc sử dụng cây Hương thảo (Rosmarinus officinalis) để phát triển thuốc chống ung thư đại trực tràng. Nhóm nghiên cứu đã sử dụng phương pháp CADD để xác định và tối ưu hóa các hợp chất có độ phân cực phù hợp, giúp tăng cường khả năng tương tác với protein đích và ức chế sự phát triển của tế bào ung thư.
Kết Luận
Độ phân cực là một trong những yếu tố quan trọng quyết định thành công của quá trình thiết kế thuốc. Bằng cách hiểu và kiểm soát độ phân cực, các nhà khoa học có thể phát triển các loại thuốc hiệu quả hơn, ít tác dụng phụ và giảm thiểu nguy cơ kháng thuốc.