Chủ đề không phân cực: "Không phân cực" là thuật ngữ thường được sử dụng trong hóa học để mô tả các liên kết cộng hóa trị mà cặp electron được chia sẻ đều giữa hai nguyên tử. Trong bài viết này, chúng ta sẽ tìm hiểu chi tiết về các đặc điểm, ứng dụng của liên kết không phân cực, và cách nó ảnh hưởng đến tính chất của các chất hóa học.
Mục lục
Khái Niệm và Ứng Dụng Của Chất Không Phân Cực
Chất không phân cực là những chất mà trong phân tử không có sự phân chia rõ rệt giữa các điện tích dương và điện tích âm. Các chất này có cấu trúc phân tử đồng đều và không có moment lưỡng cực, do đó chúng không hòa tan trong nước hoặc các dung môi phân cực. Một số ví dụ điển hình của chất không phân cực bao gồm hexan, benzen, và toluen.
1. Đặc Điểm Của Chất Không Phân Cực
- Không có moment lưỡng cực.
- Cấu trúc phân tử đối xứng và đồng đều.
- Không hòa tan trong nước nhưng hòa tan tốt trong các dung môi không phân cực khác.
- Có thể dễ dàng bay hơi, đặc biệt là trong trường hợp của các chất không phân cực có khối lượng phân tử thấp.
2. Ứng Dụng Của Chất Không Phân Cực
Các chất không phân cực có nhiều ứng dụng trong đời sống và công nghiệp:
- Trong công nghiệp hóa chất: Chúng được sử dụng làm dung môi cho các phản ứng hóa học không yêu cầu sự tham gia của nước. Ví dụ, toluen và benzen được sử dụng rộng rãi trong công nghiệp sơn và sản xuất nhựa.
- Trong ngành thực phẩm: Các chất không phân cực như dầu mỡ được sử dụng để chế biến và bảo quản thực phẩm vì khả năng không hòa tan trong nước của chúng.
- Trong lĩnh vực y tế: Một số chất không phân cực được sử dụng trong các phương pháp giặt khô và khử trùng.
- Trong nghiên cứu khoa học: Các dung môi không phân cực được sử dụng trong các phòng thí nghiệm để tách chiết và phân tích các hợp chất không phân cực.
3. Tính Chất Hóa Lý của Chất Không Phân Cực
| Chất Không Phân Cực | Công Thức Hóa Học | Ứng Dụng |
|---|---|---|
| Hexan | \(\text{C}_6\text{H}_{14}\) | Dùng làm dung môi trong công nghiệp dầu khí. |
| Benzen | \(\text{C}_6\text{H}_6\) | Sử dụng trong sản xuất nhựa, chất dẻo và các loại sơn. |
| Toluen | \(\text{C}_7\text{H}_8\) | Dùng trong sản xuất mực in và cao su. |
4. Cách Chọn Lựa Dung Môi Không Phân Cực
Khi chọn dung môi không phân cực, cần xem xét đến tính chất của chất cần hòa tan và mục đích sử dụng. Một số yếu tố cần lưu ý bao gồm:
- Độ tan của dung môi không phân cực với chất cần hòa tan.
- Tính bay hơi của dung môi để đảm bảo an toàn và hiệu quả trong quá trình sử dụng.
- Khả năng tái sử dụng và xử lý an toàn của dung môi sau khi sử dụng.
Nhìn chung, các chất không phân cực đóng vai trò quan trọng trong nhiều lĩnh vực từ công nghiệp đến nghiên cứu khoa học, nhờ vào tính chất đặc biệt của chúng.

.png)
1. Khái niệm về Liên Kết Không Phân Cực
Liên kết không phân cực là loại liên kết hóa học trong đó các electron được chia sẻ đồng đều giữa hai nguyên tử. Điều này xảy ra khi hai nguyên tử có độ âm điện tương đương, làm cho cặp electron liên kết không bị hút về phía nguyên tử nào một cách rõ rệt.
Một số đặc điểm quan trọng của liên kết không phân cực bao gồm:
- Độ âm điện tương đương: Các nguyên tử tham gia vào liên kết không phân cực có độ âm điện gần như bằng nhau, ví dụ như cặp H2 và Cl2. Do đó, không có sự chênh lệch về lực hút electron, khiến cho cặp electron liên kết được chia sẻ đồng đều.
- Không có moment lưỡng cực: Liên kết không phân cực không tạo ra moment lưỡng cực, do các điện tích trong phân tử phân bố đều đặn, dẫn đến không có cực dương hay cực âm rõ rệt trong phân tử.
- Tính chất vật lý: Các phân tử không phân cực thường có nhiệt độ sôi và nhiệt độ nóng chảy thấp hơn so với các phân tử phân cực vì lực tương tác giữa các phân tử không phân cực là lực van der Waals, yếu hơn so với lực hút tĩnh điện trong các phân tử phân cực.
Liên kết không phân cực đóng vai trò quan trọng trong nhiều quá trình hóa học và sinh học, từ việc cấu thành các chất khí đơn nguyên tử đến việc tạo ra các màng tế bào trong sinh vật sống. Ví dụ:
| Liên kết | Độ âm điện của nguyên tử | Loại liên kết |
|---|---|---|
| H2 | H (2.1) | Không phân cực |
| Cl2 | Cl (3.0) | Không phân cực |
| O2 | O (3.5) | Không phân cực |
Như vậy, liên kết không phân cực là một khái niệm cơ bản trong hóa học, giúp giải thích tính chất và hành vi của nhiều loại phân tử. Hiểu rõ về loại liên kết này giúp chúng ta áp dụng kiến thức vào thực tế, từ việc nghiên cứu các phản ứng hóa học đến việc thiết kế các chất liệu mới với các đặc tính cụ thể.
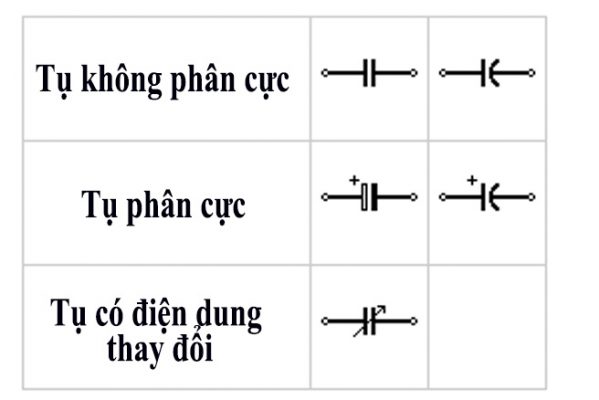
2. Tụ Điện Không Phân Cực và Tụ Điện Phân Cực
Tụ điện không phân cực và tụ điện phân cực là hai loại tụ điện phổ biến, có cấu tạo và ứng dụng khác nhau. Dưới đây là những điểm khác biệt chính giữa hai loại tụ điện này:
- Tụ Điện Phân Cực:
- Có hai cực âm (-) và dương (+) rõ ràng, cần chú ý khi lắp đặt để tránh mắc ngược, nếu không sẽ gây hỏng tụ.
- Thường sử dụng trong mạch điện một chiều (DC) và có hiệu quả cao ở tần số thấp, thường dùng làm mạch lọc nguồn và mạch âm thanh.
- Ví dụ: Tụ hóa học và tụ tantalum là những loại tụ điện phân cực phổ biến.
- Tụ Điện Không Phân Cực:
- Không có sự phân biệt giữa cực âm và cực dương, có thể lắp đặt một cách linh hoạt mà không lo ngại về chiều của điện áp.
- Thường sử dụng trong cả mạch điện xoay chiều (AC) và mạch điện một chiều (DC), đặc biệt hữu ích trong các mạch có tần số cao, như mạch lọc nhiễu hoặc mạch bù pha cho lưới điện.
- Ví dụ: Tụ gốm, tụ mica, và tụ giấy là các loại tụ điện không phân cực phổ biến.
Với sự khác biệt này, việc lựa chọn sử dụng loại tụ điện nào phụ thuộc vào yêu cầu cụ thể của mạch điện và mục đích sử dụng, đảm bảo hiệu suất và độ bền của thiết bị điện tử.

3. Ảnh Hưởng của Liên Kết Không Phân Cực trong Vật Lý
Trong vật lý, liên kết không phân cực đóng vai trò quan trọng trong việc xác định tính chất của các phân tử và chất liệu. Một liên kết không phân cực xảy ra khi hai nguyên tử có độ âm điện tương đương liên kết với nhau, làm cho sự phân bố mật độ electron giữa chúng đồng đều. Điều này dẫn đến sự ổn định về mặt điện học và không có momen lưỡng cực.
Liên kết không phân cực ảnh hưởng đến vật lý theo nhiều cách khác nhau, bao gồm:
- Tính chất cách điện: Các hợp chất có liên kết không phân cực thường không dẫn điện, vì chúng không có các hạt mang điện tự do như electron hoặc ion. Điều này làm cho chúng trở thành chất cách điện tốt, được sử dụng trong các ứng dụng cách điện khác nhau.
- Tính chất hòa tan: Các chất không phân cực hòa tan tốt trong các dung môi không phân cực. Đây là nguyên tắc "like dissolves like" trong hóa học, nghĩa là các chất với tính chất tương tự sẽ hòa tan vào nhau. Ví dụ, dầu (một chất không phân cực) sẽ hòa tan trong dầu, nhưng không trong nước (một chất phân cực).
- Điểm nóng chảy và điểm sôi: Các hợp chất không phân cực thường có điểm nóng chảy và sôi thấp hơn so với các hợp chất phân cực. Điều này là do lực tương tác giữa các phân tử không phân cực (chủ yếu là lực Van der Waals) yếu hơn so với lực giữa các phân tử phân cực.
Hơn nữa, các phân tử không phân cực thường có dạng hình học đối xứng, làm giảm hoặc loại bỏ momen lưỡng cực tổng thể. Ví dụ, khí methane (CH\(_4\)) là một phân tử không phân cực với cấu trúc tứ diện đều, nơi tất cả các liên kết C-H đều có độ dài và góc liên kết tương đương. Điều này làm cho methane ổn định và không bị ảnh hưởng bởi các trường điện từ ngoại lai.
Kết quả là, liên kết không phân cực không chỉ ảnh hưởng đến tính chất hóa học mà còn có những tác động sâu sắc trong vật lý, đặc biệt là trong các lĩnh vực liên quan đến điện và từ tính. Hiểu rõ các ảnh hưởng này giúp các nhà khoa học và kỹ sư thiết kế các vật liệu và thiết bị phù hợp với yêu cầu ứng dụng cụ thể.
| Tính chất | Liên kết Không Phân Cực | Liên kết Phân Cực |
|---|---|---|
| Cách điện | Cao | Thấp hơn |
| Điểm nóng chảy | Thấp | Cao hơn |
| Hòa tan trong dung môi không phân cực | Tốt | Kém |
4. Bài Tập về Liên Kết Không Phân Cực trong Hóa Học
Dưới đây là một số bài tập về liên kết không phân cực giúp bạn nắm vững hơn về khái niệm này và ứng dụng trong hóa học. Mỗi bài tập đều có lời giải chi tiết để giúp bạn hiểu rõ hơn về cách xác định và so sánh liên kết không phân cực.
-
Bài tập 1: Xác định loại liên kết (phân cực hay không phân cực) trong các phân tử sau: \( \text{CH}_4 \), \( \text{O}_2 \), \( \text{HCl} \).
- Lời giải:
- Phân tử \( \text{CH}_4 \) có liên kết không phân cực do các liên kết C-H có độ âm điện tương tự.
- Phân tử \( \text{O}_2 \) có liên kết không phân cực vì hai nguyên tử O giống nhau.
- Phân tử \( \text{HCl} \) có liên kết phân cực do sự khác biệt lớn về độ âm điện giữa H và Cl.
-
Bài tập 2: Giải thích tại sao các phân tử \( \text{N}_2 \) và \( \text{CO}_2 \) đều là không phân cực, mặc dù \( \text{CO}_2 \) có hai liên kết phân cực C=O.
- Lời giải:
- Phân tử \( \text{N}_2 \) là không phân cực vì nó có cấu trúc đối xứng và liên kết giữa hai nguyên tử nitrogen giống nhau.
- Phân tử \( \text{CO}_2 \) là không phân cực do cấu trúc tuyến tính và sự triệt tiêu của hai momen lưỡng cực C=O ngược chiều.
-
Bài tập 3: Xác định dạng hình học và tính phân cực của phân tử \( \text{BF}_3 \).
- Lời giải:
- Phân tử \( \text{BF}_3 \) có dạng hình học tam giác phẳng và là không phân cực do ba liên kết B-F triệt tiêu lẫn nhau.
-
Bài tập 4: Giải thích vì sao \( \text{H}_2\text{O} \) có momen lưỡng cực nhưng \( \text{CO}_2 \) thì không.
- Lời giải:
- \( \text{H}_2\text{O} \) có momen lưỡng cực do cấu trúc hình gấp khúc với hai liên kết O-H không đối xứng nhau.
- \( \text{CO}_2 \) có cấu trúc tuyến tính và hai momen lưỡng cực triệt tiêu nhau.
-
Bài tập 5: So sánh liên kết không phân cực và phân cực và đưa ra ví dụ cụ thể.
- Lời giải:
- Liên kết không phân cực: hai nguyên tử có độ âm điện tương tự, ví dụ: \( \text{N}_2 \), \( \text{O}_2 \).
- Liên kết phân cực: sự chênh lệch độ âm điện giữa hai nguyên tử lớn, ví dụ: \( \text{H}_2\text{O} \), \( \text{HCl} \).