Chủ đề nước phân cực: Nước phân cực là một chủ đề hấp dẫn trong hóa học, mở ra nhiều ứng dụng thực tiễn trong cuộc sống và công nghệ. Bài viết này sẽ khám phá sâu về tính chất phân cực của nước, những ứng dụng quan trọng trong công nghiệp và đời sống, giúp bạn hiểu rõ hơn về vai trò thiết yếu của nước trong thế giới xung quanh chúng ta.
Mục lục
- Nước Phân Cực: Tính Chất và Ứng Dụng
- Tính Chất Của Nước Phân Cực
- Ứng Dụng Của Nước Phân Cực
- 10 Dạng Bài Tập Toán/Lý/Anh Liên Quan Đến Nước Phân Cực
- Bài Tập 1: Tính Toán Độ Phân Cực
- Bài Tập 2: Phân Tích Liên Kết Hydro
- Bài Tập 3: Tính Toán Nhiệt Độ Sôi của Nước
- Bài Tập 4: Tính Chất Hòa Tan của Nước với Các Chất Khác
- Bài Tập 5: Ứng Dụng của Tính Phân Cực trong Phản Ứng Hóa Học
- Bài Tập 6: Nước và Tính Căng Bề Mặt trong Thực Tiễn
- Bài Tập 7: Nước và Các Ứng Dụng Công Nghiệp
- Bài Tập 8: Tính Toán Liên Kết Hydro trong Các Phân Tử Sinh Học
- Bài Tập 9: Phân Tích Vai Trò của Nước trong Cơ Thể Người
- Bài Tập 10: Tính Toán Liên Kết Hydro trong Mô Hình 3D
Nước Phân Cực: Tính Chất và Ứng Dụng
Nước là một hợp chất hóa học vô cùng quan trọng và phổ biến trong cuộc sống hàng ngày. Một trong những tính chất quan trọng của nước là tính phân cực. Hiểu rõ về tính chất này giúp chúng ta có thể ứng dụng nước trong nhiều lĩnh vực khác nhau như công nghệ, hóa học và y học.
Tính Phân Cực của Nước
Nước là một phân tử phân cực, có nghĩa là nó có một đầu tích điện dương và một đầu tích điện âm. Điều này xảy ra do sự chênh lệch về độ âm điện giữa nguyên tử oxy và nguyên tử hydro trong phân tử nước. Cụ thể, oxy có độ âm điện cao hơn, kéo các electron về phía mình, làm cho đầu của phân tử nước gần oxy mang điện tích âm (\( \delta^- \)), trong khi đầu gần hydro mang điện tích dương (\( \delta^+ \)).
Công thức cấu tạo của nước có thể được biểu diễn như sau:
Sự phân bố điện tích không đồng đều này tạo nên các đặc tính đặc biệt của nước, chẳng hạn như khả năng hòa tan nhiều chất khác nhau, đặc biệt là các hợp chất ion và các phân tử phân cực khác.
Ứng Dụng của Tính Phân Cực
- Dung môi tuyệt vời: Nước được coi là "dung môi chung" vì khả năng hòa tan nhiều loại chất khác nhau, từ muối, đường đến nhiều loại khí và hợp chất hữu cơ. Điều này làm cho nước trở thành môi trường lý tưởng cho các phản ứng hóa học trong cơ thể sống cũng như trong các quy trình công nghiệp.
- Điều hòa nhiệt độ: Tính phân cực và liên kết hydro của nước cho phép nó có nhiệt dung riêng cao, giúp điều hòa nhiệt độ môi trường và cơ thể sống một cách hiệu quả.
- Vai trò trong sinh học: Nước là thành phần chính trong các tế bào và là môi trường cho các quá trình sinh học. Khả năng hòa tan và vận chuyển chất dinh dưỡng, chất thải của nước đóng vai trò quan trọng trong sự sống.
Liên Kết Hydro trong Nước
Liên kết hydro là một dạng tương tác yếu nhưng quan trọng giữa các phân tử nước. Do phân tử nước là phân cực, các phân tử nước có xu hướng hình thành liên kết hydro với nhau, trong đó đầu dương (\( \delta^+ \)) của một phân tử sẽ hút đầu âm (\( \delta^- \)) của phân tử khác. Điều này giải thích tại sao nước có nhiệt độ sôi cao và đặc tính dính, kết dính đặc biệt.
Các liên kết hydro này cũng tạo ra hiện tượng bề mặt căng của nước, giúp nước có khả năng thấm và lan truyền qua các mao quản, cũng như duy trì cấu trúc của các đại phân tử sinh học như protein và DNA.
Kết Luận
Tính phân cực của nước là một trong những yếu tố quan trọng giúp nước đóng vai trò không thể thay thế trong cuộc sống. Từ việc làm dung môi cho các phản ứng hóa học đến việc điều hòa nhiệt độ và hỗ trợ các quá trình sinh học, nước là nền tảng cho sự sống trên Trái Đất. Hiểu biết về tính chất phân cực của nước không chỉ có ý nghĩa trong khoa học mà còn trong nhiều ứng dụng thực tiễn khác.

.png)
Tính Chất Của Nước Phân Cực
Nước là một phân tử phân cực với nhiều tính chất độc đáo, đóng vai trò quan trọng trong nhiều lĩnh vực khoa học và đời sống.
- Tính phân cực: Nước có cấu trúc phân tử dạng bent, với góc liên kết giữa hai nguyên tử hydro và oxy là 104,5 độ. Điều này làm cho nước trở thành một phân tử phân cực mạnh, với đầu oxy mang điện tích âm và đầu hydro mang điện tích dương.
- Liên kết hydro: Do tính phân cực của nước, các phân tử nước có khả năng hình thành liên kết hydro. Liên kết này tạo ra tính chất đặc biệt như nhiệt độ sôi cao, độ nhớt lớn, và sức căng bề mặt cao.
- Tính hòa tan: Nước được gọi là "dung môi vạn năng" do khả năng hòa tan nhiều chất khác nhau. Nhờ tính phân cực, nước có thể tương tác và hòa tan các chất phân cực khác, cũng như một số chất ion hóa.
- Sự giãn nở khi đông đặc: Khác với hầu hết các chất, nước giãn nở khi chuyển từ thể lỏng sang thể rắn, làm cho đá nước nhẹ hơn nước lỏng. Điều này giải thích tại sao băng nổi trên mặt nước.
- Nhiệt dung riêng cao: Nước có nhiệt dung riêng cao, có nghĩa là cần một lượng lớn năng lượng để làm tăng nhiệt độ của nó. Điều này giúp nước điều hòa nhiệt độ môi trường xung quanh.
Ứng Dụng Của Nước Phân Cực
Nước phân cực có rất nhiều ứng dụng trong đời sống và các ngành công nghiệp, nhờ vào tính chất độc đáo của nó.
- Dung môi trong hóa học và công nghiệp: Với khả năng hòa tan nhiều loại hợp chất, nước phân cực được sử dụng làm dung môi trong các phản ứng hóa học, quá trình sản xuất dược phẩm, và chế tạo các sản phẩm công nghiệp khác.
- Sinh học và y học: Trong cơ thể con người, nước là dung môi cho nhiều quá trình sinh hóa, giúp vận chuyển các chất dinh dưỡng, loại bỏ chất thải, và duy trì sự cân bằng nội môi. Nước phân cực cũng được ứng dụng trong việc pha chế thuốc và các dung dịch y tế.
- Điện giải: Nước phân cực đóng vai trò quan trọng trong các quá trình điện phân, đặc biệt trong việc tách các nguyên tố như hydrogen và oxygen. Quá trình này có ứng dụng rộng rãi trong sản xuất nhiên liệu hydrogen và các ngành công nghiệp khác.
- Làm sạch và tẩy rửa: Nhờ vào khả năng hòa tan các chất bẩn và dầu mỡ, nước phân cực được sử dụng rộng rãi trong các sản phẩm tẩy rửa và làm sạch hàng ngày.
- Điều hòa nhiệt độ: Nước có nhiệt dung riêng cao, giúp nó giữ nhiệt độ ổn định trong các hệ thống làm mát, chẳng hạn như trong tủ lạnh, hệ thống làm mát của ô tô, và trong các nhà máy điện.

10 Dạng Bài Tập Toán/Lý/Anh Liên Quan Đến Nước Phân Cực
Dưới đây là 10 dạng bài tập thuộc các lĩnh vực Toán, Vật lý và Tiếng Anh, liên quan đến khái niệm "nước phân cực". Các bài tập này được thiết kế để giúp học sinh nắm vững các kiến thức cơ bản và ứng dụng của nước phân cực trong các lĩnh vực khác nhau.
1. Bài Tập Toán: Tính Toán Lượng Nước Cần Thiết
Tính toán lượng nước cần thiết để hòa tan một lượng chất nhất định với tính chất phân cực. Áp dụng công thức \[ C = \frac{m}{V} \] để giải bài toán.
2. Bài Tập Toán: Tính Toán Nồng Độ Dung Dịch
Xác định nồng độ dung dịch sau khi hòa tan một hợp chất phân cực trong nước. Sử dụng phương trình \[ C_1V_1 = C_2V_2 \] để giải.
3. Bài Tập Lý: Tính Năng Lượng Cần Thiết Để Phân Tách Nước
Sử dụng định luật bảo toàn năng lượng để tính toán năng lượng cần thiết để phân tách nước thành hydro và oxy qua quá trình điện phân.
4. Bài Tập Lý: Tính Toán Sức Căng Bề Mặt Của Nước
Áp dụng công thức \[ F = \sigma \cdot L \] để tính sức căng bề mặt của nước khi chịu tác động của các lực bên ngoài.
5. Bài Tập Lý: Tính Toán Áp Suất Bề Mặt
Xác định áp suất bề mặt khi một vật nhỏ tiếp xúc với nước phân cực. Sử dụng các phương trình liên quan đến áp suất và sức căng bề mặt.
6. Bài Tập Lý: Xác Định Góc Liên Kết Trong Phân Tử Nước
Dùng các định luật của hóa học và vật lý để xác định góc liên kết giữa các nguyên tử trong phân tử nước.
7. Bài Tập Lý: Xác Định Nhiệt Độ Sôi Của Nước Phân Cực
Tính toán nhiệt độ sôi của nước phân cực dựa trên các thông số như áp suất và độ cao so với mực nước biển.
8. Bài Tập Tiếng Anh: Viết Đoạn Văn Mô Tả Tính Chất Của Nước Phân Cực
Viết một đoạn văn ngắn bằng tiếng Anh mô tả các tính chất của nước phân cực và tầm quan trọng của nó trong tự nhiên.
9. Bài Tập Tiếng Anh: Dịch Tài Liệu Khoa Học Về Nước Phân Cực
Dịch một đoạn văn bản khoa học từ tiếng Việt sang tiếng Anh, liên quan đến ứng dụng của nước phân cực trong đời sống.
10. Bài Tập Tiếng Anh: Hoàn Thành Câu Với Các Tính Từ Liên Quan Đến Nước
Hoàn thành các câu tiếng Anh bằng cách thêm các tính từ mô tả tính chất của nước phân cực như "polar", "solvent", "hydrogen bonding".

Bài Tập 1: Tính Toán Độ Phân Cực
Trong bài tập này, chúng ta sẽ tính toán độ phân cực của một phân tử nước dựa trên giá trị mômen lưỡng cực và khoảng cách giữa các hạt điện tích trong phân tử. Để tính toán độ phân cực, bạn cần làm theo các bước sau:
-
Bước 1: Xác định mômen lưỡng cực \(\mu\) của phân tử nước. Mômen lưỡng cực được xác định bằng công thức:
\[
\mu = q \times d
\]
Trong đó:
- \(q\) là điện tích của các hạt (đơn vị Coulomb).
- \(d\) là khoảng cách giữa các điện tích (đơn vị mét).
Bước 2: Sử dụng giá trị \(\mu\) để tính độ phân cực \(\Delta\) của phân tử nước. Độ phân cực có thể được tính dựa trên mối quan hệ giữa mômen lưỡng cực và cường độ điện trường trong phân tử:
\[
\Delta = \frac{\mu}{E}
\]
Trong đó:
- \(\mu\) là mômen lưỡng cực đã tính ở bước 1.
- \(E\) là cường độ điện trường trong phân tử (đơn vị V/m).
Bước 3: Sau khi tính toán xong độ phân cực \(\Delta\), bạn có thể xác định tính chất phân cực của phân tử nước và cách nó ảnh hưởng đến các tính chất hóa học và vật lý của nước như điểm sôi, độ tan, và sức căng bề mặt.
Hãy thử áp dụng các bước trên để tính toán độ phân cực của phân tử nước trong các điều kiện khác nhau và quan sát sự thay đổi của các tính chất liên quan.

Bài Tập 2: Phân Tích Liên Kết Hydro
Bài tập này sẽ giúp bạn hiểu rõ hơn về cách liên kết hydro hoạt động trong phân tử nước và vai trò của nó trong các tính chất hóa học và vật lý của nước. Để thực hiện bài tập này, bạn cần thực hiện các bước sau:
-
Bước 1: Xác định cấu trúc phân tử nước. Hình dạng phân tử nước là một góc hình chữ V với góc liên kết khoảng \(104.5^\circ\). Mỗi nguyên tử hydro được liên kết với nguyên tử oxy bằng một liên kết cộng hóa trị.
-
Bước 2: Hiểu về liên kết hydro. Liên kết hydro là một loại liên kết yếu giữa nguyên tử hydro trong một phân tử nước và nguyên tử oxy trong một phân tử nước khác. Điều này xảy ra do sự phân cực của phân tử nước, trong đó oxy mang một phần điện tích âm và hydro mang một phần điện tích dương.
\[
H_2O \cdots H_2O
\] -
Bước 3: Phân tích tính chất của liên kết hydro. Liên kết hydro làm cho nước có nhiệt độ sôi và nhiệt độ nóng chảy cao hơn so với các hợp chất khác có khối lượng phân tử tương đương. Liên kết này cũng góp phần tạo nên sức căng bề mặt cao và khả năng hòa tan nhiều chất khác của nước.
-
Bước 4: Áp dụng kiến thức về liên kết hydro để giải thích các hiện tượng tự nhiên như hiện tượng nước đóng băng từ trên xuống dưới, hoặc vì sao băng lại nổi trên mặt nước.
Bằng cách thực hiện bài tập này, bạn sẽ có cái nhìn sâu sắc hơn về liên kết hydro và vai trò quan trọng của nó trong hóa học nước.
XEM THÊM:
Bài Tập 3: Tính Toán Nhiệt Độ Sôi của Nước
Trong bài tập này, bạn sẽ học cách tính toán nhiệt độ sôi của nước dựa trên các yếu tố như áp suất và liên kết hydro. Hãy làm theo các bước sau để hoàn thành bài tập:
-
Bước 1: Hiểu về mối quan hệ giữa áp suất và nhiệt độ sôi. Nhiệt độ sôi của nước thay đổi khi áp suất thay đổi, được mô tả bằng công thức Clausius-Clapeyron:
\[
\ln \left( \frac{P_2}{P_1} \right) = -\frac{\Delta H_v}{R} \left( \frac{1}{T_2} - \frac{1}{T_1} \right)
\]Trong đó, \(P_1\) và \(P_2\) là áp suất, \(T_1\) và \(T_2\) là nhiệt độ, \(\Delta H_v\) là enthalpy bay hơi, và \(R\) là hằng số khí.
-
Bước 2: Áp dụng công thức trên để tính nhiệt độ sôi ở áp suất khác nhau. Ví dụ, tính toán nhiệt độ sôi của nước ở đỉnh núi Everest, nơi áp suất thấp hơn so với mực nước biển.
-
Bước 3: Xem xét tác động của liên kết hydro. Liên kết hydro mạnh làm tăng nhiệt độ sôi của nước so với các hợp chất khác có khối lượng phân tử tương tự.
-
Bước 4: Sử dụng dữ liệu thực nghiệm để so sánh kết quả tính toán với nhiệt độ sôi thực tế. Điều này giúp bạn kiểm tra độ chính xác của các giả định và phương pháp sử dụng trong tính toán.
Hoàn thành bài tập này sẽ giúp bạn hiểu rõ hơn về mối quan hệ giữa nhiệt độ sôi của nước và các yếu tố vật lý ảnh hưởng đến nó.

Bài Tập 4: Tính Chất Hòa Tan của Nước với Các Chất Khác
Trong bài tập này, chúng ta sẽ tìm hiểu về tính chất hòa tan của nước khi kết hợp với các chất khác nhau. Nước là một dung môi phân cực mạnh, có khả năng hòa tan nhiều loại chất khác nhau, đặc biệt là các chất ion và các chất phân cực khác. Điều này được giải thích bởi sự tương tác giữa các phân tử nước thông qua liên kết hydro và các lực hút tĩnh điện với các ion hoặc phân tử khác.
Phương pháp giải quyết bài tập:
- Xác định tính chất phân cực của chất hòa tan:
- Nếu chất là phân tử phân cực (như muối NaCl), nó có khả năng hòa tan tốt trong nước.
- Nếu chất là phân tử không phân cực (như dầu), nó sẽ không hòa tan trong nước.
- Tính toán độ hòa tan của chất dựa trên hằng số điện môi của nước và chất hòa tan.
- Xác định mức độ tương tác giữa phân tử nước và phân tử chất hòa tan bằng cách sử dụng liên kết hydro và lực hút tĩnh điện.
Ví dụ: Tính độ hòa tan của muối ăn (NaCl) trong nước ở nhiệt độ phòng.
Bước 1: Xác định tính phân cực của NaCl. Muối ăn là một hợp chất ion nên có tính phân cực.
Bước 2: Khi NaCl tan trong nước, nó phân ly thành ion Na+ và Cl-. Các ion này sẽ tương tác mạnh với các phân tử nước phân cực thông qua lực hút tĩnh điện.
Bước 3: Tính toán nồng độ dung dịch: Giả sử bạn có 58.5 gam NaCl (tương đương 1 mol) và hòa tan vào 1 lít nước.
\[
\text{Nồng độ dung dịch} = \frac{{\text{Số mol của NaCl}}}{{\text{Thể tích dung môi (lít)}}} = \frac{1}{1} = 1 \, \text{mol/L}
\]
Bước 4: Kiểm tra kết quả: Nước là dung môi phân cực mạnh, nên NaCl dễ dàng hòa tan hoàn toàn trong nước, tạo thành dung dịch NaCl.
Bài tập thực hành: Tính độ hòa tan của một chất ion khác trong nước và so sánh với NaCl. Đưa ra các kết luận về tính chất hòa tan của chất đó.

Bài Tập 5: Ứng Dụng của Tính Phân Cực trong Phản Ứng Hóa Học
Trong các phản ứng hóa học, tính phân cực của phân tử đóng một vai trò quan trọng, đặc biệt là trong việc xác định cách các chất phản ứng với nhau. Dưới đây là một số bài tập giúp bạn hiểu rõ hơn về ứng dụng của tính phân cực trong các phản ứng hóa học.
- Bài tập 1: Phân tích ảnh hưởng của tính phân cực trong phản ứng giữa nước và các chất khác
- Bài tập 2: Ứng dụng của tính phân cực trong xử lý nước
- Bài tập 3: Vai trò của tính phân cực trong phản ứng giữa axit và bazơ
- Bài tập 4: Ứng dụng của tính phân cực trong y học và công nghiệp
Trong phản ứng thủy phân, nước là một phân tử phân cực mạnh, điều này giúp nó phá vỡ các liên kết trong các hợp chất hữu cơ. Hãy xem xét phản ứng thủy phân của este:
\[
\text{R-COOR'} + H_2O \rightarrow \text{R-COOH} + \text{R'-OH}
\]
Trong phản ứng này, nước tấn công vào liên kết ester, dẫn đến sự hình thành của axit carboxylic và rượu.
Các phân tử nước phân cực có khả năng hòa tan các ion và hợp chất khác, điều này làm cho nước trở thành một dung môi tuyệt vời trong quá trình xử lý nước. Hãy giải thích vai trò của tính phân cực trong quá trình loại bỏ kim loại nặng từ nước.
\[
\text{M^{2+}} + \text{H_2O} \rightarrow \text{[M(H_2O)_6]^{2+}}
\]
Ở đây, ion kim loại nặng được hòa tan trong nước, nhờ vào khả năng hòa tan của nước, quá trình xử lý có thể loại bỏ chúng dễ dàng hơn.
Tính phân cực của nước cũng là yếu tố quyết định trong phản ứng giữa axit và bazơ. Ví dụ, trong phản ứng giữa axit clohydric (HCl) và natri hydroxide (NaOH):
\[
\text{HCl} + \text{NaOH} \rightarrow \text{NaCl} + H_2O
\]
Nước trong phản ứng này hoạt động như một dung môi phân cực, giúp ion H+ từ HCl và OH− từ NaOH kết hợp tạo thành nước.
Tính phân cực không chỉ quan trọng trong các phản ứng hóa học cơ bản mà còn được ứng dụng rộng rãi trong y học và công nghiệp. Ví dụ, trong ngành công nghiệp sản xuất xà phòng:
\[
\text{C_3H_5(OOC\text{R})_3} + 3\text{NaOH} \rightarrow \text{C_3H_5(OH)_3} + 3\text{RCOONa}
\]
Ở đây, phản ứng xà phòng hóa sử dụng tính phân cực của nước để tách các axit béo ra khỏi glycerol, tạo thành xà phòng và glycerin.
Thông qua các bài tập trên, bạn có thể thấy rằng tính phân cực của phân tử nước không chỉ ảnh hưởng đến sự phân ly của các chất trong dung dịch mà còn đóng vai trò quan trọng trong việc thúc đẩy và điều chỉnh các phản ứng hóa học khác nhau.
Bài Tập 6: Nước và Tính Căng Bề Mặt trong Thực Tiễn
Tính căng bề mặt của nước là một đặc tính quan trọng, phát sinh từ tính chất phân cực của các phân tử nước. Tính chất này giúp nước tạo ra một màng mỏng trên bề mặt, có thể hỗ trợ các hiện tượng như nổi của một số vật thể nhỏ trên mặt nước hoặc khả năng di chuyển của một số loài côn trùng trên mặt nước.
Dưới đây là một số ứng dụng cụ thể của tính căng bề mặt trong thực tiễn:
- Hiện tượng mao dẫn:
Tính căng bề mặt cùng với lực hấp dẫn giữa các phân tử nước và bề mặt chất rắn giúp nước có thể di chuyển trong các khe hẹp, như trong mạch gỗ của cây. Điều này cho phép cây hút nước từ rễ lên các bộ phận phía trên.
- Khả năng nổi của các vật nhỏ:
Những vật thể nhẹ, chẳng hạn như lá cây hay côn trùng, có thể nổi trên mặt nước mà không bị chìm do tính căng bề mặt của nước.
- Sử dụng trong công nghệ:
Tính căng bề mặt được ứng dụng trong việc sản xuất các thiết bị y tế như kim tiêm có đường kính nhỏ. Các chất lỏng chứa trong các thiết bị này cần duy trì hình dạng nhờ vào tính căng bề mặt.
Trong nghiên cứu và phát triển, tính căng bề mặt của nước còn được sử dụng để tạo ra các loại vật liệu mới có khả năng chống thấm nước hoặc giữ nước tốt hơn.

Bài Tập 7: Nước và Các Ứng Dụng Công Nghiệp
Nước là một hợp chất phân cực, có khả năng hòa tan nhiều chất khác nhau. Điều này mang lại cho nước những tính chất độc đáo, giúp nó trở thành một yếu tố quan trọng trong nhiều ứng dụng công nghiệp. Trong bài tập này, chúng ta sẽ khám phá vai trò của nước trong các ngành công nghiệp khác nhau và cách tính chất phân cực của nước được ứng dụng trong thực tế.
- Ngành công nghiệp hóa chất: Nước được sử dụng như một dung môi để pha trộn và phản ứng các hóa chất khác nhau. Do tính phân cực của nước, nó có khả năng hòa tan nhiều loại muối, acid và base, giúp quá trình sản xuất và tinh chế các hóa chất trở nên hiệu quả hơn.
- Ngành công nghiệp thực phẩm: Trong công nghiệp thực phẩm, nước được dùng để chiết xuất hương vị, bảo quản thực phẩm và làm sạch. Tính phân cực của nước giúp nó hòa tan và vận chuyển các chất dinh dưỡng, cũng như loại bỏ các tạp chất trong quá trình sản xuất thực phẩm.
- Ngành công nghiệp dệt may: Nước đóng vai trò quan trọng trong quá trình nhuộm và xử lý vải. Tính phân cực của nước cho phép nó hòa tan các loại thuốc nhuộm và các chất hóa học khác, giúp màu sắc bám vào sợi vải một cách đồng đều và bền vững.
- Ngành công nghiệp năng lượng: Nước là thành phần chính trong các hệ thống làm mát của nhà máy điện. Tính chất nhiệt động học của nước, cùng với khả năng hòa tan và vận chuyển các ion, giúp nước trở thành môi trường lý tưởng để hấp thụ và truyền tải nhiệt lượng.
Qua các ví dụ trên, chúng ta có thể thấy rằng nước không chỉ là một chất lỏng thông thường, mà còn là một công cụ mạnh mẽ trong nhiều quy trình công nghiệp. Tính phân cực của nước tạo điều kiện thuận lợi cho nhiều ứng dụng khác nhau, từ sản xuất hóa chất, chế biến thực phẩm đến xử lý và bảo quản sản phẩm dệt may.
Hãy thử áp dụng kiến thức về nước và tính phân cực của nó vào các tình huống thực tế để thấy được tầm quan trọng của nước trong cuộc sống và công nghiệp.
Bài Tập 8: Tính Toán Liên Kết Hydro trong Các Phân Tử Sinh Học
Trong các phân tử sinh học, liên kết hydro đóng vai trò quan trọng trong việc duy trì cấu trúc và chức năng của các phân tử như DNA, protein, và các loại acid nucleic khác. Để hiểu rõ hơn về tính toán liên kết hydro, chúng ta cần xem xét một số khía cạnh quan trọng.
- Tính chất của nước: Nước là một phân tử phân cực, nghĩa là nó có hai đầu mang điện tích trái dấu do sự phân bố không đều của các electron trong liên kết O-H. Liên kết hydro hình thành khi nguyên tử hydrogen của phân tử này hút nguyên tử oxygen của phân tử nước khác, tạo ra một liên kết yếu nhưng quan trọng.
- Ứng dụng trong sinh học: Liên kết hydro trong nước là yếu tố chính giúp duy trì cấu trúc xoắn kép của DNA và ảnh hưởng đến cấu trúc bậc hai và bậc ba của protein. Các phân tử nước tạo ra một môi trường mà ở đó các liên kết hydro liên tục hình thành và phá vỡ, tạo điều kiện cho các phản ứng sinh học diễn ra.
- Tính toán liên kết hydro:
- Đầu tiên, ta xác định số lượng các phân tử nước có thể liên kết với một phân tử sinh học cụ thể, như một chuỗi polypeptide hoặc một đoạn DNA.
- Sau đó, áp dụng các công thức liên quan để tính toán lực tương tác giữa các liên kết hydro, thường sử dụng hằng số Boltzmann để ước tính năng lượng tương ứng.
- Cuối cùng, kết quả tính toán sẽ cho thấy mức độ ổn định của cấu trúc phân tử trong môi trường nước, ảnh hưởng đến chức năng sinh học của nó.
- Tác động của nhiệt độ: Nhiệt độ là yếu tố ảnh hưởng lớn đến liên kết hydro. Khi nhiệt độ tăng, các liên kết hydro dễ bị phá vỡ, dẫn đến sự thay đổi cấu trúc và thậm chí là mất chức năng của phân tử sinh học.
Việc hiểu rõ liên kết hydro và cách tính toán chúng trong các phân tử sinh học giúp chúng ta nắm bắt được cơ chế hoạt động của các quá trình sinh học phức tạp, từ đó ứng dụng vào nghiên cứu và phát triển trong y học và công nghệ sinh học.
Bài Tập 9: Phân Tích Vai Trò của Nước trong Cơ Thể Người
Trong cơ thể người, nước đóng vai trò vô cùng quan trọng và chiếm khoảng 60% trọng lượng cơ thể. Nước không chỉ là thành phần chính của các tế bào mà còn tham gia vào hầu hết các quá trình sinh hóa cần thiết cho sự sống. Dưới đây là một số vai trò cụ thể của nước trong cơ thể:
- Vận chuyển chất dinh dưỡng: Nước là dung môi phân cực, có khả năng hòa tan nhiều chất khác nhau, giúp vận chuyển chất dinh dưỡng và oxy đến các tế bào.
- Điều hòa nhiệt độ: Nhờ vào khả năng hấp thụ và phát tán nhiệt, nước giúp điều chỉnh nhiệt độ cơ thể thông qua quá trình tiết mồ hôi và bốc hơi.
- Bảo vệ cơ quan: Nước tạo ra một lớp đệm bảo vệ xung quanh các cơ quan quan trọng như não, tủy sống, và thai nhi trong bụng mẹ.
- Tham gia vào quá trình tiêu hóa: Nước giúp quá trình tiêu hóa diễn ra thuận lợi bằng cách hòa tan các enzyme và chất dinh dưỡng trong dạ dày và ruột.
Để phân tích vai trò của nước trong cơ thể, ta có thể tính toán một số liên kết hydro quan trọng liên quan đến các phân tử sinh học:
- Xét liên kết hydro giữa phân tử nước và phân tử protein trong cơ thể:
Phân tử nước có thể hình thành liên kết hydro với nhóm carbonyl \((C=O)\) và nhóm amino \((NH_2)\) của protein, đóng vai trò trong việc duy trì cấu trúc bậc hai của protein.
- Xét liên kết hydro giữa phân tử nước và DNA:
Liên kết hydro hình thành giữa nước và các bazơ nitơ trong DNA giúp ổn định cấu trúc xoắn kép của DNA.
Qua các vai trò và liên kết hydro được tính toán, ta có thể thấy rằng nước không chỉ là một thành phần quan trọng mà còn là yếu tố không thể thiếu giúp cơ thể hoạt động một cách hiệu quả và bền vững.
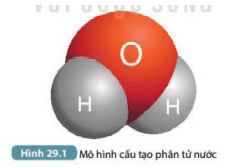
Bài Tập 10: Tính Toán Liên Kết Hydro trong Mô Hình 3D
Trong bài tập này, chúng ta sẽ phân tích chi tiết các bước để tính toán liên kết hydro trong một mô hình 3D, đặc biệt là khi liên kết hydro đóng vai trò quan trọng trong cấu trúc và tính chất của các phân tử sinh học.
- Bước 1: Xác định các phân tử nước trong mô hình 3D. Phân tử nước là một phân tử phân cực với một nguyên tử oxy và hai nguyên tử hydro, tạo nên một hình dạng uốn cong đặc trưng.
- Bước 2: Xác định các vị trí của các nguyên tử hydro và oxy trong mô hình 3D. Điều này là quan trọng để xác định đúng các vùng phân bố điện tích dương và âm trong các phân tử.
- Bước 3: Tính toán lực tương tác giữa các phân tử nước dựa trên liên kết hydro. Liên kết hydro là liên kết yếu, nhưng nó giữ vai trò quan trọng trong việc duy trì cấu trúc của các phân tử sinh học như protein và DNA.
- Bước 4: Sử dụng công thức tính toán năng lượng của liên kết hydro trong mô hình 3D:
Trong đó:
- \(Q_{1}\) và \(Q_{2}\) là điện tích tại các đầu liên kết hydro.
- \(r\) là khoảng cách giữa hai nguyên tử trong liên kết.
- \(\theta\) là góc tạo bởi các liên kết trong mô hình 3D.
Kết quả tính toán sẽ giúp ta hiểu rõ hơn về cách các phân tử tương tác với nhau thông qua liên kết hydro trong không gian ba chiều, đặc biệt là trong các hệ sinh học phức tạp.