Rượu, một trong những đồ uống được ưa chuộng nhất trên thế giới, có một công thức hóa học độc đáo và tính chất sử dụng đa dạng. Trong bài viết này, chúng ta sẽ khám phá các đặc điểm quan trọng của rượu etylic và công thức hóa học chi tiết của nó.
- Câu hỏi hội thi ngày Phụ nữ Việt Nam 20/10 (Có đáp án) Câu hỏi tọa đàm ngày Phụ nữ Việt Nam
- Paralegal là gì? Những thông tin cơ bản cần biết về Paralegal
- Cách chia động từ Lose trong tiếng anh
- Cơ cấu tổ chức – Nhà Xuất Bản Giáo Dục Tại Thành Phố Hồ Chí Minh
- Thi bằng lái xe máy Hà Nội ở đâu? Giá bao nhiêu?
Contents
Công thức hóa học của rượu etylic
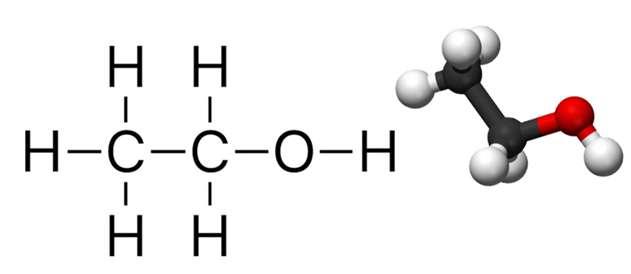
Rượu etylic, hay còn được gọi là ethanol hoặc ancol etylic, là thành phần chính của rượu, bia và các loại đồ uống có cồn khác. Công thức chung của rượu etylic là C2H6O, còn công thức hóa học chi tiết là C2H5OH. Với khối lượng phân tử là 46, rượu etylic có cấu trúc gồm một nhóm etyl CH3-CH2- được liên kết với một nhóm hidroxyl (-OH).
Bạn đang xem: Các Tính Chất Và Công Thức Hóa Học Của Rượu Etylic
.png)
Tính chất hóa học của rượu etylic
Rượu etylic thuộc nhóm ancol đơn chức do chỉ có một nhóm -OH trong dãy đồng đẳng của CH3OH. Điều này mang lại cho nó một số tính chất hóa học đặc biệt.
Phản ứng với kim loại mạnh
Rượu etylic có khả năng phản ứng với các kim loại mạnh như Na, K, tạo ra khí H2.
PTPƯ: 2C2H5OH + Na → 2C2H5ONa + H2↑
Phản ứng oxi hóa
Rượu etylic rất dễ cháy và không tạo ra khói khi cháy. Phản ứng oxi hóa của nó tạo ra CO2 và H2O, cung cấp nhiều nhiệt.
Xem thêm : DCEO PAN Food Nguyễn Thái Hạnh Linh: “Hãy biến tuổi trẻ của mình trở thành tài sản”
C2H5OH + 3O2 → 2CO2 + 3H2O (phản ứng tạo nhiệt)
Phản ứng với axit axetic
Rượu etylic có khả năng phản ứng với axit axetic để tạo ra este.
Tổng quát phản ứng este hóa:
ROH + R’COOH ↔ R’COOR + H2O
Phản ứng này diễn ra trong môi trường có axit và được đun nóng. Chú ý đến các yếu tố chuyển dịch cân bằng trong phản ứng này.
C2H5OH + CH3COOH ↔ CH3COOC2H5 + H2O
Tính chất vật lý của rượu etylic
Rượu etylic là một chất lỏng không màu, trong suốt, có mùi thơm và vị cay nhẹ. Nó nhẹ hơn nước và tan vô hạn trong nước, dễ bay hơi. Khối lượng riêng của rượu etylic là 0,789 g/cm3. Nhiệt độ sôi của nó là 78,39 độ C, trong khi nhiệt độ nóng chảy đạt 114,15 độ C.
Rượu etylic có khả năng tạo liên kết hidro, do đó, nhiệt độ sôi của nó cao hơn so với các dẫn xuất khác của hidrocacbon có cùng khối lượng phân tử.

Các phương pháp điều chế rượu etylic
Rượu etylic là một chất hữu cơ phổ biến và điều chế nó không quá phức tạp. Dưới đây là hai phương pháp phổ biến để điều chế rượu etylic.
Lên men đường hoặc tinh bột và cộng hợp etylen với nước
Phương pháp này được sử dụng rộng rãi nhất. Quá trình này chủ yếu diễn ra thông qua quá trình lên men của đường hoặc tinh bột.
Tinh bột/đường → Rượu etylic:
C6H12O6 → 2CH3CH2OH + 2CO2
Etylen cộng hợp với nước có axit làm xúc tác:
CH2 = CH2 + H2O → C2H5OH
Công nghệ Hidrat hóa Etylen
Xem thêm : 50 công ty giải trí hàng đầu Cbiz: Nhà Châu Đông Vũ #1, Yuehua ba hoa cho lắm lại rơi khỏi top 20
Phương pháp này bao gồm thủy phân etylen để tạo ra rượu etylic.
CH3CHO + H2 → CH3-CH2-OH (phản ứng với xúc tác nhiệt độ và Ni)
Công thức tính độ rượu
Độ rượu là một chỉ số quan trọng khi nói về rượu etylic. Để nhanh chóng đo độ rượu của một loại rượu, chỉ cần biết số ml etylic nguyên chất có trong 100ml hỗn hợp etylic với nước.
Ứng dụng của rượu etylic
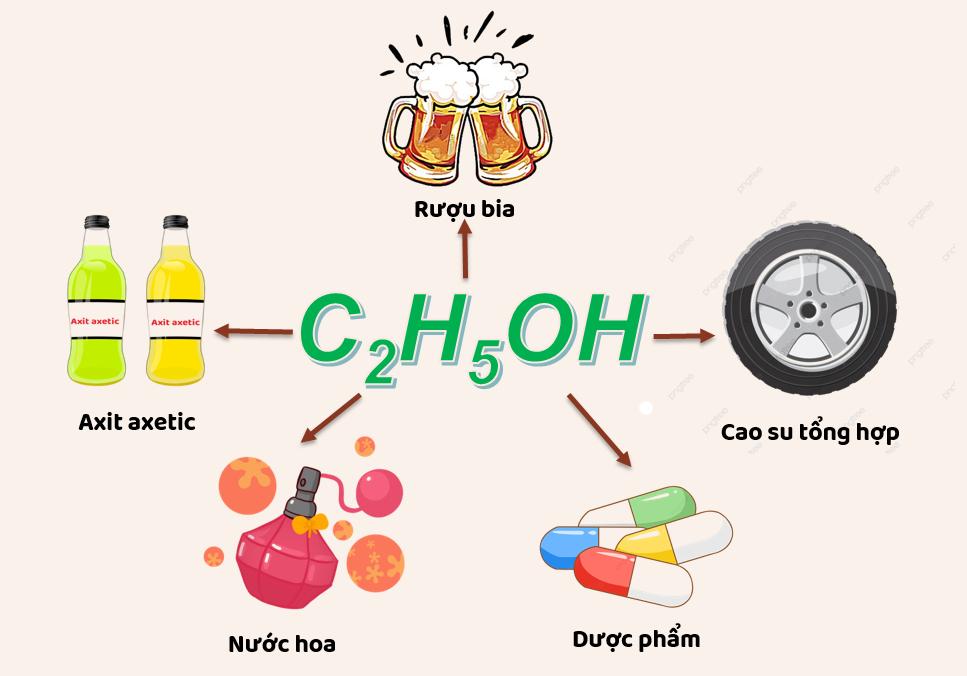
Rượu etylic có ứng dụng rất đa dạng. Nó được sử dụng làm nguyên liệu chính trong sản xuất dược phẩm, rượu, bia, đồ uống có cồn, cao su tổng hợp và axit axetic. Ngoài ra, rượu etylic được sử dụng làm dung môi trong sản xuất vecni và nước hoa.
Tác hại của rượu etylic
Rượu etylic có thể gây hại đến sức khỏe khi sử dụng quá mức, ảnh hưởng đến thần kinh và gây ra các rủi ro khác. Tùy thuộc vào nồng độ, rượu etylic có thể làm say, gây ra sự mất kiểm soát và ảnh hưởng đến sức khỏe.
Đó là toàn bộ những kiến thức cơ bản về rượu etylic, từ công thức hóa học, tính chất hóa học đến ứng dụng của nó. Hy vọng rằng bài viết này sẽ giúp bạn hiểu rõ hơn về một trong những chất lỏng quan trọng nhất trên thế giới.
Nguồn: https://ispacedanang.edu.vn
Danh mục: Học tập