Trong lĩnh vực hóa học, việc tính toán nồng độ phần trăm và nồng độ mol không chỉ giúp học sinh vượt qua các bài tập khó mà còn là nền tảng quan trọng trong củng cố kiến thức. Hiểu sâu về những kiến thức này là vô cùng quan trọng.
- Trại hè STEM là gì mà khiến phụ huynh đăng ký cho con em mình nhiều như vậy?
- Bảng hóa trị lớp 8 đầy đủ (Bảng hóa trị các nguyên tố hóa học)
- CÁCH DÙNG CHI TIẾT CẤU TRÚC ENCOURAGE VÀ BÀI TẬP
- Cơ hội cho thiếu niên tham gia trại hè miễn phí cùng bố mẹ tại Nhật Bản, Philippines
- Học Hè ở đâu cho Trẻ tại TpHCM
Trong bài viết này, chúng ta sẽ cùng khám phá các phương pháp tính nồng độ mol và nồng độ phần trăm cùng với việc giải quyết những bài tập tương ứng. Điều này sẽ giúp củng cố kiến thức của bạn và sẵn sàng cho những thử thách mới trong năm học sắp tới.
Bạn đang xem: Công thức tính nồng độ phần trăm (C%): Bài tập + Lời giải

Công thức tính C% và công thức tính nồng độ mol
Contents
Nồng độ là gì?
Nồng độ là khái niệm để biểu thị lượng hóa chất có trong một hỗn hợp, thường là dung dịch. Có một số khái niệm nồng độ phổ biến như:
- Nồng độ phần trăm
- Nồng độ mol
- Nồng độ molan: biểu thị số mol của một chất trong 1kg dung môi
- Nồng độ chuẩn: thường được sử dụng trong các phản ứng và dung dịch axit-bazơ
- Nồng độ chính tắc: cách đo nồng độ tương tự như nồng độ mol, nhưng ít được sử dụng
.png)
Nồng độ phần trăm là gì?
Nồng độ phần trăm biểu thị số gam chất tan có trong 100g dung dịch và được ký hiệu là C%.
1. Công thức tính nồng độ phần trăm
Các chuyên gia đã nghiên cứu và thử nghiệm để đưa ra công thức tính nồng độ phần trăm chính xác nhất. Công thức tính C% trong hóa học như sau:
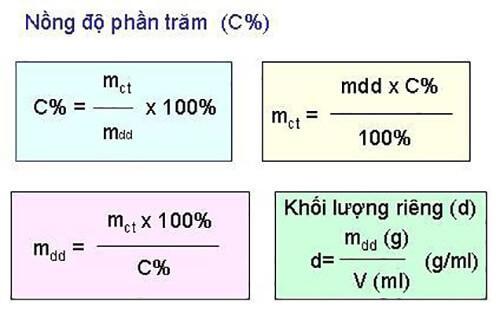
Trong đó:
- C% là ký hiệu của nồng độ phần trăm
- mct là ký hiệu của khối lượng chất tan
- mdd là ký hiệu của khối lượng dung dịch
Công thức tính mdd:
mdd = mct + mdm (trong đó mdm là khối lượng của dung môi)
2. Các bước giải bài tập tính nồng độ phần trăm
Các dạng bài tập tính nồng độ phần trăm trong hóa học rất đa dạng, nhưng chúng đều phải thực hiện theo các bước sau đây:
- Xác định số chất có trong dung dịch, đặc biệt là số dư của chất tham gia phản ứng.
- Tính khối lượng dung dịch sau phản ứng theo phương pháp bảo toàn khối lượng (tổng khối lượng chất tham gia phản ứng = tổng khối lượng sản phẩm).
- Tính mct (khối lượng chất tan).
- Áp dụng công thức tính nồng độ phần trăm để giải quyết bài tập.
Áp dụng đúng các bước trên, bạn có thể tính toán nồng độ phần trăm dễ dàng. Tuy nhiên, trong một số bài tập, khối lượng các chất không được cung cấp, bạn phải áp dụng kiến thức hóa học đã học kết hợp với công thức tính nồng độ phần trăm để giải quyết bài tập.
Bài tập tính nồng độ phần trăm của dung dịch
Bài 1: Tính khối lượng NaOH trong 200g dung dịch NaOH 15%
Lời giải:
Áp dụng công thức C% = (mct/mdd) 100% ta có:
C% = (mNaOH/200) 100 = 15 (%)
=> mNaOH = (15 * 200) / 100 = 30 (g)
Trong đó:
(.) ký hiệu dấu nhân
(/) ký hiệu dấu chia
Xem thêm : Thông tin
Kết luận: Trong 200g dung dịch NaOH 15% có 30g NaOH.
Bài 2: Hòa tan 20g muối vào nước để có dung dịch A có C% = 10%. Hãy tính khối lượng dung dịch A và khối lượng nước cần thiết.
Lời giải:
a) Áp dụng công thức C% = (mct/mdd) 100% ta có:
mdd = (mmuối 100) / C% = (20 * 100) / 10 = 200g
Kết luận: Khối lượng dung dịch A là 200g.
b) Áp dụng phương pháp bảo toàn khối lượng ta có mnước = mdd – mmuối = 200 – 20 = 180g
Kết luận: Để hòa tan 20g muối, chúng ta cần 180g nước để tạo ra 200g dung dịch.
Bài 3: Hòa tan 3,9g Kali vào 36,2g nước để có dung dịch B. Hãy tính nồng độ phần trăm của dung dịch B.
Lời giải:
Số mol của K = 3,9 / 39 = 0,1 => mol KOH = 0,1 => mol H2O = 0,05
Theo cân bằng phản ứng hóa học, ta tính được mdd = mk + mH2O – mH2 = 3,9 + 36,2 – (0,05 2) = 40g
=> Áp dụng công thức C% = (mct/mdd) 100% ta có C% = [(0,1 56) / 40] 100% = 14%
Kết luận: Khi hòa tan 3,9g Kali vào 36,2g nước, ta có dung dịch có nồng độ 14%.
Bài 4: Hòa tan 10g đường vào 40g nước. Hãy tính nồng độ phần trăm của dung dịch.
Lời giải:
Khối lượng của dung dịch là:
mdd = mdm + mct = 10 + 40 = 50g
Nồng độ phần trăm là:
C% = (mct/mdd) 100% = (10/50) 100% = 20%
Vậy nồng độ phần trăm của dung dịch thu được sau phản ứng là 20%.
Bài 5: Dung dịch HCl có nồng độ 36%. Hãy tính khối lượng HCl có trong 200g dung dịch.
Lời giải:
Nồng độ phần trăm của dung dịch là:
C% = (mct/mdd) 100%
=> mct = (C% mdd) / 100%
Vậy khối lượng chất tan HCl là: mHCl = (36% * 200g) / 100% = 72g.
Các bài tập liên quan: Phản ứng nhiệt phân KClO3.
Nguồn: https://ispacedanang.edu.vn
Danh mục: Khám phá














