Chủ đề xác định electron độc thân: Xác định electron độc thân là một khái niệm quan trọng trong hóa học, ảnh hưởng đến tính chất và hoạt động của nguyên tử. Bài viết này sẽ cung cấp hướng dẫn chi tiết về cách xác định electron độc thân, đồng thời khám phá các ứng dụng và ví dụ thực tiễn trong khoa học hiện đại.
Mục lục
Xác Định Electron Độc Thân
Electron độc thân là các electron tồn tại riêng lẻ trong các orbital nguyên tử, không cặp với bất kỳ electron nào khác. Việc xác định electron độc thân là một phần quan trọng trong việc hiểu cấu trúc electron của các nguyên tử và phân tử, từ đó giúp phân tích các đặc tính hóa học và phản ứng hóa học của chúng.
Cách Xác Định Electron Độc Thân
- Xác định cấu hình electron của nguyên tử: Để xác định số lượng electron độc thân, trước tiên cần xác định cấu hình electron của nguyên tử. Cấu hình electron mô tả sự phân bố các electron trong các orbital nguyên tử.
- Áp dụng quy tắc Hund: Sau khi có cấu hình electron, quy tắc Hund được áp dụng để xác định cách các electron được sắp xếp trong các orbital của một phân lớp. Theo quy tắc này, các electron sẽ chiếm các orbital riêng biệt trước khi ghép đôi.
- Xác định số electron độc thân: Các electron nằm trong các orbital riêng lẻ mà không ghép đôi chính là các electron độc thân. Số lượng các electron này chính là số electron độc thân của nguyên tử đó.
Ví Dụ Về Electron Độc Thân
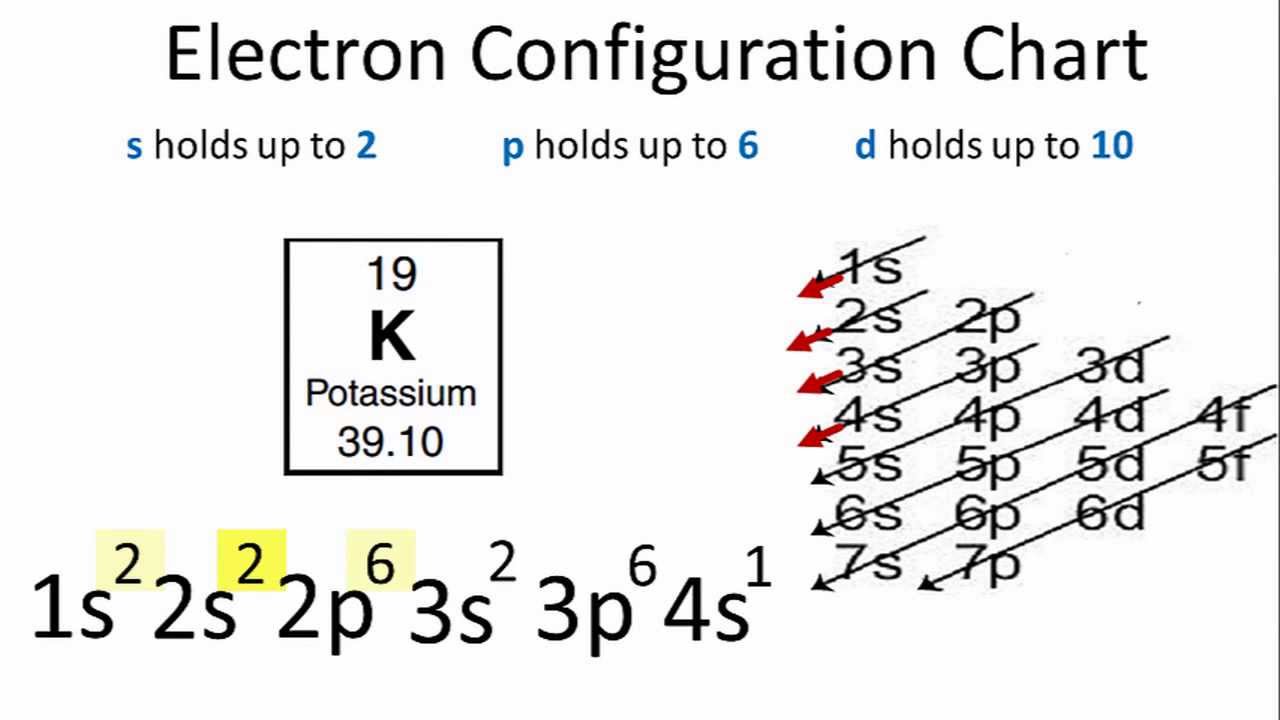
Dưới đây là một số ví dụ về cách xác định số electron độc thân của các nguyên tử với số hiệu nguyên tử khác nhau:
| Nguyên tử | Cấu hình electron | Số electron độc thân |
|---|---|---|
| Phosphorus (Z=15) | 1s2 2s2 2p6 3s2 3p3 | 3 |
| Chromium (Z=24) | [Ar] 3d5 4s1 | 6 |
| Copper (Z=29) | [Ar] 3d10 4s1 | 1 |
Ứng Dụng Của Electron Độc Thân
- Phản ứng hóa học: Electron độc thân thường rất hoạt động và có thể tham gia vào các phản ứng hóa học, đặc biệt là trong việc hình thành gốc tự do.
- Tính chất từ: Một số nguyên tố có electron độc thân thể hiện tính thuận từ, chẳng hạn như oxy (O2).
- Vật liệu hóa học: Electron độc thân có vai trò quan trọng trong việc nghiên cứu và phát triển các vật liệu mới, đặc biệt là trong khoa học vật liệu và công nghệ nano.
Việc hiểu rõ và xác định electron độc thân là cơ sở để nghiên cứu và ứng dụng trong nhiều lĩnh vực hóa học và vật lý, mở ra nhiều tiềm năng cho việc phát triển các công nghệ mới.

.png)
Tổng Quan Về Electron Độc Thân
Electron độc thân là một khái niệm quan trọng trong hóa học, mô tả các electron tồn tại riêng lẻ trong các orbital nguyên tử mà không tạo thành cặp với bất kỳ electron nào khác. Sự hiện diện của electron độc thân ảnh hưởng lớn đến tính chất hóa học và lý tính của nguyên tử, phân tử.
- Định nghĩa cơ bản: Electron độc thân là electron không ghép đôi trong một orbital nguyên tử. Điều này khiến các nguyên tử hoặc phân tử có tính phản ứng cao hơn vì electron độc thân có xu hướng tham gia vào các phản ứng hóa học.
- Vai trò trong hóa học: Electron độc thân thường xuất hiện trong các gốc tự do, đóng vai trò quan trọng trong các phản ứng oxy hóa khử, phản ứng dây chuyền, và các quá trình liên kết hóa học phức tạp.
- Các yếu tố ảnh hưởng: Cấu hình electron và các quy tắc hóa học như Hund và Pauli là những yếu tố quan trọng giúp xác định sự hiện diện của electron độc thân trong nguyên tử hoặc phân tử.
Hiểu rõ về electron độc thân không chỉ giúp xác định tính chất hóa học của các chất mà còn mở ra những ứng dụng mới trong khoa học vật liệu và công nghệ hiện đại, đặc biệt là trong việc nghiên cứu các vật liệu mới và tối ưu hóa các phản ứng hóa học.
Phương Pháp Xác Định Electron Độc Thân
Xác định electron độc thân là một bước quan trọng trong việc hiểu cấu trúc và tính chất của nguyên tử, phân tử. Dưới đây là các phương pháp chính để xác định electron độc thân một cách chi tiết và có hệ thống:
-
Xác định cấu hình electron của nguyên tử:
Bước đầu tiên là xác định cấu hình electron của nguyên tử bằng cách phân bổ các electron vào các orbital theo thứ tự năng lượng từ thấp đến cao. Sắp xếp các electron dựa trên các quy tắc như quy tắc Hund, nguyên lý Aufbau và quy tắc Pauli.
- Ví dụ: Cấu hình electron của carbon (Z=6) là 1s2 2s2 2p2.
-
Áp dụng quy tắc Hund:
Sau khi có cấu hình electron, quy tắc Hund được sử dụng để xác định cách các electron sắp xếp trong các orbital của cùng một phân lớp. Theo quy tắc này, các electron sẽ điền vào các orbital riêng lẻ trước khi ghép đôi, điều này giúp tối thiểu hóa lực đẩy giữa các electron.
- Quy tắc Hund: Mỗi orbital trong cùng một phân lớp sẽ nhận một electron trước khi bất kỳ orbital nào nhận electron thứ hai.
-
Xác định số electron độc thân:
Các electron nằm trong các orbital chưa ghép đôi chính là các electron độc thân. Đếm số lượng electron này để xác định số lượng electron độc thân trong nguyên tử.
- Ví dụ: Trong nguyên tử carbon, cấu hình 2p có hai electron độc thân.
-
Sử dụng cấu hình electron của ion hoặc phân tử:
Khi xét đến ion hoặc phân tử, cần điều chỉnh cấu hình electron để phản ánh sự mất hoặc nhận electron. Sau đó, thực hiện các bước trên để xác định số electron độc thân.
- Ví dụ: Ion O2- có một electron độc thân do sự thêm electron vào orbital 2p.
Việc xác định chính xác số lượng electron độc thân giúp hiểu rõ hơn về tính chất hóa học của các chất và cơ chế phản ứng của chúng trong các quá trình hóa học.

Các Ví Dụ Thực Tiễn
Để hiểu rõ hơn về khái niệm electron độc thân, chúng ta có thể xem xét một số ví dụ thực tiễn về các nguyên tử và phân tử có chứa electron độc thân. Dưới đây là các ví dụ cụ thể:
-
Nguyên tử carbon (C):
Carbon có số hiệu nguyên tử là 6, với cấu hình electron là 1s2 2s2 2p2. Trong phân lớp 2p, có hai electron độc thân chiếm hai orbital p riêng biệt. Điều này giải thích tại sao carbon có thể tạo bốn liên kết hóa trị (như trong hợp chất CH4) với cấu trúc lai hóa sp3.
-
Phân tử oxy (O2):
Phân tử oxy có cấu hình electron cơ bản là 1s2 2s2 2p4. Khi tạo thành phân tử O2, hai nguyên tử oxy kết hợp với nhau, nhưng mỗi nguyên tử vẫn còn một electron độc thân trong các orbital pi, dẫn đến tính chất thuận từ của O2.
-
Nguyên tử nitơ (N):
Nitơ có số hiệu nguyên tử là 7, với cấu hình electron là 1s2 2s2 2p3. Ba electron độc thân chiếm ba orbital p riêng biệt, giúp nitơ tạo ra ba liên kết cộng hóa trị trong các phân tử như NH3.
-
Nguyên tố crom (Cr):
Chromium có cấu hình electron [Ar] 3d5 4s1. Với sáu electron độc thân trong các orbital d và s, nó có thể tham gia vào nhiều loại phản ứng hóa học và thể hiện nhiều trạng thái oxy hóa khác nhau, chẳng hạn như Cr(II), Cr(III), và Cr(VI).
-
Gốc tự do hydroxyl (OH•):
Gốc hydroxyl là một phân tử có một electron độc thân, làm cho nó cực kỳ hoạt động và dễ dàng tham gia vào các phản ứng hóa học, đặc biệt là trong cơ chế phá hủy tế bào bởi stress oxy hóa.
Các ví dụ trên minh họa cách electron độc thân đóng vai trò quan trọng trong việc xác định cấu trúc và tính chất của nguyên tử, phân tử, và gốc tự do, từ đó ảnh hưởng đến các phản ứng hóa học và tính chất vật lý của chúng.