Chủ đề ne electron configuration: Cấu hình electron của Neon (Ne) là một phần quan trọng trong việc hiểu rõ tính chất hóa học và ứng dụng của nguyên tố này. Trong bài viết này, chúng tôi sẽ phân tích chi tiết về cấu hình electron của Neon, vị trí của nó trong bảng tuần hoàn, và các ứng dụng thực tế trong đời sống.
Mục lục
Cấu hình electron của Neon (Ne)
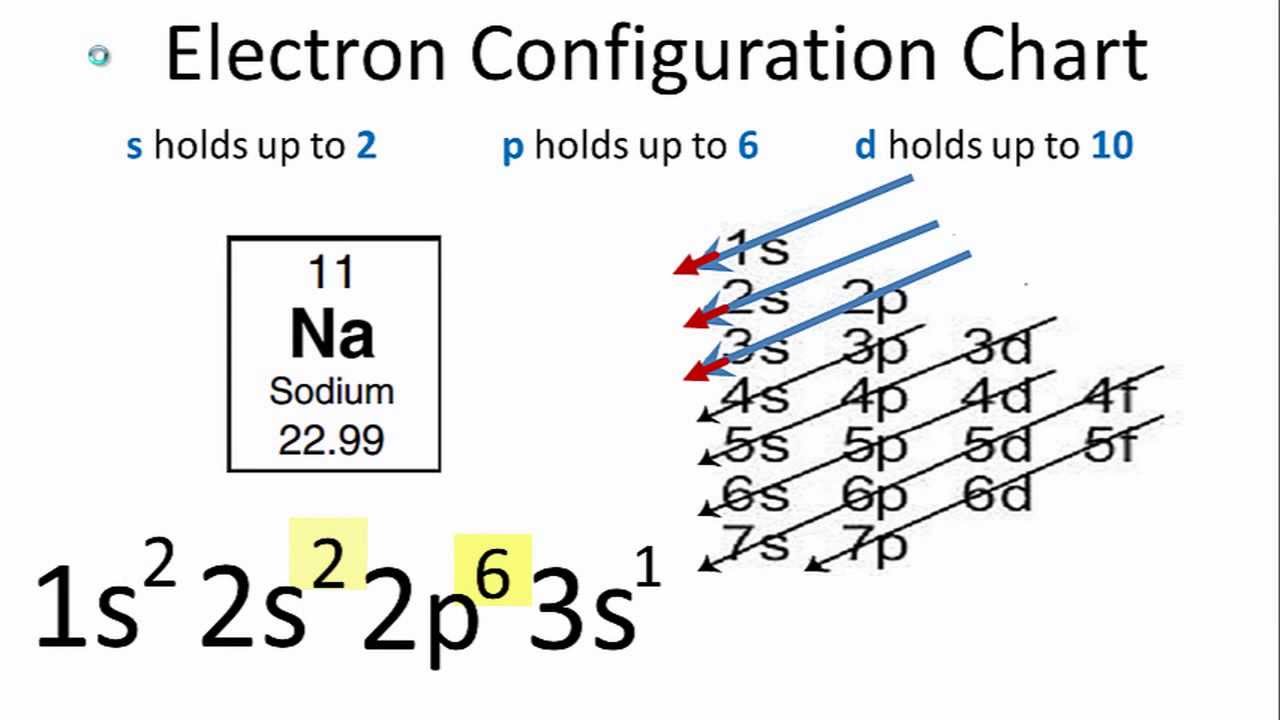
Neon (Ne) là một nguyên tố hóa học nằm trong nhóm khí hiếm thuộc chu kỳ 2 của bảng tuần hoàn các nguyên tố. Neon có số hiệu nguyên tử là 10, và điều này có nghĩa là một nguyên tử neon có 10 electron. Cấu hình electron của neon phản ánh cách các electron được sắp xếp trong các lớp và phân lớp của nguyên tử.
Cấu hình electron của Neon
Cấu hình electron của Neon (Ne) có thể được viết như sau:
Viết gọn: [He]2s22p6
Giải thích cấu hình electron của Neon
- Lớp 1 (1s2): Lớp đầu tiên chỉ có một phân lớp 1s chứa 2 electron.
- Lớp 2: Lớp thứ hai có một phân lớp 2s chứa 2 electron và một phân lớp 2p chứa 6 electron. Tổng cộng, lớp này chứa 8 electron, hoàn toàn bão hòa.
Tính chất hóa học của Neon
Neon là một khí hiếm với các tính chất đặc trưng sau:
- Neon là một trong các khí hiếm, có lớp vỏ electron ngoài cùng đã bão hòa, do đó nó không dễ dàng tham gia vào các phản ứng hóa học.
- Neon tồn tại chủ yếu dưới dạng khí đơn nguyên tử và không tạo thành hợp chất hóa học trong điều kiện bình thường.
- Neon phát sáng màu đỏ đặc trưng khi bị kích thích bởi điện trường, được ứng dụng rộng rãi trong đèn neon.
Mối quan hệ giữa cấu hình electron và vị trí trong bảng tuần hoàn
Vị trí của Neon trong bảng tuần hoàn có thể được xác định dựa trên cấu hình electron:
| Chu kỳ | 2 |
| Nhóm | VIIIA |
| Ô nguyên tố | 10 |
Neon thuộc nhóm khí hiếm, với 8 electron ở lớp vỏ ngoài cùng, giúp nó đạt được cấu hình bền vững và không phản ứng với các nguyên tố khác.
Ứng dụng của Neon
Neon có nhiều ứng dụng trong cuộc sống và công nghệ:
- Neon được sử dụng trong các biển quảng cáo, đèn neon với màu đỏ sáng đặc trưng.
- Neon còn được dùng trong ống chân không, bộ đếm Geiger và các thiết bị laser.

.png)
Giới thiệu về cấu hình electron của Neon
Neon (Ne) là một nguyên tố thuộc nhóm khí hiếm, nằm ở vị trí thứ 10 trong bảng tuần hoàn với số hiệu nguyên tử là 10. Cấu hình electron của Neon thể hiện cách các electron được phân bố trong các lớp và phân lớp của nguyên tử, giúp xác định tính chất hóa học của nguyên tố này. Với 10 electron, cấu hình electron của Neon được viết như sau:
Cấu hình này cho thấy Neon có 2 electron trong lớp vỏ đầu tiên (1s2) và 8 electron trong lớp vỏ thứ hai, bao gồm 2 electron ở phân lớp 2s và 6 electron ở phân lớp 2p. Cấu trúc này tạo nên lớp vỏ electron ngoài cùng bền vững, khiến Neon trở thành một trong những nguyên tố hóa học ổn định nhất, khó tham gia vào các phản ứng hóa học.
Nhờ cấu hình electron bền vững, Neon không tạo hợp chất hóa học trong điều kiện thường và chủ yếu tồn tại dưới dạng khí đơn nguyên tử. Sự ổn định này giúp Neon có nhiều ứng dụng quan trọng, đặc biệt trong công nghiệp chiếu sáng và các thiết bị điện tử.
Cấu hình electron chi tiết của Neon
Cấu hình electron của Neon (Ne) phản ánh cách mà các electron được phân bố trong các lớp và phân lớp khác nhau của nguyên tử. Để hiểu rõ hơn về cấu hình electron của Neon, chúng ta cần xem xét chi tiết từng lớp và phân lớp electron.
- Lớp 1: Lớp đầu tiên chỉ có một phân lớp là 1s, và trong trường hợp của Neon, phân lớp này chứa 2 electron. Cách viết cấu hình cho lớp này là .
- Lớp 2: Lớp thứ hai bao gồm hai phân lớp là 2s và 2p:
- Phân lớp 2s: Phân lớp này chứa 2 electron, được viết là .
- Phân lớp 2p: Phân lớp này chứa 6 electron, được viết là . Đây là phân lớp cuối cùng và nó hoàn toàn bão hòa, góp phần tạo nên tính ổn định của Neon.
Tổng hợp lại, cấu hình electron đầy đủ của Neon có thể viết dưới dạng:
Với cấu hình electron 1s22s22p6, Neon đạt được cấu hình bền vững với đầy đủ các electron trong lớp vỏ ngoài cùng. Điều này giải thích tại sao Neon không tham gia vào các phản ứng hóa học thông thường và được coi là một trong những khí hiếm ổn định nhất.

Vị trí của Neon trong bảng tuần hoàn
Neon (Ne) là một nguyên tố hóa học quan trọng thuộc nhóm khí hiếm, hay còn gọi là nhóm 18 trong bảng tuần hoàn các nguyên tố. Dưới đây là vị trí cụ thể và các thông tin liên quan đến Neon trong bảng tuần hoàn.
- Số hiệu nguyên tử: Neon có số hiệu nguyên tử là 10, tức là trong một nguyên tử Neon có 10 proton trong hạt nhân.
- Chu kỳ: Neon nằm ở chu kỳ 2 của bảng tuần hoàn. Điều này có nghĩa là nó có hai lớp electron.
- Nhóm: Neon thuộc nhóm 18, còn được biết đến là nhóm khí hiếm hoặc nhóm VIIIA. Các nguyên tố trong nhóm này đều có cấu hình electron bền vững và không dễ tham gia vào các phản ứng hóa học.
- Cấu hình electron: Với cấu hình electron 1s22s22p6, lớp vỏ electron ngoài cùng của Neon hoàn toàn bão hòa, điều này giải thích tính chất trơ về mặt hóa học của nó.
Bảng dưới đây tóm tắt các thông tin quan trọng về vị trí của Neon trong bảng tuần hoàn:
| Ô nguyên tố | 10 |
| Chu kỳ | 2 |
| Nhóm | 18 (VIIIA) |
| Số electron lớp ngoài cùng | 8 |
Neon, với lớp vỏ electron hoàn toàn đầy đủ, không chỉ đứng ở vị trí quan trọng trong nhóm khí hiếm mà còn là một trong những nguyên tố ít phản ứng nhất trong tự nhiên. Điều này giúp nó có nhiều ứng dụng trong công nghiệp, đặc biệt là trong lĩnh vực chiếu sáng và các thiết bị điện tử.