Chủ đề ground state electron configuration: Ground state electron configuration là một khái niệm quan trọng trong hóa học và vật lý lượng tử, giúp giải thích cách các electron phân bố trong nguyên tử. Bài viết này cung cấp cái nhìn toàn diện về cấu hình electron, từ nguyên tắc cơ bản đến các ứng dụng thực tế, đồng thời khám phá các trường hợp cấu hình đặc biệt của các nguyên tố.
Mục lục
Cấu hình electron trạng thái cơ bản
Trong hóa học và vật lý lượng tử, cấu hình electron trạng thái cơ bản mô tả cách mà các electron phân bố trong các orbital của một nguyên tử hoặc phân tử ở trạng thái năng lượng thấp nhất.
Nguyên tắc xây dựng cấu hình electron
- Nguyên tắc Hund: Các electron sẽ phân bố đều vào các orbital tương đương về năng lượng trước khi ghép đôi.
- Nguyên tắc Pauli: Không có hai electron nào trong cùng một nguyên tử có thể có cùng một bộ bốn số lượng tử.
- Quy tắc Aufbau: Electron sẽ lấp đầy các orbital có năng lượng thấp trước, sau đó mới đến các orbital có năng lượng cao hơn.
Ký hiệu cấu hình electron
Cấu hình electron thường được biểu diễn bằng một chuỗi các nhãn orbital (ví dụ: \(1s^2 2s^2 2p^6\)) trong đó số mũ chỉ số electron có trong từng orbital.
Ví dụ, cấu hình electron của nguyên tử Neon (Ne) là:
\[1s^2 2s^2 2p^6\]
Cấu hình này có nghĩa là trong lớp vỏ 1 có hai electron trong orbital s, trong lớp vỏ 2 có hai electron trong orbital s và sáu electron trong orbital p.
Ứng dụng của cấu hình electron
- Dự đoán tính chất hóa học của các nguyên tố.
- Giải thích các hiện tượng vật lý như từ tính và màu sắc của các chất.
- Phân loại nguyên tố trong bảng tuần hoàn.
Các dạng cấu hình electron đặc biệt
Một số nguyên tố có cấu hình electron không tuân theo quy tắc Aufbau một cách chặt chẽ do ảnh hưởng của sự ổn định đặc biệt trong các cấu hình đầy hoặc nửa đầy của các orbital d và f.
Ví dụ, cấu hình electron của nguyên tử đồng (Cu) thường được viết là:
\[ [Ar] 3d^{10} 4s^1 \]
Thay vì dự kiến là \( [Ar] 3d^9 4s^2 \), do sự ổn định đặc biệt của lớp d đầy.
Bảng cấu hình electron của một số nguyên tố
| Nguyên tố | Cấu hình electron |
|---|---|
| Hydrogen (H) | \[1s^1\] |
| Helium (He) | \[1s^2\] |
| Lithium (Li) | \[1s^2 2s^1\] |
| Carbon (C) | \[1s^2 2s^2 2p^2\] |
| Neon (Ne) | \[1s^2 2s^2 2p^6\] |

.png)
Giới thiệu về cấu hình electron
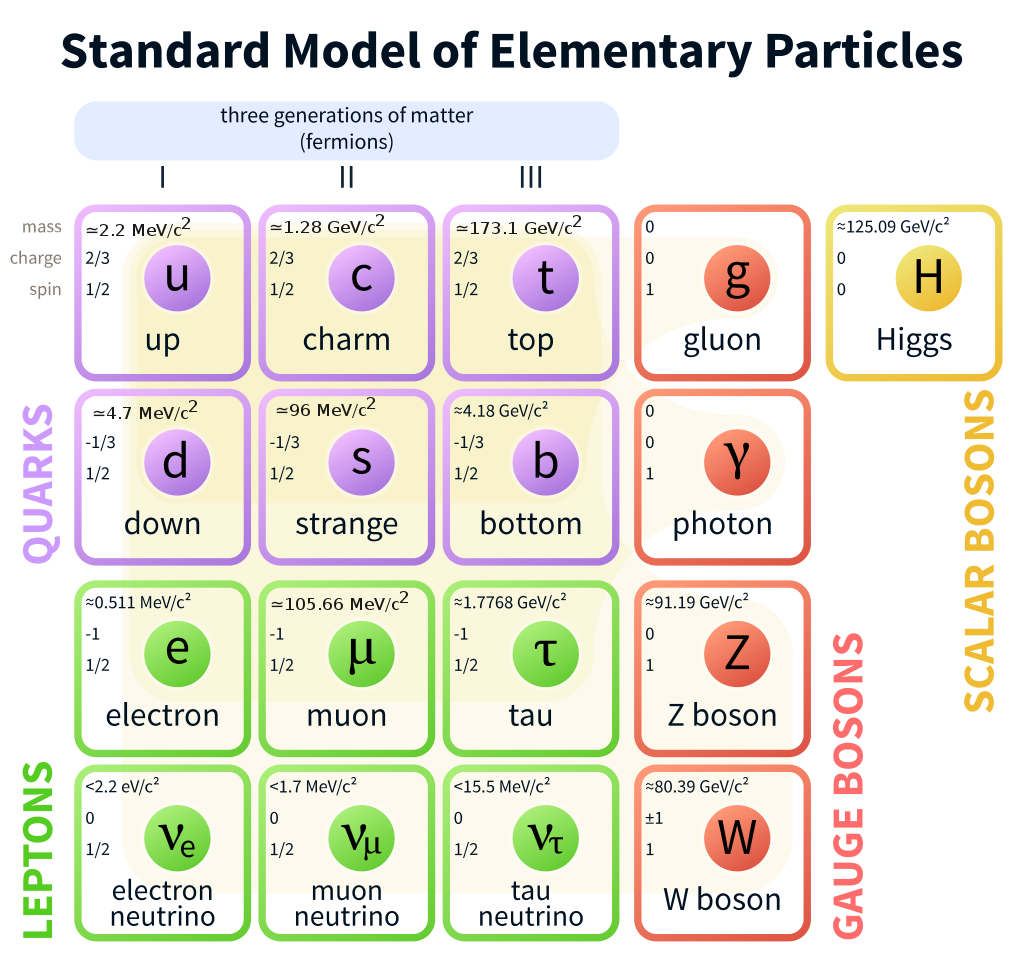
Cấu hình electron là cách phân bố các electron trong các lớp và phân lớp orbital của một nguyên tử. Mỗi nguyên tử bao gồm hạt nhân ở trung tâm, xung quanh là các electron di chuyển theo các quỹ đạo khác nhau. Mỗi electron trong nguyên tử được mô tả bởi một bộ số lượng tử xác định vị trí của nó trong không gian.
Trong quá trình tìm hiểu cấu hình electron, có ba nguyên tắc cơ bản cần ghi nhớ:
- Quy tắc Aufbau: Các electron sẽ lấp đầy các orbital có năng lượng thấp trước khi lấp đầy các orbital có năng lượng cao hơn.
- Nguyên tắc Hund: Khi các electron chiếm các orbital có cùng mức năng lượng, chúng sẽ phân bố đều vào các orbital trước khi ghép đôi.
- Nguyên tắc Pauli: Mỗi orbital có thể chứa tối đa hai electron, và chúng phải có spin ngược chiều nhau.
Cấu hình electron không chỉ xác định tính chất hóa học của nguyên tử mà còn giải thích các hiện tượng vật lý như từ tính, màu sắc và độ dẫn điện của chất. Ví dụ, cấu hình electron của nguyên tố oxy là \[1s^2 2s^2 2p^4\], với 6 electron ở lớp vỏ ngoài cùng, xác định tính oxi hóa mạnh mẽ của nguyên tố này.
Ký hiệu và biểu diễn cấu hình electron
Cấu hình electron của một nguyên tử được biểu diễn bằng cách sắp xếp các electron vào các orbital theo thứ tự năng lượng từ thấp đến cao. Mỗi orbital được ký hiệu bằng một tổ hợp các chữ cái và số, trong đó:
- Chữ cái: Biểu thị loại orbital (s, p, d, f), dựa trên hình dạng của orbital.
- Số: Biểu thị số electron trong orbital đó.
Các orbital được điền electron theo thứ tự: \(1s\), \(2s\), \(2p\), \(3s\), \(3p\), \(4s\), \(3d\), \(4p\),... với các orbital s chứa tối đa 2 electron, p chứa tối đa 6 electron, d chứa tối đa 10 electron, và f chứa tối đa 14 electron.
Ký hiệu cấu hình electron được viết dưới dạng chuỗi, trong đó mỗi orbital được biểu diễn với số electron tương ứng:
Ví dụ, cấu hình electron của nguyên tử Neon (Ne) là:
\[1s^2 2s^2 2p^6\]
Cách viết này cho thấy rằng lớp vỏ 1 có 2 electron trong orbital s, và lớp vỏ 2 có 2 electron trong orbital s và 6 electron trong orbital p.
Ký hiệu cấu hình electron cũng có thể được rút gọn bằng cách sử dụng ký hiệu của các khí hiếm ở chu kỳ trước để thay thế cho các electron ở lớp vỏ trong:
Ví dụ, cấu hình electron của Natri (Na) có thể được viết đầy đủ là \[1s^2 2s^2 2p^6 3s^1\], nhưng có thể rút gọn là \[[Ne] 3s^1\], trong đó \([Ne]\) đại diện cho cấu hình của Neon.

Cấu hình electron đặc biệt
Một số nguyên tố có cấu hình electron đặc biệt so với quy tắc Aufbau chuẩn. Điều này thường xảy ra ở các nguyên tố chuyển tiếp và các nguyên tố đất hiếm, nơi mà sự ổn định của các electron trong các orbital d và f đóng vai trò quan trọng.
Các cấu hình electron đặc biệt thường xảy ra khi có sự hoán đổi giữa các electron ở các orbital khác nhau để đạt được sự ổn định năng lượng tốt hơn. Hai trường hợp phổ biến là:
- Nguyên tố Crom (Cr): Thay vì có cấu hình \([Ar] 4s^2 3d^4\), Crom lại có cấu hình \([Ar] 4s^1 3d^5\). Sự phân bố này làm cho các orbital d có 5 electron độc lập, mang lại sự ổn định cao hơn.
- Nguyên tố Đồng (Cu): Tương tự, thay vì có cấu hình \([Ar] 4s^2 3d^9\), Đồng lại có cấu hình \([Ar] 4s^1 3d^{10}\). Việc hoàn thành đầy đủ orbital d làm cho cấu hình này ổn định hơn.
Những sự thay đổi này xảy ra do các nguyên tử có xu hướng đạt được sự phân bố electron có mức năng lượng thấp nhất, ngay cả khi điều đó có nghĩa là phá vỡ một số quy tắc cơ bản.
Cấu hình electron đặc biệt có ý nghĩa quan trọng trong việc hiểu rõ hơn về tính chất hóa học và vật lý của các nguyên tố, giúp giải thích những hiện tượng mà cấu hình electron chuẩn không thể giải thích được.

Bảng tổng hợp cấu hình electron của các nguyên tố
Dưới đây là bảng tổng hợp cấu hình electron của một số nguyên tố hóa học tiêu biểu. Các nguyên tố này được chọn dựa trên tầm quan trọng trong hóa học và tính chất đặc trưng của chúng. Bảng này cung cấp thông tin về cấu hình electron cơ bản cho các nguyên tố từ Hydrogen đến Neon, cũng như các nguyên tố nặng hơn.
Bảng cấu hình electron của các nguyên tố từ Hydrogen đến Neon
| Nguyên tố | Ký hiệu hóa học | Số nguyên tử (Z) | Cấu hình electron |
|---|---|---|---|
| Hydrogen | H | 1 | 1s1 |
| Helium | He | 2 | 1s2 |
| Lithium | Li | 3 | 1s22s1 |
| Beryllium | Be | 4 | 1s22s2 |
| Boron | B | 5 | 1s22s22p1 |
| Carbon | C | 6 | 1s22s22p2 |
| Nitrogen | N | 7 | 1s22s22p3 |
| Oxygen | O | 8 | 1s22s22p4 |
| Fluorine | F | 9 | 1s22s22p5 |
| Neon | Ne | 10 | 1s22s22p6 |
Bảng cấu hình electron của các nguyên tố nặng hơn
| Nguyên tố | Ký hiệu hóa học | Số nguyên tử (Z) | Cấu hình electron |
|---|---|---|---|
| Sodium | Na | 11 | [Ne]3s1 |
| Magnesium | Mg | 12 | [Ne]3s2 |
| Aluminum | Al | 13 | [Ne]3s23p1 |
| Silicon | Si | 14 | [Ne]3s23p2 |
| Phosphorus | P | 15 | [Ne]3s23p3 |
| Sulfur | S | 16 | [Ne]3s23p4 |
| Chlorine | Cl | 17 | [Ne]3s23p5 |
| Argon | Ar | 18 | [Ne]3s23p6 |
| Potassium | K | 19 | [Ar]4s1 |
| Calcium | Ca | 20 | [Ar]4s2 |
Bảng trên tổng hợp cấu hình electron cho một số nguyên tố quan trọng, từ đó có thể dự đoán được tính chất hóa học cơ bản của các nguyên tố này. Các cấu hình electron được viết theo thứ tự phân lớp năng lượng từ thấp đến cao, giúp dễ dàng nhận biết và so sánh.