Chủ đề valence shell electron pair repulsion theory: Lý thuyết đẩy cặp electron lớp vỏ hóa trị (Valence Shell Electron Pair Repulsion Theory) giúp giải thích cách các cặp electron định hình cấu trúc phân tử. Bài viết này sẽ khám phá nguyên lý, các hình dạng phân tử phổ biến và ứng dụng thực tiễn của lý thuyết VSEPR trong hóa học hiện đại.
Mục lục
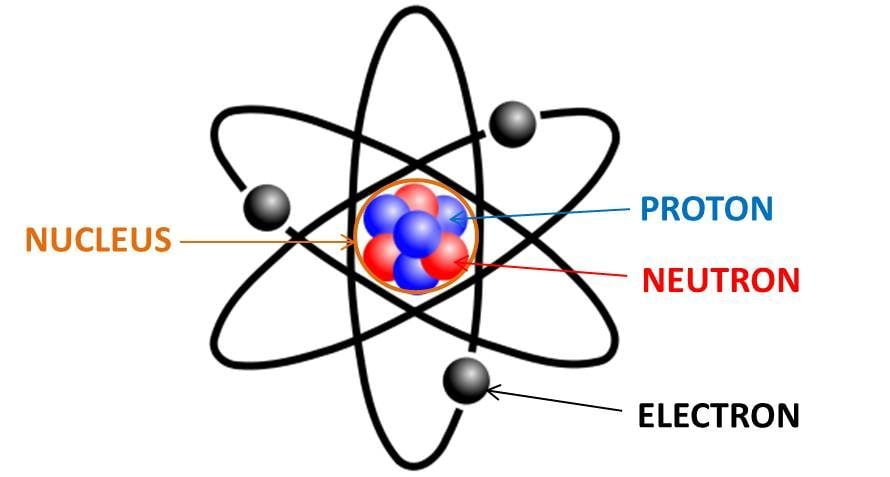
Lý Thuyết Đẩy Cặp Electron Lớp Vỏ Hóa Trị (VSEPR)
Lý thuyết đẩy cặp electron lớp vỏ hóa trị (Valence Shell Electron Pair Repulsion - VSEPR) là một lý thuyết trong hóa học giúp dự đoán hình dạng hình học của các phân tử hoặc ion dựa trên sự đẩy giữa các cặp electron hóa trị.
Nguyên Lý Cơ Bản
- Các cặp electron trong phân tử, dù là cặp liên kết hay cặp đơn, đều có xu hướng đẩy nhau để đạt được khoảng cách xa nhất có thể nhằm giảm thiểu lực đẩy và đạt trạng thái ổn định nhất.
- Số lượng các cặp electron xung quanh nguyên tử trung tâm quyết định hình dạng hình học của phân tử đó.
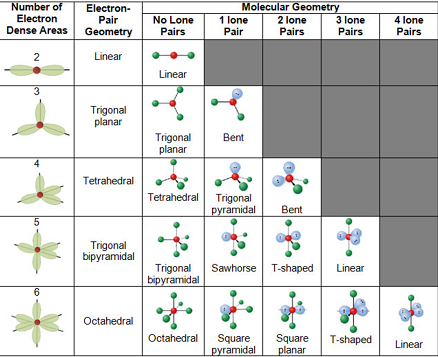
Các Hình Dạng Phân Tử Thường Gặp
| Số Nhóm Electron | Hình Học Các Nhóm Electron | Hình Dạng Phân Tử | Góc Liên Kết | Ví Dụ |
|---|---|---|---|---|
| 2 | Thẳng (linear) | Thẳng | 180° | BeF2, CO2 |
| 3 | Phẳng tam giác (trigonal planar) | Phẳng tam giác | 120° | BF3, SO3 |
| 4 | Tứ diện (tetrahedral) | Tứ diện | 109.5° | CH4, NH4+ |
| 5 | Lưỡng tháp tam giác (trigonal bipyramidal) | Lưỡng tháp tam giác | 90°, 120°, 180° | PCl5, SF4 |
| 6 | Bát diện (octahedral) | Bát diện | 90°, 180° | SF6, Mo(CO)6 |
Ký Hiệu AXE
Ký hiệu AXmEn được sử dụng để mô tả và dự đoán hình học phân tử:
- A: Nguyên tử trung tâm.
- X: Số lượng các nguyên tử liên kết với nguyên tử trung tâm.
- E: Số lượng cặp electron đơn trên nguyên tử trung tâm.
Ví dụ: Phân tử nước (H2O) có hai cặp electron đơn và hai liên kết, được ký hiệu là AX2E2, với hình dạng cong (bent).
Ứng Dụng Của Lý Thuyết VSEPR
Lý thuyết VSEPR được áp dụng rộng rãi trong hóa học để giải thích và dự đoán hình dạng của các phân tử, giúp hiểu rõ hơn về các tính chất hóa học như độ phân cực, phản ứng hóa học, và cấu trúc phân tử.

.png)
Tổng Quan Về Lý Thuyết VSEPR
Lý thuyết đẩy cặp electron lớp vỏ hóa trị (VSEPR - Valence Shell Electron Pair Repulsion) là một nguyên lý quan trọng trong hóa học, được sử dụng để dự đoán hình dạng không gian của các phân tử và ion. VSEPR dựa trên giả định rằng các cặp electron xung quanh nguyên tử trung tâm sẽ đẩy nhau để đạt được sự ổn định tối đa, từ đó xác định hình dạng của phân tử.
VSEPR giúp hiểu rõ hơn về cấu trúc không gian của các phân tử, từ đó dự đoán được tính chất hóa học và vật lý của chúng. Nguyên lý này bao gồm các bước cơ bản như sau:
- Xác định cấu hình electron của nguyên tử trung tâm: Đầu tiên, xác định số lượng electron hóa trị và cấu hình electron của nguyên tử trung tâm để hiểu rõ hơn về sự sắp xếp không gian của các cặp electron.
- Xác định số lượng nhóm electron: Nhóm electron bao gồm các cặp electron liên kết (cặp electron tham gia liên kết với các nguyên tử khác) và cặp electron đơn (không tham gia liên kết).
- Xác định hình dạng không gian: Dựa trên số lượng nhóm electron, VSEPR đưa ra các hình dạng không gian tương ứng để tối thiểu hóa lực đẩy giữa các nhóm electron. Các hình dạng này bao gồm thẳng, tam giác phẳng, tứ diện, lưỡng tháp tam giác, và bát diện.
Hình dạng của phân tử phụ thuộc vào sự phân bố của các nhóm electron xung quanh nguyên tử trung tâm, và có thể được ký hiệu bằng công thức AXE, trong đó A là nguyên tử trung tâm, X là số lượng nguyên tử liên kết, và E là số cặp electron đơn. Các hình dạng phân tử tiêu biểu được xác định bằng ký hiệu này, chẳng hạn như phân tử \(\text{AX}_2\) sẽ có hình dạng thẳng.
Nguyên Lý Hoạt Động Của VSEPR
Nguyên lý hoạt động của lý thuyết VSEPR dựa trên việc phân tích lực đẩy giữa các cặp electron trong lớp vỏ hóa trị của một nguyên tử trung tâm. Các cặp electron, bao gồm cả cặp liên kết và cặp đơn, đều có xu hướng đẩy nhau vì chúng mang điện tích âm và luôn muốn giữ khoảng cách tối đa để giảm thiểu lực đẩy.
Quá trình dự đoán hình dạng phân tử theo VSEPR được thực hiện theo các bước sau:
- Xác định cấu trúc Lewis: Trước hết, vẽ cấu trúc Lewis để xác định số lượng cặp electron xung quanh nguyên tử trung tâm, bao gồm cả các cặp liên kết và cặp đơn.
- Đếm số nhóm electron xung quanh nguyên tử trung tâm: Mỗi cặp liên kết đôi hoặc đơn và mỗi cặp đơn đều được coi là một nhóm electron. Các nhóm này bao quanh nguyên tử trung tâm.
- Xác định hình dạng hình học của phân tử: Các nhóm electron sẽ bố trí xung quanh nguyên tử trung tâm theo cách mà lực đẩy giữa chúng là nhỏ nhất. Điều này dẫn đến các hình dạng hình học phân tử đặc trưng như thẳng (linear), tam giác phẳng (trigonal planar), tứ diện (tetrahedral), lưỡng tháp tam giác (trigonal bipyramidal), và bát diện (octahedral).
Các hình dạng phân tử được dự đoán dựa trên số lượng cặp electron và sự phân bố không gian của chúng. Công thức chung được sử dụng là \(\text{AX}_m\text{E}_n\), trong đó:
- A là nguyên tử trung tâm.
- X là số lượng nguyên tử liên kết với nguyên tử trung tâm.
- E là số lượng cặp electron đơn trên nguyên tử trung tâm.
Ví dụ, nếu một phân tử có cấu trúc \(\text{AX}_2\), nó sẽ có hình dạng thẳng. Ngược lại, nếu nó có cấu trúc \(\text{AX}_3\text{E}_1\), nó sẽ có hình dạng tam giác phẳng với một góc giữa các liên kết nhỏ hơn 120° do ảnh hưởng của cặp electron đơn.

Các Hình Dạng Phân Tử Theo VSEPR
Theo lý thuyết VSEPR, hình dạng của phân tử được xác định dựa trên sự sắp xếp không gian của các nhóm electron xung quanh nguyên tử trung tâm. Các nhóm electron bao gồm cặp electron liên kết và cặp electron đơn, và chúng sẽ định hình phân tử sao cho lực đẩy giữa các cặp này là nhỏ nhất. Dưới đây là các hình dạng phân tử phổ biến theo lý thuyết VSEPR:
- Hình dạng thẳng (Linear):
Khi nguyên tử trung tâm có 2 nhóm electron, các nhóm này sẽ bố trí đối diện nhau để giảm thiểu lực đẩy, tạo thành hình dạng thẳng với góc liên kết \[180^\circ\]. Ví dụ: phân tử \(\text{CO}_2\).
- Hình dạng tam giác phẳng (Trigonal Planar):
Khi có 3 nhóm electron, các nhóm này sẽ sắp xếp trên một mặt phẳng và cách đều nhau với góc liên kết \[120^\circ\]. Ví dụ: phân tử \(\text{BF}_3\).
- Hình dạng tứ diện (Tetrahedral):
Với 4 nhóm electron, chúng sẽ phân bố theo cấu trúc tứ diện với góc liên kết \[109.5^\circ\]. Ví dụ: phân tử \(\text{CH}_4\).
- Hình dạng lưỡng tháp tam giác (Trigonal Bipyramidal):
Khi có 5 nhóm electron, hình dạng này bao gồm ba nhóm electron ở mặt phẳng giữa và hai nhóm còn lại nằm ở đỉnh của hai tháp, tạo thành góc \[120^\circ\] và \[90^\circ\]. Ví dụ: phân tử \(\text{PCl}_5\).
- Hình dạng bát diện (Octahedral):
Khi có 6 nhóm electron, chúng sẽ sắp xếp thành một cấu trúc bát diện với các góc liên kết đều bằng \[90^\circ\]. Ví dụ: phân tử \(\text{SF}_6\).
Các hình dạng trên là cơ bản nhất trong lý thuyết VSEPR và có thể biến đổi khi có các cặp electron đơn, làm thay đổi góc liên kết và hình dạng phân tử. Những biến đổi này được thể hiện qua các mô hình như hình dạng gấp khúc (bent) hay hình chữ T (T-shaped).
Ký Hiệu AXE Trong VSEPR
Ký hiệu AXE trong lý thuyết VSEPR là một công cụ hữu ích để mô tả và dự đoán hình dạng của các phân tử. Ký hiệu này bao gồm ba thành phần chính:
- A (Atom): Đại diện cho nguyên tử trung tâm trong phân tử.
- X (X-ray): Đại diện cho số lượng các nguyên tử liên kết trực tiếp với nguyên tử trung tâm.
- E (Electron): Đại diện cho số lượng cặp electron đơn (cặp electron không tham gia liên kết) xung quanh nguyên tử trung tâm.
Ký hiệu AXE giúp ta hiểu rõ hơn về cấu trúc và hình dạng của phân tử bằng cách biểu diễn số lượng và loại các nhóm electron xung quanh nguyên tử trung tâm. Ví dụ:
- \(\text{AX}_2\): Với hai nguyên tử liên kết và không có cặp electron đơn, phân tử sẽ có hình dạng thẳng.
- \(\text{AX}_3\text{E}_1\): Với ba nguyên tử liên kết và một cặp electron đơn, phân tử sẽ có hình dạng tam giác phẳng biến dạng (hình dạng chữ V).
- \(\text{AX}_4\text{E}_2\): Với bốn nguyên tử liên kết và hai cặp electron đơn, phân tử sẽ có hình dạng bát diện.
Như vậy, thông qua ký hiệu AXE, ta có thể nhanh chóng nhận biết được hình dạng không gian của một phân tử dựa trên số lượng nhóm liên kết và cặp electron đơn xung quanh nguyên tử trung tâm.

Ứng Dụng Thực Tiễn Của Lý Thuyết VSEPR
Lý thuyết đẩy cặp electron lớp vỏ hóa trị (VSEPR) không chỉ giúp chúng ta hiểu rõ về cấu trúc không gian của phân tử, mà còn có nhiều ứng dụng thực tiễn quan trọng trong các lĩnh vực khoa học và công nghệ. Dưới đây là một số ứng dụng phổ biến của lý thuyết VSEPR:
- Dự đoán hình dạng phân tử:
Lý thuyết VSEPR được sử dụng rộng rãi để dự đoán hình dạng của các phân tử trong hóa học. Việc hiểu rõ hình dạng của phân tử giúp các nhà khoa học dự đoán tính chất hóa học, phản ứng và tương tác của phân tử trong môi trường cụ thể.
- Phân tích cấu trúc trong dược phẩm:
Trong ngành dược phẩm, VSEPR giúp các nhà nghiên cứu dự đoán cách mà các phân tử thuốc sẽ tương tác với mục tiêu sinh học. Điều này rất quan trọng trong việc thiết kế thuốc hiệu quả và ít tác dụng phụ.
- Thiết kế vật liệu mới:
VSEPR hỗ trợ trong việc thiết kế các vật liệu mới với các tính chất đặc biệt bằng cách hiểu rõ cách các nguyên tử sắp xếp trong không gian. Ví dụ, các vật liệu có tính chất quang học hoặc điện tử độc đáo thường được thiết kế dựa trên hiểu biết về cấu trúc phân tử.
- Giảng dạy và nghiên cứu:
Trong giáo dục, VSEPR là một công cụ cơ bản để giảng dạy cấu trúc phân tử và liên kết hóa học. Nó cung cấp cho sinh viên một cách tiếp cận trực quan để hiểu về hình dạng và cấu trúc của các phân tử trong không gian ba chiều.
Nhờ vào lý thuyết VSEPR, các nhà khoa học có thể dự đoán và kiểm soát nhiều tính chất quan trọng của phân tử, từ đó thúc đẩy sự phát triển của nhiều ngành công nghiệp và nghiên cứu khoa học.
XEM THÊM:
Mô Phỏng Và Thực Hành VSEPR
Để hiểu rõ hơn về lý thuyết VSEPR và các hình dạng phân tử, việc mô phỏng và thực hành là rất cần thiết. Các công cụ mô phỏng trực tuyến hiện nay đã trở thành một phần không thể thiếu trong việc học và giảng dạy hóa học, đặc biệt là với lý thuyết VSEPR. Dưới đây là một số bước và công cụ bạn có thể sử dụng để thực hiện việc này.
Các Công Cụ Mô Phỏng Trực Tuyến
- PhET Interactive Simulations: Đây là một trong những công cụ phổ biến nhất được phát triển bởi Đại học Colorado Boulder. Bạn có thể sử dụng công cụ này để tạo ra các mô hình phân tử 3D dựa trên lý thuyết VSEPR. Chỉ cần chọn số lượng cặp electron liên kết và không liên kết xung quanh nguyên tử trung tâm, bạn sẽ thấy được ngay lập tức hình dạng của phân tử. Trang web:
- Molecular Workbench: Công cụ này cho phép bạn không chỉ mô phỏng hình dạng phân tử mà còn khám phá các yếu tố khác như điện tích và lực liên kết giữa các nguyên tử. Đây là một nền tảng học tập rất mạnh mẽ cho những ai muốn tìm hiểu sâu hơn về các nguyên tắc của hóa học phân tử.
- ChemCollective: Trang web này cung cấp các mô phỏng ảo cho nhiều loại thí nghiệm hóa học khác nhau, bao gồm cả các mô phỏng dựa trên lý thuyết VSEPR. Đây là một lựa chọn tuyệt vời để thực hành khi không có điều kiện tiếp cận phòng thí nghiệm thực tế.
Thực Hành VSEPR Qua Các Bài Tập
- Vẽ Cấu Trúc Lewis: Bắt đầu bằng việc vẽ cấu trúc Lewis cho phân tử mà bạn muốn tìm hiểu. Hãy đảm bảo rằng bạn đã xác định đúng số lượng cặp electron liên kết và không liên kết trên nguyên tử trung tâm.
- Xác Định Hình Dạng Phân Tử: Dựa trên số lượng cặp electron và cách chúng sắp xếp xung quanh nguyên tử trung tâm, sử dụng lý thuyết VSEPR để xác định hình dạng hình học của phân tử. Bạn có thể tham khảo bảng VSEPR để giúp quá trình này dễ dàng hơn.
- Sử Dụng Công Cụ Mô Phỏng: Sau khi xác định được hình dạng phân tử, sử dụng các công cụ mô phỏng trực tuyến để kiểm tra lại kết quả của mình. So sánh hình dạng mà bạn đã dự đoán với hình dạng hiển thị trong mô phỏng.
- Phân Tích Kết Quả: Cuối cùng, hãy phân tích xem các cặp electron không liên kết (nếu có) ảnh hưởng thế nào đến góc liên kết và độ biến dạng của phân tử. Đây là bước quan trọng giúp bạn hiểu sâu hơn về các yếu tố ảnh hưởng đến hình dạng phân tử thực tế.
Việc sử dụng các công cụ mô phỏng và bài tập thực hành không chỉ giúp bạn củng cố kiến thức lý thuyết mà còn nâng cao khả năng áp dụng vào các tình huống thực tế trong hóa học. Hãy tận dụng những nguồn tài liệu trực tuyến này để nâng cao hiệu quả học tập của bạn.