Chủ đề affinity electron: Affinity Electron là một khái niệm quan trọng trong hóa học và vật lý, thể hiện khả năng của một nguyên tử thu hút và giữ electron. Bài viết này sẽ khám phá chi tiết về ái lực electron, từ các nguyên lý cơ bản đến ứng dụng trong nghiên cứu hóa học hiện đại, giúp bạn hiểu rõ hơn về vai trò của ái lực electron trong việc xác định tính chất hóa học của các nguyên tố.
Mục lục
Khái niệm "Affinity Electron"
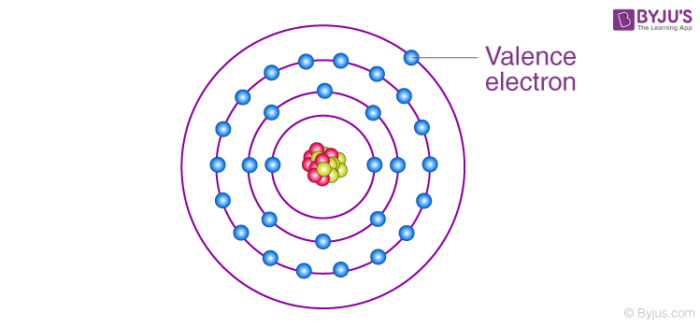
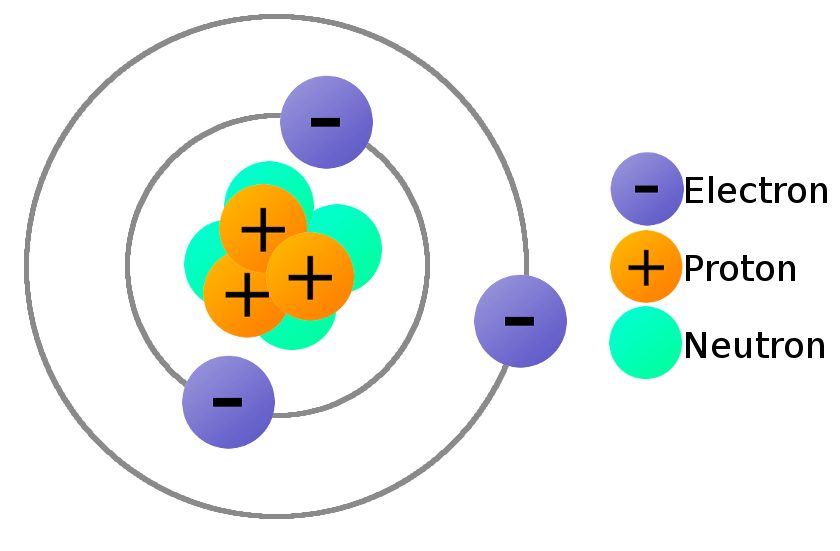
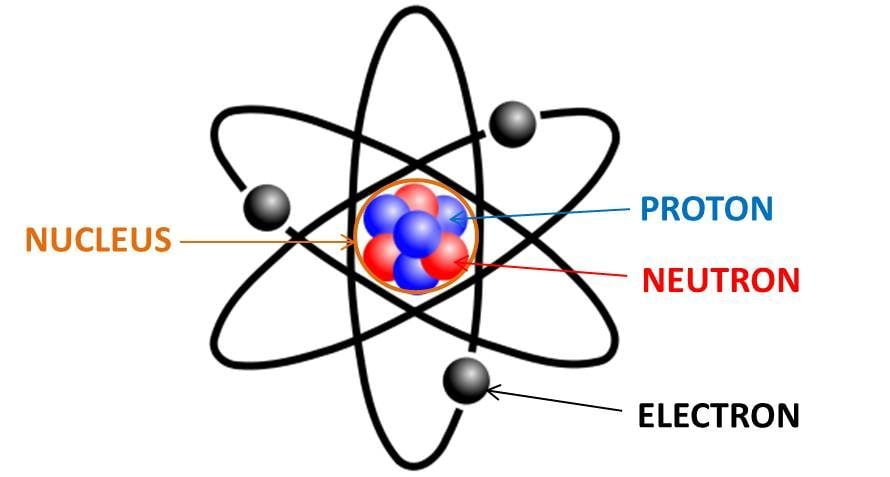
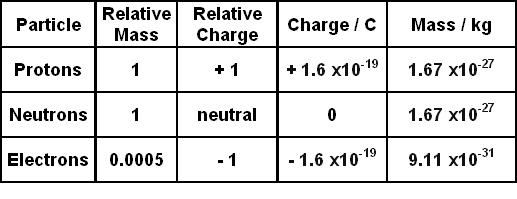
Trong lĩnh vực vật lý và hóa học, affinity electron hay ái lực electron là khái niệm miêu tả năng lượng được giải phóng khi một nguyên tử trung hòa thu nhận một electron để tạo thành ion âm.
Công thức tính
Ái lực electron được tính bằng đơn vị kJ/mol. Công thức chung là:
\[ \text{A}(X) = E(X) - E(X^-) \]
Trong đó:
- \(E(X)\) là năng lượng của nguyên tử trung hòa.
- \(E(X^-)\) là năng lượng của ion âm.
Ý nghĩa và ứng dụng
Ái lực electron giúp dự đoán tính chất hóa học của nguyên tố, hỗ trợ trong việc xác định cấu hình electron và liên kết hóa học. Các nguyên tố có ái lực electron cao thường là các phi kim có khả năng thu nhận electron để hoàn thiện cấu hình bền vững.
Ví dụ
Ví dụ, ái lực electron của nguyên tử clo (\(Cl\)) rất cao, thể hiện qua năng lượng được giải phóng khi clo thu nhận một electron để trở thành ion Cl-:
\[ \text{Cl} + e^- \rightarrow \text{Cl}^- + \text{năng lượng} \]
Các yếu tố ảnh hưởng
- Kích thước nguyên tử: Kích thước nhỏ thường làm tăng ái lực electron.
- Cấu hình electron: Các nguyên tử có cấu hình bền vững sẽ có ái lực electron thấp.
.png)
1. Khái niệm Affinity Electron
Affinity Electron, hay ái lực electron, là đại lượng biểu thị khả năng của một nguyên tử trung hòa khi thu nhận một electron để tạo thành ion âm. Quá trình này giải phóng năng lượng, được đo lường bằng đơn vị kJ/mol. Ái lực electron thường được biểu diễn qua phương trình:
\[ X(g) + e^- \rightarrow X^-(g) + \text{năng lượng} \]
Trong đó, \(X(g)\) là nguyên tử ở trạng thái khí và \(X^-(g)\) là ion âm tạo thành. Ái lực electron càng cao, nguyên tử càng dễ thu nhận electron.
2. Ứng dụng của Affinity Electron trong Hóa học
Ái lực electron đóng vai trò quan trọng trong nhiều khía cạnh của hóa học, từ dự đoán tính chất nguyên tố đến việc thiết kế các phản ứng hóa học. Dưới đây là một số ứng dụng chính:
- Dự đoán tính chất hóa học của nguyên tố: Ái lực electron giúp xác định khả năng một nguyên tử sẽ thu nhận hoặc nhường electron, qua đó ảnh hưởng đến tính chất oxi hóa-khử của nguyên tố.
- Xác định cấu hình electron: Ái lực electron giúp xác định cách mà các electron sắp xếp xung quanh hạt nhân nguyên tử, từ đó ảnh hưởng đến cấu trúc và tính chất hóa học của phân tử.
- Thiết kế phản ứng hóa học: Trong việc thiết kế các phản ứng hóa học, đặc biệt là trong tổng hợp hữu cơ, việc hiểu rõ ái lực electron của các nguyên tố giúp nhà hóa học chọn lựa các tác nhân phản ứng phù hợp để đạt được sản phẩm mong muốn.
- Nghiên cứu về vật liệu: Ái lực electron còn được sử dụng trong việc nghiên cứu và phát triển các vật liệu mới, đặc biệt là trong công nghệ pin và vật liệu siêu dẫn.

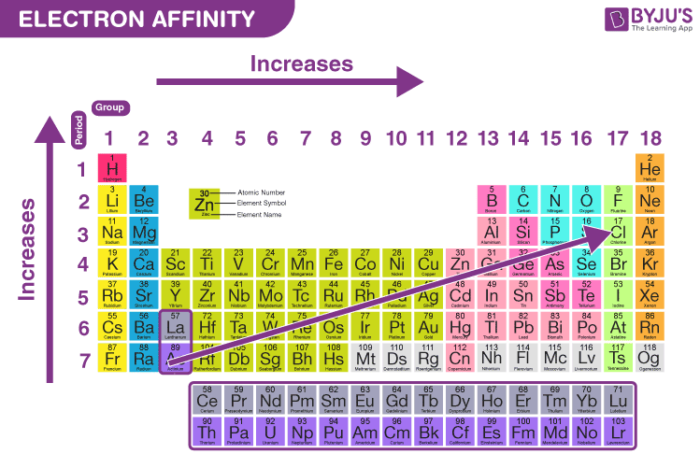
3. Các yếu tố ảnh hưởng đến Affinity Electron
Ái lực electron của một nguyên tử có thể bị ảnh hưởng bởi nhiều yếu tố, trong đó quan trọng nhất là:
- Kích thước nguyên tử: Kích thước của nguyên tử càng nhỏ, ái lực electron càng lớn, do lực hút giữa hạt nhân và electron mới càng mạnh.
- Độ âm điện: Nguyên tử có độ âm điện cao thường có ái lực electron lớn, do xu hướng thu hút electron mạnh hơn.
- Cấu hình electron: Nguyên tử có cấu hình electron bền vững thường có ái lực electron thấp hơn, vì khó thu nhận thêm electron.
- Mức năng lượng: Electron nằm ở mức năng lượng thấp hơn sẽ có ái lực electron cao hơn, vì năng lượng cần thiết để thu nhận electron ít hơn.
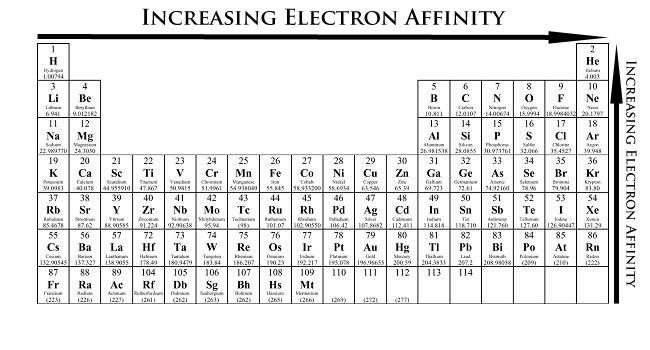
4. Ví dụ và thực hành
Dưới đây là một số ví dụ về cách tính ái lực electron và các bài tập thực hành để bạn hiểu rõ hơn về khái niệm này:
4.1. Ví dụ về Ái lực electron của Clo (Cl)
Nguyên tử Clo (\(Cl\)) thu nhận một electron để trở thành ion âm (\(Cl^-\)). Phương trình phản ứng có dạng:
\[ \text{Cl}(g) + e^- \rightarrow \text{Cl}^-(g) + \text{năng lượng} \]
Trong trường hợp này, ái lực electron của Clo có giá trị là \(-349 \, \text{kJ/mol}\), cho thấy Clo rất dễ thu nhận electron.
4.2. Bài tập thực hành
- Tính ái lực electron cho nguyên tử oxy (\(O\)) khi thu nhận một electron.
- So sánh ái lực electron của oxy với Clo và giải thích sự khác biệt.
- Xác định yếu tố nào ảnh hưởng lớn nhất đến ái lực electron trong các nguyên tử thuộc nhóm halogen.