Chủ đề electron hóa trị: Electron hóa trị là một khái niệm quan trọng trong hóa học, đóng vai trò chủ chốt trong việc xác định tính chất hóa học của các nguyên tố. Bài viết này sẽ giới thiệu chi tiết về khái niệm electron hóa trị, cách xác định chúng và ứng dụng của chúng trong thực tiễn, giúp bạn hiểu rõ hơn về chủ đề này.
Mục lục
Electron Hóa Trị: Khái Niệm và Cách Xác Định
Trong hóa học, electron hóa trị là các electron nằm ở lớp vỏ ngoài cùng của nguyên tử, có vai trò quan trọng trong việc hình thành liên kết hóa học và xác định tính chất hóa học của nguyên tố. Số lượng electron hóa trị thường được xác định dựa trên vị trí của nguyên tố trong bảng tuần hoàn.
Cách Xác Định Electron Hóa Trị
Có một số phương pháp để xác định số lượng electron hóa trị của một nguyên tố:
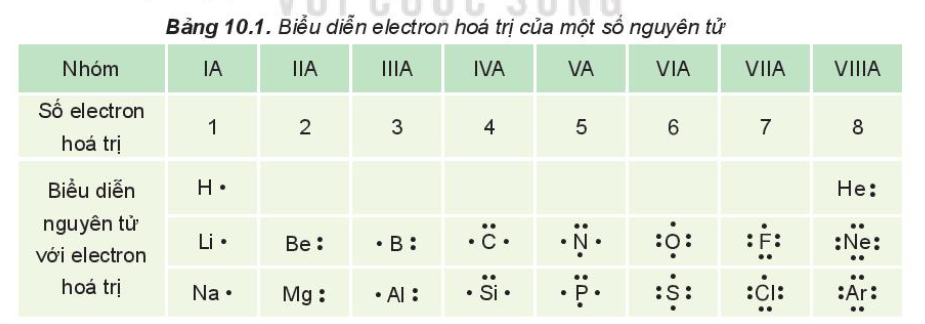
- Dựa vào bảng tuần hoàn: Đối với các nguyên tố thuộc nhóm chính (A), số lượng electron hóa trị bằng số thứ tự của nhóm.
- Dựa vào cấu hình electron: Electron hóa trị là các electron ở lớp vỏ ngoài cùng hoặc ở lớp dưới cùng nếu lớp đó chưa bão hòa. Phương pháp này phức tạp hơn đối với các nguyên tố kim loại chuyển tiếp (nhóm B).
Ví Dụ Về Electron Hóa Trị
| Nguyên Tố | Nhóm | Số Electron Hóa Trị |
|---|---|---|
| Lithium (Li) | IA | 1 |
| Beryllium (Be) | IIA | 2 |
| Carbon (C) | IVA | 4 |
| Nitrogen (N) | VA | 5 |
| Oxygen (O) | VIA | 6 |
Một Số Lưu Ý Quan Trọng
- Electron hóa trị không giống với hóa trị của nguyên tố. Hóa trị là khả năng của nguyên tử để hình thành liên kết hóa học.
- Các electron hóa trị có thể hấp thụ hoặc phát ra năng lượng dưới dạng photon.
- Electron hóa trị đóng vai trò quyết định trong việc xác định tính dẫn điện của một nguyên tố.
Việc hiểu và xác định chính xác số electron hóa trị là vô cùng quan trọng trong hóa học, giúp dự đoán và giải thích được nhiều tính chất và phản ứng hóa học.
.png)
1. Khái Niệm Electron Hóa Trị
Electron hóa trị là các electron nằm ở lớp vỏ ngoài cùng của nguyên tử, nơi chúng có khả năng tham gia vào các liên kết hóa học. Các electron này đóng vai trò quan trọng trong việc xác định tính chất hóa học của nguyên tố, như khả năng tạo liên kết, phản ứng hóa học và tính chất dẫn điện.
Trong nguyên tử, các electron được sắp xếp thành nhiều lớp, và các electron ở lớp ngoài cùng được gọi là electron hóa trị. Số lượng electron hóa trị thường tương đương với số thứ tự của nguyên tố trong bảng tuần hoàn đối với các nguyên tố nhóm A. Đối với các nguyên tố nhóm B (kim loại chuyển tiếp), việc xác định số electron hóa trị phức tạp hơn, vì nó liên quan đến cả các electron nằm ở phân lớp sát lớp ngoài cùng.
- Đối với các nguyên tố nhóm A: Số electron hóa trị thường bằng với số thứ tự của nhóm trong bảng tuần hoàn. Ví dụ, các nguyên tố thuộc nhóm IA như Na có 1 electron hóa trị, nhóm IIA như Mg có 2 electron hóa trị.
- Đối với các nguyên tố nhóm B: Số electron hóa trị có thể dao động và thường phải tính thêm các electron ở phân lớp d, ví dụ như đối với các nguyên tố kim loại chuyển tiếp.
Electron hóa trị không chỉ xác định khả năng tạo liên kết của nguyên tử mà còn ảnh hưởng đến hình dạng của phân tử và sự sắp xếp không gian của các liên kết trong phân tử đó. Khái niệm electron hóa trị là cơ sở cho việc hiểu biết về các liên kết hóa học, phản ứng hóa học và các tính chất vật lý khác của nguyên tố.
2. Cách Xác Định Electron Hóa Trị
Việc xác định số lượng electron hóa trị của một nguyên tố là rất quan trọng trong hóa học, vì nó giúp dự đoán khả năng phản ứng và tính chất hóa học của nguyên tố đó. Dưới đây là các bước cơ bản để xác định electron hóa trị:
-
Dựa vào vị trí trong bảng tuần hoàn:
Các nguyên tố trong nhóm A của bảng tuần hoàn có số electron hóa trị tương ứng với số thứ tự nhóm. Ví dụ, các nguyên tố trong nhóm IA có 1 electron hóa trị, nhóm IIA có 2 electron hóa trị.
-
Xác định dựa trên cấu hình electron:
Đối với các nguyên tố, ta cần viết cấu hình electron của nguyên tử đó để xác định lớp ngoài cùng chứa các electron hóa trị. Ví dụ, cấu hình electron của Oxy (O) là \(1s^2 2s^2 2p^4\), cho thấy Oxy có 6 electron hóa trị nằm ở lớp 2.
-
Đối với kim loại chuyển tiếp:
Việc xác định electron hóa trị phức tạp hơn vì các electron hóa trị có thể nằm ở cả phân lớp \(s\) và \(d\). Ví dụ, đối với Sắt (Fe) với cấu hình electron \( [Ar] 3d^6 4s^2\), số electron hóa trị có thể là 2 hoặc 8 tùy theo môi trường phản ứng.
Như vậy, việc xác định electron hóa trị dựa vào vị trí trong bảng tuần hoàn, cấu hình electron và tính chất đặc trưng của các nguyên tố, đặc biệt là đối với các nguyên tố kim loại chuyển tiếp, giúp chúng ta hiểu rõ hơn về tính chất và khả năng phản ứng của các nguyên tố hóa học.

3. Ví Dụ Về Electron Hóa Trị
Để hiểu rõ hơn về electron hóa trị, chúng ta sẽ xem xét một số ví dụ cụ thể liên quan đến các nguyên tố khác nhau trong bảng tuần hoàn. Các ví dụ này sẽ giúp làm rõ cách xác định số lượng electron hóa trị và vai trò của chúng trong phản ứng hóa học.
- Ví dụ 1: Nguyên tố Natri (Na)
Natri nằm ở nhóm IA của bảng tuần hoàn. Cấu hình electron của Na là \(1s^2 2s^2 2p^6 3s^1\). Như vậy, Natri có 1 electron hóa trị nằm ở phân lớp \(3s\). Electron này dễ dàng bị mất đi trong các phản ứng, tạo ra ion \(Na^+\) với cấu hình bền vững \(1s^2 2s^2 2p^6\).
- Ví dụ 2: Nguyên tố Oxy (O)
Oxy nằm ở nhóm VIA của bảng tuần hoàn với cấu hình electron là \(1s^2 2s^2 2p^4\). Oxy có 6 electron hóa trị nằm ở lớp vỏ ngoài cùng (lớp 2). Trong các phản ứng, Oxy có xu hướng nhận thêm 2 electron để hoàn thành lớp vỏ ngoài cùng, tạo thành ion \(O^{2-}\) với cấu hình bền vững \(1s^2 2s^2 2p^6\).
- Ví dụ 3: Nguyên tố Carbon (C)
Carbon nằm ở nhóm IVA của bảng tuần hoàn, với cấu hình electron \(1s^2 2s^2 2p^2\). Carbon có 4 electron hóa trị, và do đó, nó có thể tạo ra bốn liên kết cộng hóa trị, như trong phân tử \(CH_4\) (methane) hoặc \(CO_2\) (carbon dioxide).
- Ví dụ 4: Nguyên tố Sắt (Fe)
Sắt là một nguyên tố kim loại chuyển tiếp thuộc nhóm VIIIB, với cấu hình electron là \([Ar] 3d^6 4s^2\). Số electron hóa trị của Sắt có thể thay đổi tùy theo hợp chất, thường là 2 hoặc 3 electron hóa trị, dẫn đến các trạng thái oxi hóa phổ biến như \(Fe^{2+}\) và \(Fe^{3+}\).
Những ví dụ trên minh họa cách xác định electron hóa trị của các nguyên tố khác nhau và vai trò của chúng trong phản ứng hóa học, từ đó giúp hiểu rõ hơn về đặc tính hóa học của các nguyên tố.
XEM THÊM:
4. Ứng Dụng của Electron Hóa Trị
Electron hóa trị đóng vai trò quan trọng trong nhiều khía cạnh của hóa học và có nhiều ứng dụng trong cả lý thuyết và thực tiễn. Dưới đây là một số ứng dụng nổi bật của electron hóa trị:
- Dự đoán khả năng tạo liên kết hóa học:
Electron hóa trị giúp xác định cách mà các nguyên tử liên kết với nhau để tạo thành các phân tử và hợp chất. Ví dụ, số lượng electron hóa trị của nguyên tử quyết định số lượng liên kết cộng hóa trị mà nó có thể hình thành. Trong phân tử \(H_2O\) (nước), nguyên tử Oxy có 6 electron hóa trị, và nó tạo ra hai liên kết cộng hóa trị với hai nguyên tử Hydro.
- Xác định hình dạng phân tử:
VSEPR (Valence Shell Electron Pair Repulsion) là một lý thuyết dựa trên số lượng electron hóa trị để dự đoán hình dạng không gian của các phân tử. Các cặp electron hóa trị quanh nguyên tử trung tâm sẽ sắp xếp để giảm thiểu lực đẩy giữa chúng, từ đó xác định hình dạng phân tử. Ví dụ, phân tử \(CH_4\) (methane) có cấu trúc tứ diện do bốn cặp electron hóa trị tạo ra bốn liên kết với các nguyên tử Hydro.
- Ứng dụng trong phân tích phản ứng hóa học:
Trong các phản ứng hóa học, việc biết được số lượng electron hóa trị giúp dự đoán sản phẩm của phản ứng và cơ chế xảy ra. Chẳng hạn, phản ứng oxy hóa khử liên quan đến việc trao đổi electron hóa trị giữa các nguyên tử, giúp xác định chất nào bị oxy hóa và chất nào bị khử.
- Xác định tính chất điện hóa của nguyên tố:
Electron hóa trị cũng quyết định khả năng dẫn điện và nhiệt của nguyên tố. Ví dụ, kim loại có số lượng lớn electron hóa trị tự do có khả năng dẫn điện tốt, như Đồng (Cu) với một electron hóa trị.
Những ứng dụng trên cho thấy electron hóa trị là một khái niệm cốt lõi trong hóa học, không chỉ giúp hiểu sâu hơn về cấu trúc và tính chất của các nguyên tố mà còn áp dụng trong nhiều lĩnh vực khoa học và công nghệ.

5. Các Lưu Ý Khi Nghiên Cứu Electron Hóa Trị
Trong quá trình nghiên cứu về electron hóa trị, có một số điểm cần lưu ý để đảm bảo sự hiểu biết chính xác và toàn diện. Dưới đây là các lưu ý quan trọng:
- Hiểu rõ cấu hình electron:
Cấu hình electron của một nguyên tử là cơ sở để xác định số lượng electron hóa trị. Việc ghi nhớ cách sắp xếp các electron trong các phân lớp (s, p, d, f) sẽ giúp bạn xác định chính xác electron hóa trị, đặc biệt là đối với các nguyên tố chuyển tiếp.
- Lưu ý về các nguyên tố đặc biệt:
Một số nguyên tố, đặc biệt là các kim loại chuyển tiếp, có thể có nhiều hơn một trạng thái hóa trị. Ví dụ, Sắt (Fe) có thể có hóa trị 2 hoặc 3, tùy thuộc vào hợp chất mà nó tham gia. Điều này yêu cầu bạn phải chú ý đến hoàn cảnh cụ thể của nguyên tố khi xác định số electron hóa trị.
- Tương tác giữa các electron:
Các electron trong lớp vỏ nguyên tử không chỉ đơn thuần là các hạt riêng lẻ mà chúng còn tương tác với nhau. Những tương tác này có thể ảnh hưởng đến mức năng lượng và hình dạng của các orbital, do đó cần được xem xét khi nghiên cứu các tính chất hóa học của nguyên tố.
- Các trường hợp ngoại lệ:
Không phải lúc nào quy tắc cũng áp dụng một cách tuyệt đối. Một số nguyên tố có thể không tuân theo các quy tắc cơ bản do các yếu tố như hiệu ứng đa cấu hình hoặc liên kết đặc biệt. Ví dụ, trong các hợp chất của đồng (Cu), dù có cấu hình electron là \( [Ar] 3d^{10} 4s^1\), hóa trị phổ biến lại là 1.
- Vai trò của môi trường phản ứng:
Electron hóa trị có thể thay đổi tùy theo điều kiện phản ứng, như pH, nhiệt độ, và sự có mặt của các chất khác. Điều này có thể dẫn đến sự hình thành các trạng thái oxi hóa không điển hình hoặc các liên kết hóa học đặc biệt.
Việc chú ý đến các yếu tố trên sẽ giúp bạn có được một cái nhìn toàn diện và chính xác hơn khi nghiên cứu và ứng dụng khái niệm electron hóa trị trong hóa học.