Chủ đề 1 electron: 1 Electron là một hạt hạ nguyên tử với vai trò quyết định trong cấu trúc và tính chất của vật chất. Bài viết này sẽ đưa bạn vào một hành trình khám phá chi tiết về electron, từ những khái niệm cơ bản đến các ứng dụng thực tiễn trong đời sống và công nghệ, giúp bạn hiểu rõ hơn về tầm quan trọng của hạt nhỏ bé này.
Mục lục
Thông tin chi tiết về "1 electron"
Electron là một hạt hạ nguyên tử quan trọng với nhiều ứng dụng trong vật lý, hóa học và công nghệ. Dưới đây là các khía cạnh quan trọng liên quan đến khái niệm "1 electron".
1. Khái niệm cơ bản về Electron
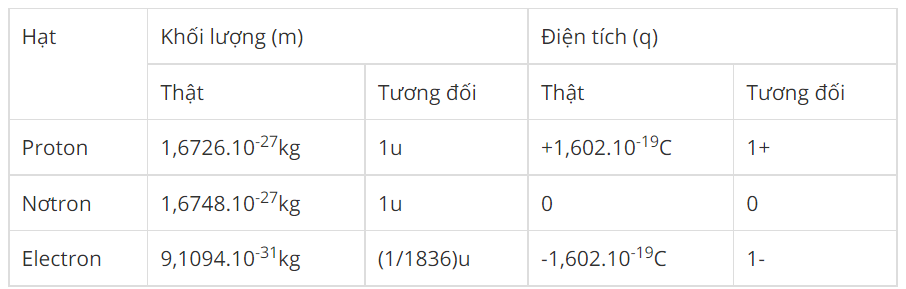
Electron là một hạt hạ nguyên tử mang điện tích âm, được ký hiệu là \(e^-\). Trong một nguyên tử, các electron quay quanh hạt nhân và sắp xếp theo các mức năng lượng khác nhau. Điện tích của electron là \(-1.6 \times 10^{-19}\) Coulomb và khối lượng của nó là khoảng \(9.11 \times 10^{-31}\) kg.
2. Cấu hình Electron
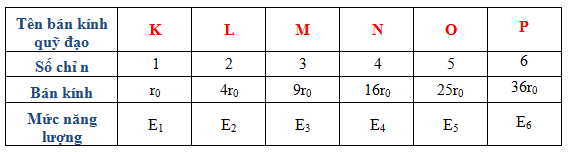
Trong các nguyên tử, electron được sắp xếp theo các mức năng lượng tăng dần. Cấu hình electron mô tả cách các electron phân bố trong các lớp và phân lớp xung quanh hạt nhân. Ví dụ, cấu hình electron của nguyên tố Natri (Z = 11) là \(1s^2 2s^2 2p^6 3s^1\).
3. Thuyết Electron và Định luật Bảo toàn Điện tích
Theo thuyết electron, các electron có thể rời khỏi nguyên tử và di chuyển, dẫn đến sự tạo thành các ion dương hoặc âm. Định luật bảo toàn điện tích khẳng định rằng tổng điện tích trong một hệ cô lập luôn được bảo toàn. Điện tích không thể được tạo ra hoặc mất đi, mà chỉ có thể chuyển từ vật này sang vật khác.
4. Ứng dụng của Electron
- Trong công nghệ: Electron đóng vai trò quan trọng trong các thiết bị điện tử như bóng đèn điện tử, máy tính, và các thiết bị viễn thông.
- Trong hóa học: Electron tham gia vào các liên kết hóa học và quyết định tính chất của các nguyên tố và hợp chất.
- Trong vật lý: Electron được sử dụng trong nhiều thí nghiệm và ứng dụng như kính hiển vi điện tử và gia tốc hạt.
5. Các hiện tượng liên quan đến Electron
- Sự nhiễm điện: Khi một vật nhiễm điện, sự dịch chuyển của electron là nguyên nhân chính tạo ra hiện tượng này.
- Hiệu ứng quang điện: Khi chiếu sáng vào bề mặt kim loại, electron có thể bị bứt ra khỏi bề mặt, tạo ra dòng điện quang.
- Hiệu ứng Compton: Sự tán xạ của photon khi va chạm với electron tự do trong vật chất, làm giảm năng lượng của photon và tăng động năng của electron.
6. Kết luận
Electron là một phần tử cơ bản trong tự nhiên, đóng vai trò then chốt trong việc xác định tính chất của vật chất. Các nghiên cứu và ứng dụng liên quan đến electron không chỉ giới hạn trong lĩnh vực khoa học mà còn mở rộng sang các ngành công nghiệp, y học, và công nghệ cao.

.png)
1. Giới thiệu về Electron
Electron là một hạt hạ nguyên tử, mang điện tích âm, và là một trong những thành phần cơ bản của nguyên tử. Điện tích của một electron được xác định là \(-1.6 \times 10^{-19}\) Coulomb, và khối lượng của nó là khoảng \(9.11 \times 10^{-31}\) kg, nhỏ hơn rất nhiều so với proton và neutron.
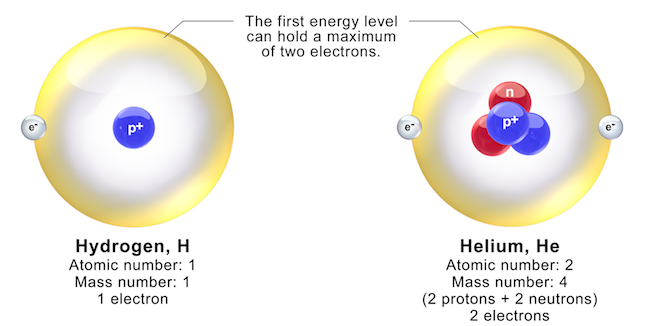
Trong nguyên tử, electron quay quanh hạt nhân, nơi chứa các proton và neutron, theo các quỹ đạo xác định. Sự phân bố của electron trong các quỹ đạo này được gọi là cấu hình electron, quyết định tính chất hóa học và vật lý của nguyên tử.
Electron không chỉ đóng vai trò quan trọng trong việc hình thành các liên kết hóa học mà còn là nền tảng của nhiều hiện tượng vật lý quan trọng như hiệu ứng quang điện, dòng điện trong chất rắn, và sự phát xạ ánh sáng trong các thiết bị điện tử. Chính vì vậy, electron là một khái niệm không thể thiếu trong cả vật lý lẫn hóa học, và có ảnh hưởng sâu rộng đến các lĩnh vực công nghệ và đời sống hiện đại.
2. Đặc điểm cơ bản của Electron
Electron là một trong những hạt cơ bản của vật chất và là thành phần quan trọng trong cấu trúc của nguyên tử. Dưới đây là một số đặc điểm cơ bản của electron:
- Điện tích: Electron mang điện tích âm với giá trị \(-1.6 \times 10^{-19}\) Coulomb. Đây là đơn vị cơ bản của điện tích âm trong các hệ thống điện tử và vật lý.
- Khối lượng: Electron có khối lượng rất nhỏ, khoảng \(9.11 \times 10^{-31}\) kg, chỉ bằng khoảng 1/1836 lần khối lượng của proton. Mặc dù khối lượng rất nhỏ, nhưng electron có động năng đáng kể khi di chuyển trong không gian.
- Quỹ đạo và cấu hình: Trong một nguyên tử, các electron quay quanh hạt nhân trong các quỹ đạo xác định, sắp xếp theo mức năng lượng từ thấp đến cao. Cấu hình electron quyết định tính chất hóa học của nguyên tử, bao gồm khả năng tạo liên kết và tính chất của các hợp chất mà nguyên tử đó tham gia.
- Nguyên lý Pauli: Mỗi electron trong một nguyên tử phải tuân theo nguyên lý loại trừ Pauli, nghĩa là không có hai electron nào trong cùng một nguyên tử có cùng bốn số lượng tử giống nhau. Điều này dẫn đến sự sắp xếp duy nhất của các electron trong các quỹ đạo khác nhau.
- Tính chất sóng-hạt: Electron có tính chất kép vừa là sóng vừa là hạt. Điều này được thể hiện qua các hiện tượng như sự giao thoa và nhiễu xạ, cũng như qua thực nghiệm khi electron được phát hiện dưới dạng các hạt trong các phép đo.
Những đặc điểm này làm cho electron trở thành một phần tử không thể thiếu trong việc giải thích các hiện tượng vật lý và hóa học, đồng thời cũng là nền tảng cho nhiều ứng dụng công nghệ hiện đại.

3. Cấu hình Electron và cách xác định
Cấu hình electron của một nguyên tử mô tả sự phân bố của các electron trong các lớp và phân lớp khác nhau xung quanh hạt nhân. Cấu hình này tuân theo một số quy tắc cơ bản để đảm bảo rằng các electron sắp xếp theo cách ổn định nhất.
3.1. Quy tắc Hund
Theo quy tắc Hund, các electron sẽ điền vào các orbital có cùng mức năng lượng (các orbital thuộc cùng một phân lớp) sao cho số electron chưa ghép cặp là lớn nhất. Điều này có nghĩa là trong mỗi phân lớp, mỗi orbital sẽ nhận một electron trước khi bất kỳ orbital nào nhận electron thứ hai.
3.2. Nguyên lý Pauli
Nguyên lý loại trừ Pauli khẳng định rằng không có hai electron nào trong cùng một nguyên tử có thể có cùng một bộ bốn số lượng tử. Điều này có nghĩa là mỗi orbital chỉ có thể chứa tối đa hai electron với spin ngược nhau.
3.3. Quy tắc Aufbau
Quy tắc Aufbau, hay còn gọi là quy tắc xây dựng, quy định rằng các electron sẽ điền vào các orbital theo thứ tự mức năng lượng tăng dần. Thứ tự này bắt đầu từ phân lớp 1s, sau đó là 2s, 2p, 3s, 3p, 4s, 3d, 4p, v.v...
3.4. Cách viết cấu hình Electron
- Xác định số electron của nguyên tử dựa trên số hiệu nguyên tử (Z).
- Điền electron vào các phân lớp theo thứ tự mức năng lượng thấp đến cao theo quy tắc Aufbau.
- Đảm bảo tuân thủ quy tắc Hund và nguyên lý Pauli khi phân bố electron trong các orbital.
Ví dụ, cấu hình electron của nguyên tử Oxy (Z = 8) được viết là \(1s^2 2s^2 2p^4\), trong đó hai electron đầu tiên chiếm phân lớp 1s, hai electron tiếp theo chiếm phân lớp 2s, và bốn electron cuối cùng phân bố vào các orbital 2p.

4. Thuyết Electron và các định luật liên quan
Thuyết electron là nền tảng quan trọng trong vật lý học, giúp giải thích các hiện tượng liên quan đến điện tích và tương tác giữa các hạt hạ nguyên tử. Dưới đây là các khía cạnh chính của thuyết electron và các định luật liên quan:
4.1. Thuyết Electron
Theo thuyết electron, các electron là các hạt mang điện tích âm, có khả năng di chuyển trong các chất dẫn điện. Khi một lực điện từ tác động lên, các electron sẽ di chuyển, tạo ra dòng điện. Thuyết này giúp hiểu rõ về bản chất của dòng điện, hiện tượng dẫn điện và các ứng dụng của nó trong cuộc sống.
4.2. Định luật Bảo toàn Điện tích
Định luật bảo toàn điện tích phát biểu rằng tổng điện tích trong một hệ cô lập luôn được bảo toàn, nghĩa là điện tích không thể được tạo ra hoặc mất đi, mà chỉ có thể chuyển từ vật này sang vật khác. Điều này đóng vai trò quan trọng trong việc giải thích các hiện tượng điện học và các phản ứng hóa học.
4.3. Định luật Coulomb
Định luật Coulomb mô tả lực tương tác giữa hai điện tích điểm. Lực này tỉ lệ thuận với tích của hai điện tích và tỉ lệ nghịch với bình phương khoảng cách giữa chúng. Công thức của định luật Coulomb là:
trong đó \(F\) là lực tác dụng, \(q_1\) và \(q_2\) là hai điện tích, \(r\) là khoảng cách giữa hai điện tích, và \(k\) là hằng số Coulomb.
4.4. Định luật Ohm
Định luật Ohm mô tả mối quan hệ giữa điện áp (U), dòng điện (I), và điện trở (R) trong một mạch điện đơn giản, được phát biểu dưới dạng:
Định luật này là cơ sở cho nhiều ứng dụng trong điện tử và kỹ thuật điện, giúp dự đoán và điều chỉnh dòng điện trong các mạch điện.
Các thuyết và định luật trên không chỉ giúp giải thích các hiện tượng tự nhiên mà còn ứng dụng rộng rãi trong công nghệ, từ thiết kế mạch điện tử đến nghiên cứu vật lý hạt nhân.

5. Ứng dụng của Electron trong đời sống
Electron đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống, từ công nghệ đến y học và năng lượng. Dưới đây là một số ứng dụng tiêu biểu của electron:
5.1. Ứng dụng trong công nghệ điện tử
Các electron là nền tảng của tất cả các thiết bị điện tử hiện đại. Chúng tham gia vào quá trình dẫn điện trong các linh kiện như diode, transistor, và vi mạch tích hợp (IC). Những thành phần này là trái tim của các thiết bị như điện thoại di động, máy tính, và tivi, giúp xử lý và truyền tải thông tin.
5.2. Ứng dụng trong y học
Electron cũng có vai trò quan trọng trong y học, đặc biệt là trong chẩn đoán hình ảnh và điều trị. Các thiết bị như máy chụp X-quang và máy chụp cắt lớp vi tính (CT) sử dụng electron để tạo ra hình ảnh chi tiết của cơ thể. Ngoài ra, các electron trong các tia electron (electron beam) được sử dụng trong liệu pháp xạ trị để tiêu diệt tế bào ung thư.
5.3. Ứng dụng trong năng lượng
Trong lĩnh vực năng lượng, electron là nhân tố quan trọng trong các quá trình sản xuất và truyền tải điện năng. Trong các nhà máy điện, electron được tạo ra từ quá trình chuyển hóa năng lượng và được truyền qua các dây dẫn để cung cấp điện cho các hộ gia đình và cơ sở công nghiệp. Pin năng lượng mặt trời cũng dựa trên nguyên tắc chuyển hóa năng lượng ánh sáng thành dòng điện tử để tạo ra điện năng.
5.4. Ứng dụng trong vật lý và nghiên cứu
Electron là một đối tượng nghiên cứu quan trọng trong vật lý, giúp khám phá các nguyên lý cơ bản của vật chất và năng lượng. Các máy gia tốc hạt, như máy gia tốc vòng (cyclotron) và máy gia tốc tuyến tính (linac), sử dụng electron để nghiên cứu cấu trúc nguyên tử và các hiện tượng lượng tử.
Những ứng dụng trên cho thấy electron không chỉ là một hạt cơ bản mà còn là nhân tố chính trong nhiều công nghệ và lĩnh vực khoa học, đóng góp to lớn vào sự phát triển của xã hội hiện đại.
XEM THÊM:
6. Các hiện tượng liên quan đến Electron
6.1. Sự nhiễm điện và vai trò của Electron
Khi một vật được cọ xát, các electron có thể bị dịch chuyển từ vật này sang vật khác, dẫn đến sự nhiễm điện. Vật bị mất electron sẽ mang điện tích dương, trong khi vật nhận thêm electron sẽ mang điện tích âm. Sự chuyển dịch này giải thích tại sao khi chúng ta chải tóc, lược có thể hút các mảnh giấy nhỏ hoặc khi ta chạm vào một bề mặt kim loại, ta có thể cảm nhận được tia điện nhẹ.
6.2. Hiệu ứng quang điện
Hiệu ứng quang điện xảy ra khi ánh sáng chiếu vào một bề mặt kim loại, làm cho các electron từ bề mặt bị giải phóng. Albert Einstein đã giải thích hiện tượng này bằng lý thuyết lượng tử ánh sáng, cho rằng mỗi photon của ánh sáng mang một lượng năng lượng xác định, và khi photon có đủ năng lượng, nó có thể bứt electron khỏi bề mặt kim loại. Đây là cơ sở cho sự phát triển của các công nghệ như pin mặt trời và cảm biến ánh sáng.
6.3. Hiệu ứng Compton
Hiệu ứng Compton là hiện tượng tán xạ của tia X hoặc tia gamma khi chúng tương tác với các electron trong một vật liệu. Khi một photon va chạm với electron, một phần năng lượng của photon được truyền cho electron, làm thay đổi hướng và năng lượng của photon. Hiệu ứng này chứng minh rằng ánh sáng có tính chất của cả sóng và hạt, và nó là một trong những hiện tượng quan trọng trong việc khẳng định thuyết lượng tử.
Những hiện tượng này không chỉ giúp chúng ta hiểu rõ hơn về bản chất của electron, mà còn ứng dụng rộng rãi trong các lĩnh vực công nghệ, vật lý và hóa học, từ việc chế tạo các thiết bị điện tử cho đến việc phát triển các công nghệ năng lượng mới.
7. Tổng kết
Electron, một hạt cơ bản trong cấu trúc của vật chất, đóng vai trò vô cùng quan trọng trong nhiều hiện tượng vật lý, hóa học và công nghệ. Từ việc tạo nên sự cân bằng điện tích trong nguyên tử, đến việc tham gia vào các hiện tượng như nhiễm điện, hiệu ứng quang điện, và hiệu ứng Compton, electron không chỉ là một phần nhỏ bé mà còn là chìa khóa để hiểu và ứng dụng những nguyên lý cơ bản của tự nhiên.
Trong suốt bài viết, chúng ta đã khám phá các đặc điểm cơ bản của electron, từ khối lượng, điện tích cho đến cấu hình và vai trò của nó trong nguyên tử. Chúng ta cũng đã nhìn thấy cách mà electron tham gia vào các định luật vật lý và ảnh hưởng lớn đến cuộc sống hàng ngày thông qua các ứng dụng trong công nghệ, hóa học và vật lý.
Từ những hiện tượng như nhiễm điện do cọ xát, hiệu ứng quang điện mà Einstein đã mô tả, đến sự tán xạ của photon trong hiệu ứng Compton, tất cả đều cho thấy sự kỳ diệu và tầm quan trọng của electron. Những kiến thức này không chỉ giúp chúng ta hiểu rõ hơn về thế giới vi mô mà còn mở ra nhiều cơ hội ứng dụng trong các lĩnh vực tiên tiến.
Cuối cùng, việc nghiên cứu về electron không chỉ dừng lại ở mức độ lý thuyết mà còn mang đến nhiều ứng dụng thực tiễn. Từ việc phát triển công nghệ bán dẫn, năng lượng mặt trời, đến các nghiên cứu tiên tiến trong lĩnh vực vật lý hạt, electron tiếp tục đóng góp vào sự phát triển của khoa học và công nghệ hiện đại. Điều này minh chứng rằng, dù nhỏ bé nhưng electron là một phần không thể thiếu trong hành trình khám phá và chinh phục tự nhiên của con người.