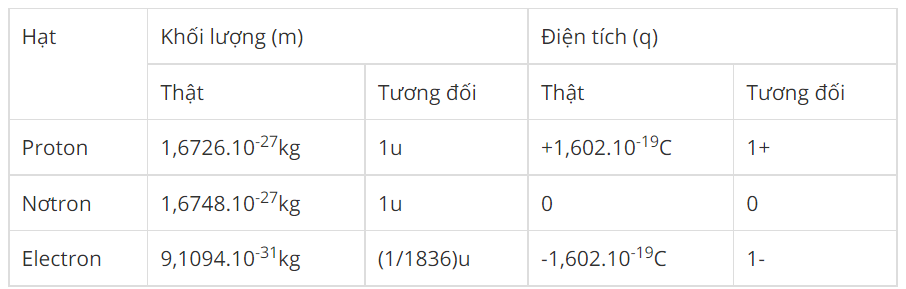
Chủ đề đặc điểm của electron lớp ngoài cùng: Đặc điểm của electron lớp ngoài cùng đóng vai trò quan trọng trong việc quyết định tính chất hóa học và vật lý của các nguyên tố. Bài viết này sẽ cung cấp cái nhìn sâu sắc về cách mà electron lớp ngoài cùng ảnh hưởng đến liên kết hóa học và phản ứng của các nguyên tử, giúp bạn hiểu rõ hơn về thế giới vi mô.
Mục lục
- Đặc điểm của Electron Lớp Ngoài Cùng
- 1. Khái niệm về Electron và Lớp Electron
- 2. Vai trò của Electron Lớp Ngoài Cùng trong Nguyên Tử
- 3. Các Tính Chất của Electron Lớp Ngoài Cùng
- 4. Vai trò của Electron Lớp Ngoài Cùng trong Phản Ứng Hóa Học
- 5. Ảnh hưởng của Electron Lớp Ngoài Cùng Đến Tính Kim Loại và Phi Kim
- 6. Sự Liên Quan Giữa Electron Lớp Ngoài Cùng và Cấu Hình Electron
- 7. Vai trò của Electron Lớp Ngoài Cùng trong Hình Thành Tính Chất Nguyên Tử
Đặc điểm của Electron Lớp Ngoài Cùng
Electron lớp ngoài cùng đóng vai trò quan trọng trong việc xác định tính chất hóa học của nguyên tử. Dưới đây là các đặc điểm quan trọng của electron lớp ngoài cùng:
1. Số lượng electron lớp ngoài cùng
Số lượng electron lớp ngoài cùng ảnh hưởng trực tiếp đến khả năng tham gia phản ứng hóa học của nguyên tử. Các nguyên tử có số lượng electron lớp ngoài cùng từ 1 đến 3 thường có xu hướng mất electron để đạt cấu hình bền vững, trong khi các nguyên tử có từ 5 đến 7 electron lớp ngoài cùng có xu hướng nhận thêm electron.
2. Vai trò trong liên kết hóa học
Electron lớp ngoài cùng quyết định kiểu liên kết mà nguyên tử có thể tạo ra. Ví dụ:
- Nếu nguyên tử có 1 hoặc 2 electron lớp ngoài cùng, nó có xu hướng tạo liên kết ion bằng cách nhường electron.
- Nếu nguyên tử có 4 hoặc 5 electron lớp ngoài cùng, nó có xu hướng tạo liên kết cộng hóa trị bằng cách chia sẻ electron.
3. Ảnh hưởng đến tính chất hóa học của nguyên tử
Vị trí của electron lớp ngoài cùng trong bảng tuần hoàn giúp xác định tính chất hóa học của nguyên tử. Ví dụ:
- Nguyên tử có electron lớp ngoài cùng ở nhóm 1 (nhóm kiềm) rất hoạt động và dễ dàng nhường electron để tạo liên kết ion.
- Nguyên tử có electron lớp ngoài cùng ở nhóm 17 (nhóm halogen) có xu hướng nhận electron để tạo liên kết ion hoặc liên kết cộng hóa trị.
4. Liên quan đến cấu hình electron
Cấu hình electron của nguyên tử cho biết sự phân bố của các electron trong các lớp và phân lớp. Electron lớp ngoài cùng là những electron có mức năng lượng cao nhất, và chúng nằm trong các lớp ngoài cùng của cấu hình electron.
5. Ảnh hưởng đến tính kim loại và phi kim
Các nguyên tố có ít electron lớp ngoài cùng thường có tính kim loại mạnh, trong khi các nguyên tố có nhiều electron lớp ngoài cùng thường có tính phi kim mạnh.
6. Cách thức tham gia phản ứng hóa học
Các electron lớp ngoài cùng dễ dàng tham gia vào các phản ứng hóa học vì chúng chịu ảnh hưởng yếu nhất từ lực hút của hạt nhân. Chúng dễ dàng bị kích thích hoặc chuyển giao trong các phản ứng hóa học.
Kết luận
Electron lớp ngoài cùng có vai trò quyết định trong việc hình thành tính chất hóa học của nguyên tử, ảnh hưởng đến cấu hình electron, khả năng phản ứng, và loại liên kết hóa học mà nguyên tử có thể tạo ra.

.png)
1. Khái niệm về Electron và Lớp Electron
Electron là hạt mang điện tích âm, có khối lượng rất nhỏ, chuyển động xung quanh hạt nhân nguyên tử. Electron là một trong những hạt cơ bản tạo nên vật chất, đóng vai trò quan trọng trong việc xác định các tính chất hóa học và vật lý của nguyên tử.
Trong nguyên tử, các electron không di chuyển một cách ngẫu nhiên mà được sắp xếp theo các lớp năng lượng xác định. Mỗi lớp electron tương ứng với một mức năng lượng khác nhau và chứa một số lượng electron nhất định.
- Lớp electron: Các lớp này được đánh số thứ tự từ 1 trở đi (K, L, M, N,...), và mỗi lớp có thể chứa một số lượng electron tối đa, xác định theo công thức \[2n^2\], trong đó \(n\) là số thứ tự của lớp.
- Electron lớp ngoài cùng: Đây là các electron nằm ở lớp ngoài cùng nhất của nguyên tử, có mức năng lượng cao nhất. Chúng đóng vai trò quyết định trong việc hình thành liên kết hóa học và phản ứng hóa học.
Vị trí và số lượng electron trong lớp ngoài cùng của một nguyên tử quyết định tính chất hóa học của nguyên tố đó, bao gồm cả khả năng phản ứng và kiểu liên kết mà nguyên tử có thể hình thành.
2. Vai trò của Electron Lớp Ngoài Cùng trong Nguyên Tử
Electron lớp ngoài cùng đóng vai trò quan trọng trong việc quyết định tính chất hóa học và vật lý của nguyên tử. Đây là những electron có mức năng lượng cao nhất, và vì vậy, chúng dễ dàng tham gia vào các phản ứng hóa học. Dưới đây là các vai trò chính của electron lớp ngoài cùng trong nguyên tử:
2.1. Quyết định khả năng liên kết hóa học
Electron lớp ngoài cùng là yếu tố quyết định nguyên tử có thể tạo ra liên kết hóa học nào:
- Nếu nguyên tử có 1 hoặc 2 electron lớp ngoài cùng, nó có xu hướng nhường electron để tạo liên kết ion với các nguyên tử khác.
- Nếu nguyên tử có 4 đến 7 electron lớp ngoài cùng, nó có xu hướng nhận electron hoặc chia sẻ electron để tạo liên kết cộng hóa trị.
- Nguyên tử có 8 electron lớp ngoài cùng (cấu hình bền vững) thường ít tham gia vào phản ứng hóa học, ví dụ như các khí hiếm.
2.2. Ảnh hưởng đến tính chất hóa học của nguyên tố
Số lượng electron lớp ngoài cùng quyết định tính chất hóa học của nguyên tố:
- Nguyên tử có ít electron lớp ngoài cùng thường có tính kim loại mạnh, dễ dàng mất electron để tạo thành ion dương.
- Nguyên tử có nhiều electron lớp ngoài cùng thường có tính phi kim mạnh, dễ dàng nhận electron để tạo thành ion âm.
2.3. Vai trò trong phản ứng hóa học
Trong các phản ứng hóa học, electron lớp ngoài cùng là những hạt tham gia trực tiếp vào quá trình trao đổi hoặc chia sẻ, từ đó hình thành liên kết hóa học mới. Điều này có nghĩa là các electron này quyết định cả tốc độ và hướng diễn ra của phản ứng hóa học.
2.4. Ảnh hưởng đến cấu trúc và hình dạng phân tử
Cách mà các electron lớp ngoài cùng phân bố xung quanh nguyên tử ảnh hưởng đến cấu trúc và hình dạng của phân tử. Các lực hút và đẩy giữa các electron lớp ngoài cùng của các nguyên tử liên kết tạo ra các hình dạng phân tử đặc trưng, từ đó ảnh hưởng đến tính chất và hoạt động của phân tử.
Tóm lại, electron lớp ngoài cùng không chỉ quyết định tính chất hóa học của nguyên tử mà còn đóng vai trò chủ chốt trong việc hình thành các liên kết hóa học và cấu trúc phân tử.

3. Các Tính Chất của Electron Lớp Ngoài Cùng
Electron lớp ngoài cùng là những electron nằm ở lớp vỏ ngoài cùng của nguyên tử, đóng vai trò quan trọng trong việc xác định tính chất hóa học và phản ứng của nguyên tố. Dưới đây là các tính chất quan trọng của electron lớp ngoài cùng:
3.1. Số lượng electron lớp ngoài cùng
Số lượng electron trong lớp ngoài cùng quyết định khả năng phản ứng của nguyên tử:
- Nguyên tử có 1 đến 3 electron lớp ngoài cùng thường có tính kim loại, dễ dàng mất electron để đạt cấu hình bền vững.
- Nguyên tử có 5 đến 7 electron lớp ngoài cùng thường có tính phi kim, dễ dàng nhận thêm electron để đạt cấu hình bền vững.
- Nguyên tử có 8 electron lớp ngoài cùng (cấu hình electron hoàn chỉnh) thường không hoạt động hóa học, ví dụ như các khí hiếm.
3.2. Năng lượng của electron lớp ngoài cùng
Electron lớp ngoài cùng có mức năng lượng cao nhất so với các electron ở các lớp bên trong:
- Vì có mức năng lượng cao, chúng dễ dàng bị kích thích hoặc bị loại ra khỏi nguyên tử trong các phản ứng hóa học.
- Trong một số trường hợp, electron lớp ngoài cùng có thể tham gia vào việc hình thành liên kết hóa học nếu nhận đủ năng lượng.
3.3. Độ âm điện và xu hướng tạo liên kết
Độ âm điện là khả năng hút electron của nguyên tử trong một liên kết hóa học, và electron lớp ngoài cùng đóng vai trò chủ yếu trong việc này:
- Nguyên tử có độ âm điện cao thường có xu hướng kéo electron về phía mình, tạo thành các liên kết cộng hóa trị hoặc liên kết ion.
- Nguyên tử có độ âm điện thấp hơn có xu hướng nhường electron, dẫn đến việc tạo thành ion dương trong liên kết ion.
3.4. Tính linh động của electron lớp ngoài cùng
Electron lớp ngoài cùng có khả năng di chuyển dễ dàng hơn trong các liên kết, đặc biệt là trong các kim loại:
- Trong các nguyên tố kim loại, electron lớp ngoài cùng có thể di chuyển tự do giữa các ion dương, tạo ra dòng điện dẫn điện.
- Trong các phân tử phi kim, electron lớp ngoài cùng thường chia sẻ giữa các nguyên tử để tạo ra các liên kết cộng hóa trị bền vững.
Các tính chất của electron lớp ngoài cùng quyết định phần lớn đến tính chất hóa học và vật lý của nguyên tử, ảnh hưởng trực tiếp đến cách mà nguyên tử tham gia vào các phản ứng hóa học và liên kết với các nguyên tử khác.

4. Vai trò của Electron Lớp Ngoài Cùng trong Phản Ứng Hóa Học
Electron lớp ngoài cùng đóng vai trò quan trọng trong các phản ứng hóa học, bởi chúng là những hạt tham gia trực tiếp vào quá trình hình thành và phá vỡ các liên kết hóa học. Dưới đây là những vai trò chính của electron lớp ngoài cùng trong phản ứng hóa học:
4.1. Hình thành liên kết hóa học
Electron lớp ngoài cùng tham gia vào việc tạo ra các loại liên kết hóa học, quyết định cách mà các nguyên tử kết hợp với nhau:
- Liên kết ion: Xảy ra khi một nguyên tử nhường electron lớp ngoài cùng của mình cho một nguyên tử khác. Ví dụ, trong phản ứng giữa natri (Na) và clo (Cl), natri nhường một electron để tạo thành ion Na\(^+\), trong khi clo nhận electron đó để tạo thành ion Cl\(^-\).
- Liên kết cộng hóa trị: Xảy ra khi các nguyên tử chia sẻ electron lớp ngoài cùng để đạt được cấu hình bền vững. Ví dụ, trong phân tử H\(_2\)O, nguyên tử oxy chia sẻ electron với hai nguyên tử hydro để tạo ra liên kết cộng hóa trị.
4.2. Quyết định tính chất của phản ứng hóa học
Electron lớp ngoài cùng không chỉ quyết định khả năng hình thành liên kết mà còn ảnh hưởng đến tính chất của phản ứng hóa học:
- Tính oxi hóa: Nguyên tử có khuynh hướng nhận electron lớp ngoài cùng sẽ có tính oxi hóa mạnh. Chẳng hạn, các nguyên tố nhóm halogen như flo (F) có khả năng nhận electron mạnh và là chất oxi hóa mạnh.
- Tính khử: Nguyên tử có khuynh hướng nhường electron lớp ngoài cùng sẽ có tính khử mạnh. Ví dụ, kim loại kiềm như natri (Na) có khả năng nhường electron dễ dàng, là chất khử mạnh.
4.3. Ảnh hưởng đến tốc độ phản ứng
Vị trí và số lượng electron lớp ngoài cùng cũng ảnh hưởng đến tốc độ của các phản ứng hóa học:
- Nguyên tử có electron lớp ngoài cùng dễ bị kích thích sẽ phản ứng nhanh hơn, đặc biệt trong các phản ứng cần năng lượng thấp để phá vỡ liên kết.
- Trong các phản ứng cộng hóa trị, sự phân bố của electron lớp ngoài cùng quyết định độ bền vững của liên kết, từ đó ảnh hưởng đến tốc độ phản ứng.
4.4. Vai trò trong phản ứng oxi hóa - khử
Electron lớp ngoài cùng là yếu tố quyết định trong các phản ứng oxi hóa - khử, nơi xảy ra sự trao đổi electron:
- Trong quá trình oxi hóa, nguyên tử mất electron lớp ngoài cùng và trở thành ion dương.
- Trong quá trình khử, nguyên tử nhận electron vào lớp ngoài cùng và trở thành ion âm.
- Ví dụ, trong phản ứng giữa sắt (Fe) và oxi (O\(_2\)), sắt bị oxi hóa mất electron, trong khi oxi bị khử nhận electron.
Như vậy, electron lớp ngoài cùng không chỉ quyết định khả năng phản ứng của nguyên tử mà còn ảnh hưởng sâu sắc đến bản chất và tốc độ của phản ứng hóa học.

5. Ảnh hưởng của Electron Lớp Ngoài Cùng Đến Tính Kim Loại và Phi Kim
Electron lớp ngoài cùng đóng vai trò quan trọng trong việc xác định tính chất kim loại và phi kim của một nguyên tố. Các nguyên tử có số lượng electron khác nhau ở lớp ngoài cùng sẽ thể hiện các tính chất hóa học và vật lý khác nhau, ảnh hưởng trực tiếp đến tính chất của nguyên tố đó.
5.1. Tính kim loại và số lượng electron lớp ngoài cùng
Tính kim loại của một nguyên tố phụ thuộc nhiều vào số lượng electron có mặt ở lớp ngoài cùng:
- Kim loại: Các nguyên tử có từ 1 đến 3 electron ở lớp ngoài cùng thường có xu hướng nhường electron để đạt được cấu hình electron bền vững hơn. Điều này làm cho chúng trở thành các nguyên tố kim loại, với tính chất dễ bị oxi hóa và dẫn điện tốt. Ví dụ, các nguyên tố như natri (Na) và canxi (Ca) đều có số lượng electron ngoài cùng là 1 và 2, lần lượt, và đều thể hiện tính kim loại mạnh.
5.2. Tính phi kim và số lượng electron lớp ngoài cùng
Ngược lại, các nguyên tử có từ 5 đến 7 electron ở lớp ngoài cùng thường có xu hướng nhận thêm electron để hoàn thiện cấu hình octet:
- Phi kim: Các nguyên tử này có xu hướng nhận electron để đạt trạng thái ổn định với 8 electron ở lớp ngoài cùng. Điều này làm cho chúng trở thành các nguyên tố phi kim, có tính chất ít dẫn điện và dễ dàng tạo liên kết cộng hóa trị. Ví dụ, các nguyên tố như oxy (O) và fluor (F) có 6 và 7 electron ở lớp ngoài cùng, và đều thể hiện tính phi kim mạnh.
Như vậy, số lượng electron ở lớp ngoài cùng là yếu tố quyết định tính kim loại hay phi kim của nguyên tố. Nguyên tử với 4 electron ở lớp ngoài cùng có thể biểu hiện cả hai tính chất, tùy thuộc vào hoàn cảnh cụ thể.
XEM THÊM:
6. Sự Liên Quan Giữa Electron Lớp Ngoài Cùng và Cấu Hình Electron
Electron lớp ngoài cùng đóng vai trò quyết định trong việc hình thành tính chất hóa học của một nguyên tử. Để hiểu rõ hơn về mối quan hệ giữa electron lớp ngoài cùng và cấu hình electron, chúng ta cần nắm vững một số nguyên tắc cơ bản về cấu hình electron.
6.1. Mối quan hệ giữa cấu hình electron và tính chất hóa học
Cấu hình electron của một nguyên tử mô tả cách các electron được sắp xếp trên các lớp và phân lớp xung quanh hạt nhân. Electron lớp ngoài cùng là những electron ở lớp năng lượng cao nhất (lớp ngoài cùng), và chính chúng quyết định tính chất hóa học của nguyên tử.
- Các nguyên tử có từ 1 đến 3 electron lớp ngoài cùng thường là kim loại và dễ dàng nhường electron để tạo ra các ion dương.
- Ngược lại, các nguyên tử có từ 5 đến 7 electron lớp ngoài cùng có xu hướng nhận thêm electron để đạt được cấu hình bền vững, thường là các nguyên tố phi kim.
- Các nguyên tử có 4 electron lớp ngoài cùng có thể là kim loại hoặc phi kim, tùy thuộc vào hoàn cảnh cụ thể.
Điều này cho thấy, chỉ cần biết cấu hình electron, đặc biệt là của lớp ngoài cùng, chúng ta có thể dự đoán được tính chất hóa học cơ bản của nguyên tố đó.
6.2. Cấu hình electron và mức năng lượng của electron lớp ngoài cùng
Thứ tự sắp xếp các electron trong nguyên tử tuân theo nguyên tắc năng lượng tăng dần, nghĩa là các electron sẽ lấp đầy các mức năng lượng thấp trước khi chuyển sang các mức cao hơn. Cấu hình electron cũng phản ánh sự phân bố này và ảnh hưởng đến mức năng lượng của electron lớp ngoài cùng.
Thứ tự điền electron vào các phân lớp tuân theo dãy: \(1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p...\) Điều này có nghĩa là mức năng lượng của các lớp electron không phải lúc nào cũng tăng đều từ lớp trong ra ngoài, mà có sự xen kẽ giữa các phân lớp.
Khi xét cấu hình electron, các nguyên tố có cấu hình electron ổn định thường có mức năng lượng thấp hơn và ít tham gia vào phản ứng hóa học. Ví dụ, các nguyên tố khí hiếm có 8 electron ở lớp ngoài cùng (trừ He) và thường không phản ứng vì cấu hình của chúng đã bền vững.
Như vậy, mối liên hệ giữa electron lớp ngoài cùng và cấu hình electron không chỉ ảnh hưởng đến tính chất hóa học mà còn đến mức năng lượng và độ ổn định của nguyên tử.

7. Vai trò của Electron Lớp Ngoài Cùng trong Hình Thành Tính Chất Nguyên Tử
Electron lớp ngoài cùng, hay còn gọi là electron hóa trị, đóng vai trò quan trọng trong việc xác định các tính chất hóa học và vật lý của nguyên tử. Điều này bao gồm khả năng phản ứng của nguyên tố, tính kim loại hoặc phi kim, và cách nguyên tố này tương tác với các nguyên tố khác.
7.1. Sự quyết định tính chất của nguyên tử
Electron lớp ngoài cùng quyết định cách mà nguyên tử tham gia vào các phản ứng hóa học. Chúng xác định khả năng nguyên tử mất, nhận, hoặc chia sẻ electron để đạt đến cấu hình electron ổn định, thường là cấu hình của khí hiếm. Các nguyên tử với số lượng electron lớp ngoài cùng ít (thường là 1 hoặc 2 electron) dễ dàng mất electron và trở thành cation, trong khi các nguyên tử có 5, 6 hoặc 7 electron lớp ngoài cùng có xu hướng nhận thêm electron để trở thành anion.
Một ví dụ điển hình là natri (Na) với một electron lớp ngoài cùng dễ dàng mất đi electron này để hình thành ion Na+. Ngược lại, chlorine (Cl) với bảy electron ở lớp ngoài cùng thường nhận thêm một electron để đạt được cấu hình ổn định, hình thành ion Cl-.
7.2. Ảnh hưởng đến đặc tính hóa học và vật lý
Electron lớp ngoài cùng không chỉ quyết định tính chất hóa học mà còn ảnh hưởng đến các tính chất vật lý của nguyên tố, như độ dẫn điện, độ cứng, và điểm nóng chảy. Ví dụ, kim loại có xu hướng có ít electron hóa trị, điều này cho phép các electron di chuyển tự do giữa các nguyên tử, tạo ra tính dẫn điện và dẫn nhiệt cao. Trong khi đó, các phi kim, với nhiều electron hóa trị, có xu hướng chia sẻ hoặc nhận electron, tạo ra các liên kết cộng hóa trị mạnh và làm cho chúng ít dẫn điện hơn.
Cấu hình electron cũng quyết định khả năng liên kết giữa các nguyên tử. Liên kết ion được hình thành khi có sự chuyển giao hoàn toàn electron từ nguyên tử này sang nguyên tử khác, trong khi liên kết cộng hóa trị xảy ra khi các nguyên tử chia sẻ electron với nhau để đạt được cấu hình ổn định.
Như vậy, electron lớp ngoài cùng không chỉ là yếu tố quyết định trong các phản ứng hóa học mà còn là nền tảng hình thành các đặc tính vật lý và hóa học của nguyên tử, từ đó ảnh hưởng đến cách mà các nguyên tố tương tác và tồn tại trong tự nhiên.