Chủ đề khối lượng 1 electron: Khối lượng 1 electron là một khái niệm quan trọng trong vật lý và hóa học, ảnh hưởng lớn đến các nguyên tử và phân tử. Trong bài viết này, chúng tôi sẽ khám phá chi tiết về khối lượng của electron, so sánh với các hạt cơ bản khác và ứng dụng của nó trong các lĩnh vực công nghệ hiện đại.
Mục lục
Khối lượng của Electron
Electron là một trong những hạt cơ bản cấu tạo nên nguyên tử. Với khối lượng rất nhỏ, electron đóng vai trò quan trọng trong các phản ứng hóa học và cấu trúc nguyên tử.
Giá trị khối lượng của Electron
Khối lượng của một electron được xác định là:
\[
m_e = 9.1094 \times 10^{-31} \, \text{kg}
\]
Khối lượng này nhỏ hơn rất nhiều so với khối lượng của proton và neutron, các hạt cấu tạo nên hạt nhân của nguyên tử.
Vai trò của Electron trong Nguyên tử
Electron di chuyển xung quanh hạt nhân trong các quỹ đạo hoặc mức năng lượng khác nhau. Chúng không chỉ quyết định tính chất hóa học của nguyên tố mà còn ảnh hưởng đến các liên kết hóa học giữa các nguyên tử.
Ứng dụng của Khối lượng Electron
Khối lượng của electron là một yếu tố quan trọng trong các tính toán vật lý và hóa học. Nó được sử dụng để tính toán năng lượng của các mức quỹ đạo, xác định cấu trúc nguyên tử và nhiều ứng dụng trong công nghệ hiện đại như điện tử và máy tính.
Bảng Khối lượng của Các Hạt Cơ Bản
| Hạt | Khối lượng (kg) |
|---|---|
| Electron | \(9.1094 \times 10^{-31}\) |
| Proton | \(1.6726 \times 10^{-27}\) |
| Neutron | \(1.6749 \times 10^{-27}\) |
Kết luận
Khối lượng của electron tuy nhỏ nhưng rất quan trọng trong việc xác định tính chất của các nguyên tố và phản ứng hóa học. Hiểu rõ khối lượng này giúp chúng ta nắm bắt tốt hơn về cấu trúc vật chất và ứng dụng trong nhiều lĩnh vực khoa học và công nghệ.

.png)
1. Khái niệm cơ bản về Electron
Electron là một hạt cơ bản trong vật lý, đóng vai trò quan trọng trong cấu trúc và hoạt động của nguyên tử. Được khám phá lần đầu vào năm 1897 bởi nhà vật lý người Anh J.J. Thomson, electron là thành phần cấu tạo của mọi nguyên tử, cùng với proton và neutron.
- Định nghĩa: Electron là hạt mang điện tích âm, với giá trị điện tích \(-1.602 \times 10^{-19}\) Coulombs. Đây là điện tích nhỏ nhất có thể tồn tại trong tự nhiên và là một trong những hằng số cơ bản của vật lý.
- Khối lượng: Khối lượng của electron là rất nhỏ so với các hạt khác như proton và neutron. Giá trị chính xác của khối lượng electron là \[9.1094 \times 10^{-31}\] kg. Mặc dù nhỏ, nhưng khối lượng này rất quan trọng trong việc xác định tính chất của nguyên tử.
- Vị trí trong nguyên tử: Electron di chuyển quanh hạt nhân nguyên tử trong các quỹ đạo hoặc lớp năng lượng. Chúng không chỉ tạo nên tính chất hóa học của nguyên tố mà còn quyết định tính dẫn điện và tính từ của vật liệu.
- Tính chất: Electron có các tính chất cơ bản như spin (một dạng mômen động lượng) và khối lượng nghỉ. Spin của electron là \(\frac{1}{2}\), làm cho nó trở thành một fermion theo phân loại hạt cơ bản.
Hiểu biết về electron là cơ sở để nghiên cứu sâu hơn về vật lý nguyên tử và hóa học, đồng thời mở ra nhiều ứng dụng quan trọng trong khoa học và công nghệ.
2. Khối lượng của Electron
Khối lượng của electron là một trong những đại lượng vật lý cơ bản quan trọng nhất, ảnh hưởng đến nhiều hiện tượng trong cả vật lý và hóa học. Dưới đây là các thông tin chi tiết về khối lượng của electron:
- Giá trị khối lượng: Khối lượng của một electron là rất nhỏ, được xác định chính xác là \[9.1094 \times 10^{-31}\] kg. Giá trị này nhỏ hơn nhiều so với khối lượng của các hạt khác như proton (\(1.6726 \times 10^{-27}\) kg) và neutron (\(1.6749 \times 10^{-27}\) kg).
- Phương pháp xác định khối lượng: Khối lượng của electron được xác định thông qua các thí nghiệm trong phòng thí nghiệm, sử dụng các công cụ hiện đại như bẫy ion và phổ kế khối lượng. Các phương pháp này giúp đo đạc chính xác khối lượng của electron với sai số rất nhỏ.
- Tầm quan trọng: Mặc dù khối lượng của electron rất nhỏ, nhưng nó đóng vai trò quyết định trong các hiện tượng vật lý và hóa học. Chẳng hạn, trong các phản ứng hóa học, sự chuyển động của electron giữa các nguyên tử là yếu tố quyết định sự hình thành hoặc phá vỡ liên kết hóa học.
- So sánh với các hạt khác: Khi so sánh với proton và neutron, electron có khối lượng nhỏ hơn rất nhiều, chỉ bằng khoảng \(\frac{1}{1836}\) lần khối lượng của proton. Điều này giải thích tại sao electron có thể chuyển động nhanh quanh hạt nhân mà không bị rơi vào trong.
Việc hiểu rõ khối lượng của electron không chỉ giúp nắm bắt các khái niệm cơ bản về cấu trúc nguyên tử mà còn mở ra các ứng dụng quan trọng trong công nghệ và khoa học hiện đại.

3. Vai trò của Electron trong cấu trúc nguyên tử
Electron là thành phần không thể thiếu trong cấu trúc nguyên tử, đóng vai trò quyết định trong nhiều hiện tượng vật lý và hóa học. Vai trò của electron trong cấu trúc nguyên tử được thể hiện qua các khía cạnh sau:
- Vị trí của Electron: Electron di chuyển xung quanh hạt nhân nguyên tử trong các quỹ đạo xác định hoặc đám mây electron. Các quỹ đạo này không cố định mà thay đổi theo mức năng lượng của electron. Các electron nằm càng xa hạt nhân thì năng lượng của chúng càng lớn.
- Tính chất hóa học của Nguyên tử: Số lượng electron trong lớp vỏ ngoài cùng của nguyên tử quyết định tính chất hóa học của nguyên tố. Các electron ở lớp vỏ ngoài cùng này tham gia vào các phản ứng hóa học và quyết định khả năng kết hợp với các nguyên tử khác.
- Liên kết hóa học: Electron đóng vai trò quan trọng trong việc hình thành các liên kết hóa học giữa các nguyên tử. Có hai loại liên kết chính là liên kết ion và liên kết cộng hóa trị, đều dựa trên sự trao đổi hoặc chia sẻ electron giữa các nguyên tử.
- Ảnh hưởng đến tính chất vật lý: Sự phân bố electron trong các quỹ đạo ảnh hưởng trực tiếp đến các tính chất vật lý của nguyên tử như độ âm điện, năng lượng ion hóa và độ phân cực. Chúng cũng đóng vai trò quan trọng trong các tính chất từ tính và dẫn điện của vật liệu.
- Nguyên lý Pauli và Cấu hình Electron: Nguyên lý Pauli quy định rằng không có hai electron nào trong cùng một nguyên tử có thể có cùng một tập hợp các số lượng tử. Điều này dẫn đến việc hình thành các cấu hình electron, từ đó xác định tính chất của nguyên tử và phân tử.
Nhìn chung, electron là yếu tố cốt lõi trong việc hiểu cấu trúc nguyên tử và các phản ứng hóa học. Hiểu biết về vai trò của electron giúp chúng ta nắm bắt được các nguyên lý cơ bản của khoa học và công nghệ hiện đại.

4. Ứng dụng của Electron trong công nghệ
Electron không chỉ là một hạt cơ bản trong vật lý mà còn có nhiều ứng dụng quan trọng trong công nghệ hiện đại. Dưới đây là các ứng dụng chính của electron trong các lĩnh vực công nghệ:
- Điện tử và Máy tính: Electron là nền tảng của các thiết bị điện tử, từ bóng bán dẫn đến mạch tích hợp. Sự chuyển động của electron trong các mạch điện tạo ra dòng điện, giúp vận hành các thiết bị như máy tính, điện thoại di động và các thiết bị điện tử khác.
- Viễn thông: Trong các hệ thống viễn thông, tín hiệu được truyền tải thông qua sự di chuyển của electron trong các dây dẫn và cáp quang. Các electron trong dây dẫn chịu trách nhiệm truyền tải thông tin từ điểm này đến điểm khác một cách nhanh chóng và hiệu quả.
- Công nghệ Y tế: Electron được sử dụng trong nhiều thiết bị y tế, chẳng hạn như máy quét MRI và máy X-quang. Các thiết bị này sử dụng electron để tạo ra hình ảnh bên trong cơ thể, giúp chẩn đoán và điều trị bệnh một cách chính xác.
- Thiết bị điện tử gia dụng: Nhiều thiết bị điện tử gia dụng như TV, lò vi sóng và tủ lạnh hoạt động dựa trên nguyên lý chuyển động của electron. Chẳng hạn, trong màn hình TV, electron được phóng từ súng electron để tạo ra hình ảnh trên màn hình.
- Công nghệ Năng lượng: Trong các tấm pin năng lượng mặt trời, electron được kích thích bởi ánh sáng mặt trời để tạo ra dòng điện, giúp chuyển đổi năng lượng mặt trời thành điện năng sử dụng. Đây là một trong những ứng dụng quan trọng nhất của electron trong công nghệ năng lượng tái tạo.
- Công nghiệp Nặng: Electron được sử dụng trong các quy trình công nghiệp, chẳng hạn như hàn điện, nơi electron giúp tạo ra nhiệt để kết nối các kim loại với nhau. Electron cũng được sử dụng trong quá trình điện phân để chiết xuất kim loại từ quặng.
Nhờ vào các ứng dụng này, electron đã và đang tiếp tục đóng góp to lớn vào sự phát triển của công nghệ, mang lại nhiều tiện ích và cải thiện chất lượng cuộc sống của con người.

5. Các phương pháp đo lường và tính toán liên quan đến Electron
Việc đo lường và tính toán các thuộc tính của electron là một phần quan trọng trong nghiên cứu vật lý và hóa học. Dưới đây là các phương pháp chính được sử dụng để đo lường và tính toán liên quan đến electron:
- Phương pháp đo khối lượng electron: Khối lượng của electron được xác định bằng cách sử dụng các phương pháp tiên tiến như cân vi mô hoặc phổ kế khối lượng. Phổ kế khối lượng sử dụng nguyên lý chuyển động của electron trong từ trường để đo lường khối lượng của chúng với độ chính xác cao.
- Phương pháp xác định điện tích electron: Điện tích của electron được đo bằng phương pháp giọt dầu Millikan. Trong thí nghiệm này, các giọt dầu được treo trong không khí giữa hai điện cực và điện tích của chúng được xác định thông qua cân bằng giữa lực điện và lực trọng trường.
- Phương pháp tính toán năng lượng của electron: Năng lượng của electron trong các quỹ đạo nguyên tử được tính toán dựa trên mô hình cơ học lượng tử. Các phương trình Schrödinger được sử dụng để xác định các mức năng lượng khác nhau mà electron có thể chiếm giữ trong nguyên tử.
- Sử dụng phổ quang học để xác định cấu hình electron: Phổ quang học của nguyên tử cung cấp thông tin về cấu hình electron thông qua các vạch quang phổ. Các vạch này xuất hiện do sự chuyển đổi giữa các mức năng lượng của electron, và chúng giúp xác định cấu trúc electron của nguyên tử.
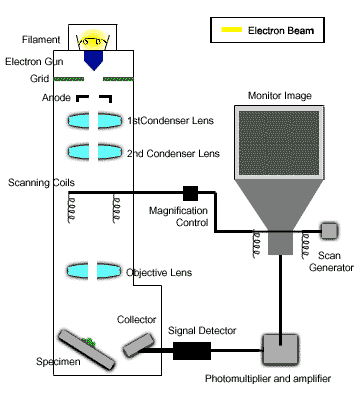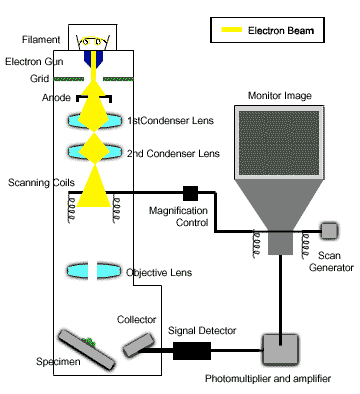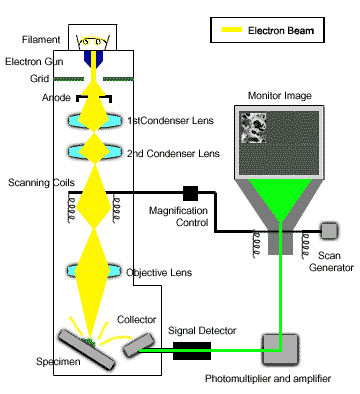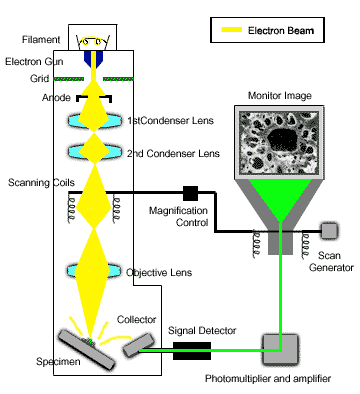
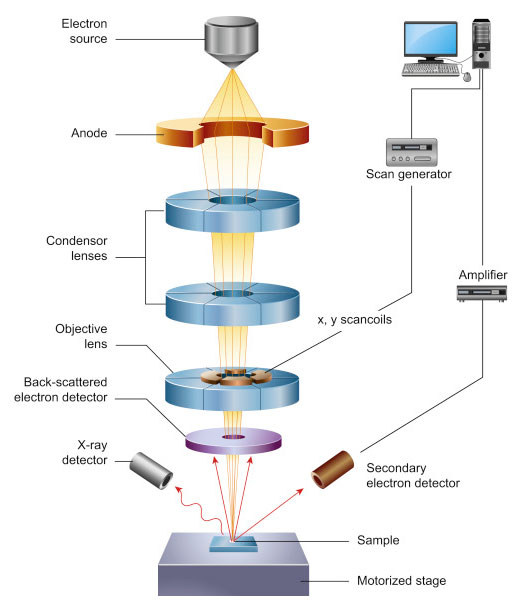
- Phương pháp sử dụng kính hiển vi điện tử: Kính hiển vi điện tử sử dụng một chùm electron để tạo ra hình ảnh có độ phân giải cao của mẫu vật. Phương pháp này không chỉ giúp quan sát cấu trúc vật liệu ở cấp độ nguyên tử mà còn cung cấp thông tin về tính chất điện tử của chúng.
Nhờ các phương pháp đo lường và tính toán này, các nhà khoa học có thể nghiên cứu và hiểu sâu hơn về electron và các hiện tượng liên quan, từ đó mở rộng kiến thức về thế giới vi mô và ứng dụng vào thực tiễn.
XEM THÊM:
6. Kết luận
Khối lượng của electron, mặc dù rất nhỏ bé với giá trị chỉ khoảng \(9.1094 \times 10^{-31} \, \text{kg}\), lại đóng vai trò vô cùng quan trọng trong việc hình thành và duy trì cấu trúc của nguyên tử. Hiểu rõ về khối lượng và vai trò của electron không chỉ giúp chúng ta giải thích được những hiện tượng cơ bản trong vật lý và hóa học mà còn mở ra những ứng dụng tiên tiến trong công nghệ và đời sống.
Trước hết, việc nghiên cứu về electron và khối lượng của nó đã góp phần quan trọng trong việc phát triển các lĩnh vực khoa học hiện đại. Nhờ vào những phát hiện này, chúng ta có thể hiểu rõ hơn về cấu trúc nguyên tử, cơ chế hình thành các liên kết hóa học, và từ đó thiết kế ra các vật liệu mới với tính năng ưu việt.
Thêm vào đó, những kiến thức về khối lượng của electron còn được áp dụng rộng rãi trong công nghệ, đặc biệt là trong ngành điện tử và máy tính. Các thiết bị điện tử ngày nay, từ máy tính đến điện thoại di động, đều dựa trên nguyên lý hoạt động của các electron trong mạch điện và các linh kiện bán dẫn. Hiểu biết sâu sắc về đặc tính của electron giúp các kỹ sư và nhà khoa học cải tiến và tối ưu hóa các công nghệ này, đáp ứng nhu cầu ngày càng cao của xã hội hiện đại.
Cuối cùng, nghiên cứu về electron không chỉ dừng lại ở những lý thuyết khô khan mà còn có nhiều ứng dụng thực tiễn trong đời sống hàng ngày. Từ việc phát triển năng lượng tái tạo, như năng lượng mặt trời và pin nhiên liệu, cho đến việc cải tiến các quy trình sản xuất trong công nghiệp, tất cả đều có sự đóng góp không nhỏ từ những hiểu biết về electron.
Tóm lại, việc hiểu rõ về khối lượng của electron không chỉ là nền tảng cho các nghiên cứu khoa học mà còn là chìa khóa mở ra những ứng dụng hữu ích trong công nghệ và đời sống. Chính nhờ vào những nghiên cứu này, chúng ta có thể tiếp tục tiến xa hơn trên con đường khám phá và chinh phục những bí ẩn của vũ trụ.