Chủ đề valence electron: Valence electron là yếu tố then chốt quyết định tính chất hóa học của các nguyên tố. Bài viết này sẽ cung cấp cái nhìn toàn diện về electron hóa trị, cách xác định và vai trò của chúng trong các phản ứng hóa học, giúp bạn hiểu rõ hơn về thế giới vi mô đầy thú vị này.
Mục lục
Electron Hóa Trị (Valence Electron)
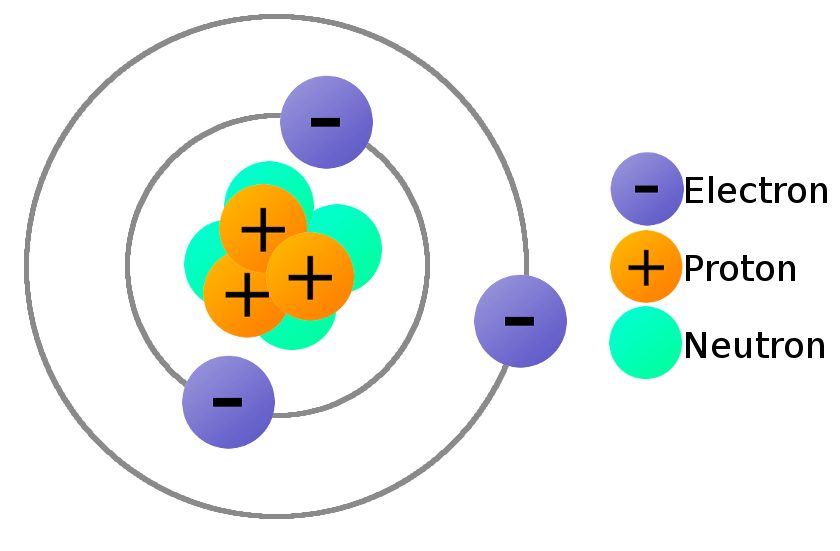
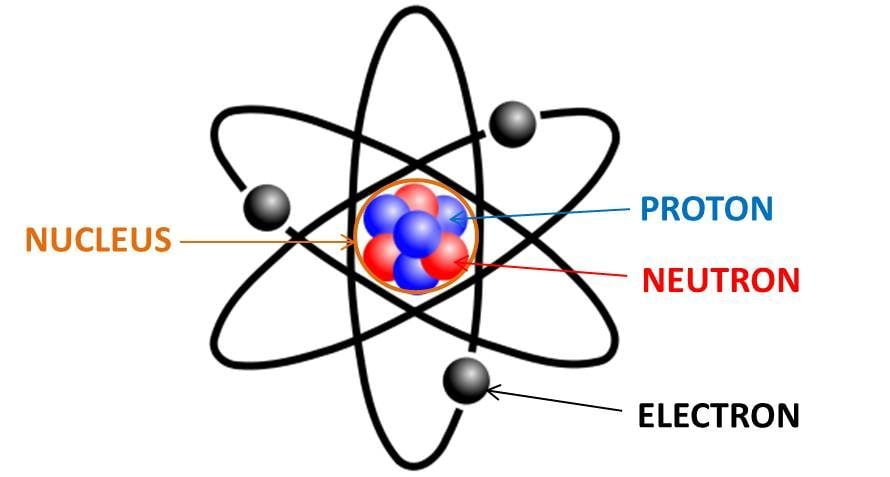
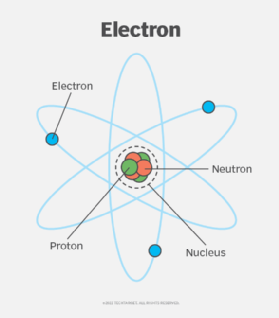
Electron hóa trị là các electron nằm ở lớp ngoài cùng của nguyên tử, có vai trò quan trọng trong việc xác định tính chất hóa học của nguyên tố đó. Những electron này tham gia vào việc tạo ra các liên kết hóa học giữa các nguyên tử, quyết định cách mà nguyên tử tương tác với các nguyên tử khác trong các phản ứng hóa học.
Đặc điểm của Electron Hóa Trị
- Các electron hóa trị nằm ở lớp ngoài cùng của nguyên tử, hay còn gọi là lớp vỏ ngoài cùng.
- Chúng đóng vai trò chính trong việc xác định tính chất hóa học của nguyên tố.
- Electron hóa trị tham gia vào việc hình thành liên kết hóa học, như liên kết cộng hóa trị và liên kết ion.
Số Lượng Electron Hóa Trị
Số lượng electron hóa trị của một nguyên tố có thể được xác định dựa trên vị trí của nó trong bảng tuần hoàn:
- Các nguyên tố trong nhóm 1 có 1 electron hóa trị.
- Các nguyên tố trong nhóm 2 có 2 electron hóa trị.
- Các nguyên tố trong nhóm 13 có 3 electron hóa trị.
- Các nguyên tố trong nhóm 14 có 4 electron hóa trị.
- Các nguyên tố trong nhóm 15 có 5 electron hóa trị.
- Các nguyên tố trong nhóm 16 có 6 electron hóa trị.
- Các nguyên tố trong nhóm 17 có 7 electron hóa trị.
- Các nguyên tố trong nhóm 18 có 8 electron hóa trị (ngoại trừ heli chỉ có 2).
Liên Kết Hóa Học và Vai Trò của Electron Hóa Trị
Các electron hóa trị có vai trò quan trọng trong việc hình thành các loại liên kết hóa học:
- Liên kết cộng hóa trị: Khi các nguyên tử chia sẻ electron hóa trị để tạo thành phân tử.
- Liên kết ion: Khi một nguyên tử nhường electron hóa trị cho nguyên tử khác, tạo thành ion dương và ion âm, từ đó hình thành liên kết giữa chúng.
Các Ví Dụ về Electron Hóa Trị
- Nguyên tử oxy (\(\text{O}\)) có 6 electron hóa trị, chúng tham gia vào việc tạo thành liên kết đôi trong phân tử \(\text{O}_2\).
- Nguyên tử natri (\(\text{Na}\)) có 1 electron hóa trị, dễ dàng nhường electron này để tạo thành ion \(\text{Na}^+\), thường thấy trong muối ăn (\(\text{NaCl}\)).
- Nguyên tử carbon (\(\text{C}\)) có 4 electron hóa trị, cho phép nó hình thành nhiều loại hợp chất khác nhau, bao gồm cả các hợp chất hữu cơ phức tạp như protein và DNA.
Ứng Dụng của Hiểu Biết Về Electron Hóa Trị
Hiểu biết về electron hóa trị giúp các nhà khoa học dự đoán được cách mà các nguyên tố sẽ phản ứng với nhau, thiết kế và tạo ra các vật liệu mới, từ đó ứng dụng trong nhiều lĩnh vực như:
- Hóa học: Phân tích và dự đoán các phản ứng hóa học.
- Vật liệu học: Phát triển các vật liệu mới với tính chất đặc biệt.
- Công nghệ sinh học: Hiểu cơ chế hoạt động của các phân tử sinh học.
.png)
Khái niệm về Electron Hóa Trị
Electron hóa trị là các electron nằm ở lớp ngoài cùng của nguyên tử, còn được gọi là lớp vỏ electron ngoài cùng. Những electron này có vai trò quan trọng trong việc xác định tính chất hóa học và cách mà nguyên tử tương tác với các nguyên tử khác trong các phản ứng hóa học.
Một nguyên tử có thể có nhiều lớp electron, nhưng chỉ có các electron ở lớp vỏ ngoài cùng mới được gọi là electron hóa trị. Số lượng electron hóa trị của một nguyên tố quyết định khả năng tạo liên kết hóa học với các nguyên tố khác.
Xác định Electron Hóa Trị
Việc xác định số lượng electron hóa trị của một nguyên tử dựa trên vị trí của nguyên tố đó trong bảng tuần hoàn:
- Nguyên tố thuộc nhóm 1: 1 electron hóa trị.
- Nguyên tố thuộc nhóm 2: 2 electron hóa trị.
- Nguyên tố thuộc nhóm 13: 3 electron hóa trị.
- Nguyên tố thuộc nhóm 14: 4 electron hóa trị.
- Nguyên tố thuộc nhóm 15: 5 electron hóa trị.
- Nguyên tố thuộc nhóm 16: 6 electron hóa trị.
- Nguyên tố thuộc nhóm 17: 7 electron hóa trị.
- Nguyên tố thuộc nhóm 18: 8 electron hóa trị (ngoại trừ heli chỉ có 2).
Vai Trò của Electron Hóa Trị
Các electron hóa trị là nhân tố chính trong việc hình thành các loại liên kết hóa học như:
- Liên kết cộng hóa trị: Khi hai nguyên tử chia sẻ electron hóa trị để tạo thành phân tử.
- Liên kết ion: Khi một nguyên tử nhường electron hóa trị cho nguyên tử khác, tạo ra ion dương và ion âm, dẫn đến sự hình thành liên kết giữa chúng.
Thông qua sự hiểu biết về electron hóa trị, chúng ta có thể dự đoán cách mà các nguyên tố sẽ phản ứng với nhau, từ đó ứng dụng trong việc thiết kế và phát triển các hợp chất mới.
Cách Xác Định Số Lượng Electron Hóa Trị
Việc xác định số lượng electron hóa trị của một nguyên tử rất quan trọng trong việc dự đoán tính chất hóa học và khả năng phản ứng của nguyên tố đó. Dưới đây là các bước cơ bản để xác định số lượng electron hóa trị:
Bước 1: Xác Định Vị Trí Nguyên Tố Trong Bảng Tuần Hoàn
Bảng tuần hoàn các nguyên tố hóa học được sắp xếp thành các nhóm và chu kỳ. Các nhóm nằm dọc theo bảng tuần hoàn và các nguyên tố trong cùng một nhóm có số lượng electron hóa trị giống nhau.
Bước 2: Xác Định Nhóm của Nguyên Tố
- Các nguyên tố trong nhóm 1 (như natri, kali) có 1 electron hóa trị.
- Các nguyên tố trong nhóm 2 (như magiê, canxi) có 2 electron hóa trị.
- Các nguyên tố trong nhóm 13 (như nhôm) có 3 electron hóa trị.
- Các nguyên tố trong nhóm 14 (như carbon, silic) có 4 electron hóa trị.
- Các nguyên tố trong nhóm 15 (như nitơ, photpho) có 5 electron hóa trị.
- Các nguyên tố trong nhóm 16 (như oxy, lưu huỳnh) có 6 electron hóa trị.
- Các nguyên tố trong nhóm 17 (như flo, clo) có 7 electron hóa trị.
- Các nguyên tố trong nhóm 18 (như heli, neon) có 8 electron hóa trị, ngoại trừ heli chỉ có 2.
Bước 3: Xác Định Số Lượng Electron Hóa Trị Dựa Trên Cấu Hình Electron
Cấu hình electron của một nguyên tử cho biết cách sắp xếp các electron trong các lớp vỏ. Để xác định số lượng electron hóa trị, bạn chỉ cần xem xét các electron nằm ở lớp vỏ ngoài cùng:
- Nếu nguyên tử có cấu hình electron là \(1s^2 2s^2 2p^6 3s^1\), thì lớp vỏ ngoài cùng (lớp 3) có 1 electron, vì vậy số lượng electron hóa trị là 1.
- Đối với cấu hình \(1s^2 2s^2 2p^6 3s^2 3p^5\), lớp vỏ ngoài cùng có 7 electron, nghĩa là nguyên tử có 7 electron hóa trị.
Bước 4: Xác Định Đối Với Các Nguyên Tố Chuyển Tiếp
Đối với các nguyên tố chuyển tiếp, việc xác định số lượng electron hóa trị phức tạp hơn do các electron có thể tham gia vào các lớp vỏ khác nhau. Thông thường, các electron ở lớp \(s\) và \(d\) được xem là electron hóa trị.
Bằng cách sử dụng các bước trên, bạn có thể xác định chính xác số lượng electron hóa trị của một nguyên tố và dự đoán cách mà nguyên tố đó sẽ phản ứng trong các phản ứng hóa học.

Vai Trò của Electron Hóa Trị trong Liên Kết Hóa Học
Electron hóa trị là yếu tố quan trọng quyết định cách thức các nguyên tử liên kết với nhau để tạo thành các hợp chất hóa học. Dưới đây là các vai trò chính của electron hóa trị trong việc hình thành liên kết hóa học:
1. Hình Thành Liên Kết Cộng Hóa Trị
Liên kết cộng hóa trị xảy ra khi hai nguyên tử chia sẻ một hoặc nhiều cặp electron hóa trị để đạt được cấu hình electron bền vững. Ví dụ:
- Trong phân tử \(H_2\), mỗi nguyên tử hydro chia sẻ một electron của mình với nguyên tử kia, tạo thành một cặp electron chung.
- Trong phân tử \(O_2\), hai nguyên tử oxy chia sẻ hai cặp electron hóa trị để hình thành liên kết đôi, giúp mỗi nguyên tử đạt được 8 electron ở lớp vỏ ngoài cùng.
2. Hình Thành Liên Kết Ion
Liên kết ion hình thành khi một nguyên tử nhường electron hóa trị của mình cho nguyên tử khác, tạo ra ion dương và ion âm. Các ion này sau đó hút nhau do lực tĩnh điện:
- Nguyên tử natri (\(\text{Na}\)) có 1 electron hóa trị và dễ dàng nhường electron này để trở thành ion \(\text{Na}^+\).
- Nguyên tử clo (\(\text{Cl}\)) có 7 electron hóa trị và cần thêm 1 electron để đạt cấu hình bền vững, do đó nó nhận electron từ natri để trở thành ion \(\text{Cl}^-\).
- Hai ion \(\text{Na}^+\) và \(\text{Cl}^-\) hút nhau, hình thành liên kết ion và tạo ra hợp chất \(\text{NaCl}\).
3. Định Hình Tính Chất Của Hợp Chất Hóa Học
Loại và số lượng electron hóa trị tham gia vào liên kết hóa học ảnh hưởng trực tiếp đến tính chất vật lý và hóa học của hợp chất:
- Liên kết cộng hóa trị thường tạo ra các phân tử có tính chất linh hoạt và có thể tồn tại ở dạng khí, lỏng, hoặc rắn.
- Liên kết ion tạo ra các tinh thể rắn có điểm nóng chảy cao và dễ dàng hòa tan trong nước để tạo ra dung dịch dẫn điện.
4. Tạo Ra Các Liên Kết Phối Trí (Liên Kết Dative)
Liên kết phối trí xảy ra khi một nguyên tử cung cấp cả hai electron cần thiết cho một liên kết hóa trị:
- Ví dụ trong ion amoni \(\text{NH}_4^+\), nguyên tử nitơ cung cấp một cặp electron để liên kết với ion hydro \(H^+\), tạo ra liên kết phối trí.
Như vậy, electron hóa trị đóng vai trò cốt lõi trong việc xác định cách thức các nguyên tử liên kết và tương tác với nhau, tạo nên sự đa dạng và phong phú của các hợp chất hóa học.
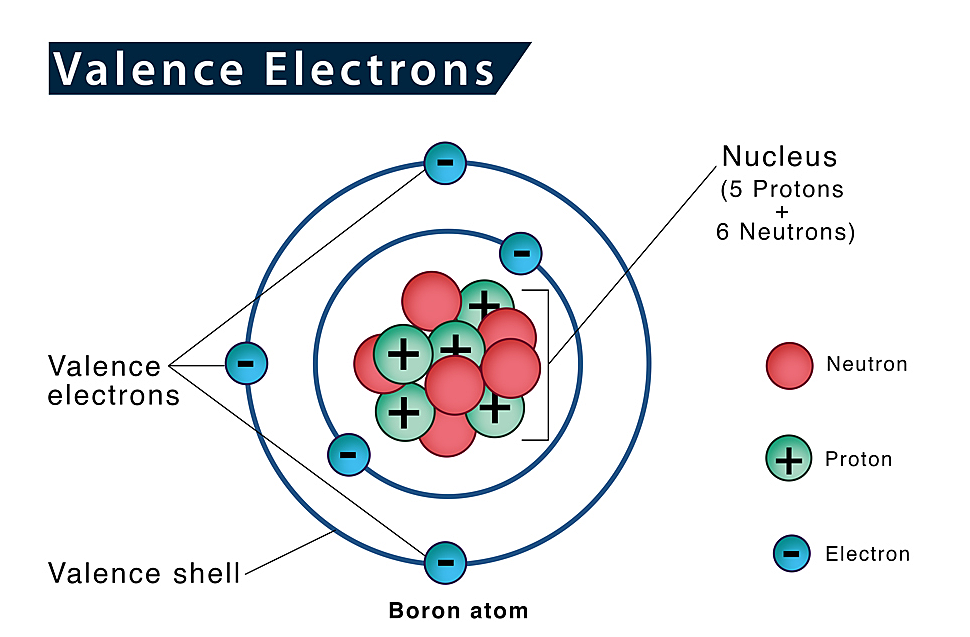
Ứng Dụng của Electron Hóa Trị trong Hóa Học
Electron hóa trị đóng vai trò then chốt trong nhiều ứng dụng của hóa học, từ việc dự đoán phản ứng hóa học đến thiết kế vật liệu mới. Dưới đây là một số ứng dụng quan trọng của electron hóa trị trong lĩnh vực hóa học:
1. Dự Đoán Phản Ứng Hóa Học
Electron hóa trị giúp các nhà hóa học dự đoán cách các nguyên tử và phân tử sẽ tương tác với nhau trong các phản ứng hóa học. Bằng cách xem xét số lượng và cách sắp xếp của các electron hóa trị, có thể xác định được:
- Các nguyên tố nào sẽ dễ dàng nhường hoặc nhận electron để hình thành các liên kết ion.
- Các nguyên tố nào có khả năng chia sẻ electron để tạo thành liên kết cộng hóa trị.
- Khả năng của các nguyên tố hoặc hợp chất trong việc tham gia các phản ứng oxy hóa-khử.
2. Thiết Kế Vật Liệu Mới
Hiểu biết về electron hóa trị là nền tảng để thiết kế và phát triển các vật liệu mới với những tính chất đặc biệt. Ví dụ:
- Trong ngành công nghiệp bán dẫn, sự điều chỉnh số lượng và loại electron hóa trị trong các nguyên tố như silicon giúp tạo ra các vật liệu với đặc tính dẫn điện mong muốn.
- Trong hóa học hữu cơ, việc thiết kế các phân tử hữu cơ dựa trên cấu trúc và sự sắp xếp của electron hóa trị cho phép tạo ra các vật liệu polymer, chất dẻo, và thuốc có tính chất vượt trội.
3. Phát Triển Các Hợp Chất Hữu Cơ và Vô Cơ
Electron hóa trị còn được ứng dụng trong việc phát triển các hợp chất hữu cơ và vô cơ. Bằng cách hiểu rõ về cách các electron hóa trị tương tác, các nhà khoa học có thể:
- Thiết kế các hợp chất mới có thể được sử dụng làm thuốc hoặc chất xúc tác trong các phản ứng hóa học.
- Tạo ra các hợp chất phức hợp với các kim loại chuyển tiếp, mở ra những ứng dụng trong công nghệ hóa học và y sinh.
4. Cải Tiến Quy Trình Công Nghiệp Hóa Học
Trong công nghiệp hóa học, việc kiểm soát và tối ưu hóa các phản ứng hóa học dựa trên sự hiểu biết về electron hóa trị giúp cải tiến hiệu suất và độ an toàn của các quy trình sản xuất. Điều này có ý nghĩa lớn trong:
- Sản xuất các hợp chất hóa học với năng suất cao và chi phí thấp hơn.
- Giảm thiểu chất thải và tác động môi trường, hướng tới sản xuất hóa học bền vững.
Tóm lại, electron hóa trị không chỉ là một khái niệm cơ bản trong hóa học mà còn có nhiều ứng dụng thực tiễn, góp phần thúc đẩy sự phát triển của khoa học và công nghệ.

Ví Dụ về Electron Hóa Trị trong Thực Tế
Electron hóa trị đóng vai trò quan trọng trong việc hình thành các liên kết hóa học và quyết định tính chất của các chất trong thực tế. Dưới đây là một số ví dụ về electron hóa trị trong các hợp chất và ứng dụng thực tiễn:
1. Liên Kết Ion trong Muối Ăn (\(\text{NaCl}\))
Muối ăn, hay natri clorua (\(\text{NaCl}\)), là một ví dụ điển hình về sự hình thành liên kết ion dựa trên electron hóa trị:
- Natri (\(\text{Na}\)) có 1 electron hóa trị, dễ dàng nhường electron này để trở thành ion \(\text{Na}^+\).
- Clo (\(\text{Cl}\)) có 7 electron hóa trị và cần 1 electron để đạt cấu hình bền vững, do đó nhận electron từ natri để trở thành ion \(\text{Cl}^-\).
- Các ion \(\text{Na}^+\) và \(\text{Cl}^-\) hút nhau mạnh mẽ, hình thành nên liên kết ion và tạo thành muối ăn.
2. Liên Kết Cộng Hóa Trị trong Phân Tử Nước (\(\text{H}_2\text{O}\))
Phân tử nước là một ví dụ về liên kết cộng hóa trị, nơi mà các nguyên tử chia sẻ electron hóa trị:
- Mỗi nguyên tử hydro (\(\text{H}\)) có 1 electron hóa trị và cần thêm 1 electron để hoàn thành lớp vỏ ngoài cùng.
- Nguyên tử oxy (\(\text{O}\)) có 6 electron hóa trị và cần thêm 2 electron để đạt cấu hình bền vững.
- Hai nguyên tử hydro chia sẻ electron với oxy, tạo thành hai liên kết cộng hóa trị, và kết quả là phân tử nước (\(\text{H}_2\text{O}\)).
3. Ứng Dụng trong Công Nghệ Pin Lithium-Ion
Pin lithium-ion, được sử dụng phổ biến trong điện thoại di động và xe điện, hoạt động dựa trên sự chuyển động của các ion lithium (\(\text{Li}^+\)) qua lại giữa các điện cực:
- Lithium có 1 electron hóa trị, khi mất đi electron này sẽ trở thành ion \(\text{Li}^+\).
- Trong quá trình sạc pin, các ion \(\text{Li}^+\) di chuyển từ cực dương sang cực âm, và trong quá trình xả, chúng quay trở lại, tạo ra dòng điện.
4. Cấu Trúc Kim Cương và Graphene
Cả kim cương và graphene đều là các dạng thù hình của carbon, nhưng có tính chất rất khác nhau do cách sắp xếp electron hóa trị:
- Trong kim cương, mỗi nguyên tử carbon sử dụng 4 electron hóa trị để tạo 4 liên kết cộng hóa trị mạnh với các nguyên tử carbon khác, tạo ra một mạng tinh thể cứng chắc.
- Trong graphene, mỗi nguyên tử carbon liên kết với 3 nguyên tử khác, còn electron hóa trị thứ 4 tự do di chuyển trong mạng lưới, tạo nên tính dẫn điện tuyệt vời của graphene.
Những ví dụ trên cho thấy electron hóa trị không chỉ quyết định cấu trúc và tính chất của các chất mà còn có ứng dụng quan trọng trong nhiều lĩnh vực của cuộc sống hàng ngày.