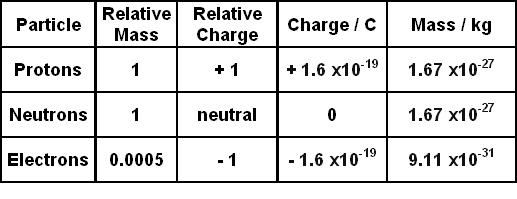
Chủ đề electron geometry: Electron Geometry là yếu tố quan trọng quyết định hình dạng và tính chất của phân tử. Trong bài viết này, chúng tôi sẽ cung cấp một hướng dẫn toàn diện về Electron Geometry, bao gồm khái niệm, các dạng hình học phổ biến, và ứng dụng thực tiễn trong hóa học, giúp bạn nắm bắt và áp dụng kiến thức một cách hiệu quả.
Mục lục
- Electron Geometry và Cách Xác Định
- 1. Khái niệm Electron Geometry
- 2. Các dạng Electron Geometry phổ biến
- 3. Cách xác định Electron Geometry của phân tử
- 4. Ứng dụng của Electron Geometry trong hóa học
- 5. Các công cụ và phương pháp hỗ trợ xác định Electron Geometry
- 6. Các ví dụ minh họa về Electron Geometry
- 7. Thách thức và xu hướng nghiên cứu mới về Electron Geometry
Electron Geometry và Cách Xác Định
Trong hóa học, electron geometry (hình học electron) đề cập đến sự sắp xếp không gian của các cặp electron xung quanh nguyên tử trung tâm trong một phân tử. Sự sắp xếp này có ảnh hưởng lớn đến tính chất hóa học và vật lý của phân tử. Hình học electron bao gồm tất cả các cặp electron liên kết và cặp electron đơn lẻ (cặp electron không tham gia liên kết).
Các dạng hình học electron phổ biến
- Thẳng (Linear): Khi có hai cặp electron xung quanh nguyên tử trung tâm, các cặp electron này sẽ cách nhau một góc 180 độ, tạo thành hình học thẳng.
- Tam giác phẳng (Trigonal Planar): Với ba cặp electron, các cặp này sẽ cách đều nhau và tạo thành một tam giác đều trong một mặt phẳng, với góc 120 độ giữa các cặp electron.
- Tứ diện (Tetrahedral): Với bốn cặp electron, chúng sẽ sắp xếp thành hình tứ diện, với các góc khoảng 109.5 độ giữa các cặp electron.
- Hình tam giác lưỡng tháp (Trigonal Bipyramidal): Khi có năm cặp electron, chúng sẽ sắp xếp thành một lưỡng tháp tam giác, với các góc 90, 120 và 180 độ.
- Bát diện (Octahedral): Với sáu cặp electron, chúng sẽ sắp xếp thành hình bát diện, với các góc 90 độ.
Cách xác định hình học electron
Để xác định hình học electron của một phân tử, ta cần làm theo các bước sau:
- Xác định tổng số cặp electron xung quanh nguyên tử trung tâm. Bao gồm cả cặp electron liên kết và cặp electron không liên kết.
- Dựa trên số lượng cặp electron, xác định hình học electron theo các dạng phổ biến đã nêu ở trên.
- Nếu có cặp electron không liên kết, hãy điều chỉnh hình học để phản ánh sự đẩy giữa các cặp electron này với các cặp electron liên kết.
Tác động của hình học electron đến tính chất phân tử
Hình học electron ảnh hưởng trực tiếp đến hình học phân tử và do đó ảnh hưởng đến các tính chất như độ âm điện, mômen lưỡng cực, và tính phản ứng của phân tử. Việc hiểu rõ hình học electron là cơ sở quan trọng trong việc dự đoán và giải thích các đặc tính của các chất hóa học.
Sự hiểu biết về electron geometry không chỉ giúp chúng ta nắm bắt cấu trúc và tính chất của các phân tử mà còn cung cấp cơ sở để tiếp cận các nghiên cứu phức tạp hơn trong hóa học lượng tử và hóa học cấu trúc.

.png)
1. Khái niệm Electron Geometry
Electron Geometry (hình học electron) là khái niệm trong hóa học mô tả cách các cặp electron, bao gồm cả cặp liên kết và cặp đơn, sắp xếp xung quanh nguyên tử trung tâm trong một phân tử. Sự sắp xếp này ảnh hưởng trực tiếp đến hình dạng tổng thể của phân tử, từ đó quyết định tính chất hóa học và vật lý của nó.
Để hiểu rõ hơn về Electron Geometry, ta cần xem xét các bước cơ bản sau:
- Xác định số lượng cặp electron: Đầu tiên, ta cần xác định số lượng cặp electron xung quanh nguyên tử trung tâm. Các cặp này có thể bao gồm cặp electron liên kết (tham gia tạo liên kết hóa học) và cặp electron không liên kết (còn gọi là cặp đơn).
- Sử dụng lý thuyết VSEPR: Lý thuyết đẩy các cặp electron của vỏ hóa trị (VSEPR - Valence Shell Electron Pair Repulsion) là công cụ chính giúp dự đoán hình học electron. Theo lý thuyết này, các cặp electron sẽ đẩy nhau để tạo ra cấu hình không gian với năng lượng thấp nhất, tức là chúng sẽ sắp xếp sao cho khoảng cách giữa chúng là lớn nhất.
- Xác định hình học electron: Dựa trên số lượng cặp electron, ta có thể xác định hình học electron tương ứng, chẳng hạn như:
- Linear: 2 cặp electron, góc giữa các cặp là 180 độ.
- Trigonal Planar: 3 cặp electron, góc giữa các cặp là 120 độ.
- Tetrahedral: 4 cặp electron, góc giữa các cặp là 109.5 độ.
- Trigonal Bipyramidal: 5 cặp electron, góc 90 độ và 120 độ.
- Octahedral: 6 cặp electron, góc giữa các cặp là 90 độ.
Trong mỗi trường hợp, hình học electron phản ánh sự sắp xếp không gian của các cặp electron xung quanh nguyên tử trung tâm, qua đó ảnh hưởng đến hình dạng và các đặc tính khác của phân tử.
2. Các dạng Electron Geometry phổ biến
Trong hóa học, Electron Geometry mô tả sự sắp xếp không gian của các cặp electron xung quanh nguyên tử trung tâm. Dưới đây là các dạng Electron Geometry phổ biến, mỗi dạng tương ứng với số lượng cặp electron cụ thể.
- Hình học thẳng (Linear)
- Số cặp electron: 2
- Mô tả: Trong dạng hình học này, hai cặp electron xung quanh nguyên tử trung tâm sẽ sắp xếp đối xứng nhau, tạo ra một đường thẳng với góc 180 độ.
- Ví dụ: Phân tử carbon dioxide (CO\(_2\)) có hình dạng thẳng.
- Hình học tam giác phẳng (Trigonal Planar)
- Số cặp electron: 3
- Mô tả: Khi có ba cặp electron, chúng sẽ sắp xếp trong một mặt phẳng và tạo thành hình tam giác đều với góc 120 độ giữa các cặp electron.
- Ví dụ: Phân tử boron trifluoride (BF\(_3\)) có hình dạng tam giác phẳng.
- Hình học tứ diện (Tetrahedral)
- Số cặp electron: 4
- Mô tả: Bốn cặp electron sẽ sắp xếp sao cho mỗi cặp nằm ở đỉnh của một hình tứ diện, với góc 109.5 độ giữa các cặp electron.
- Ví dụ: Phân tử methane (CH\(_4\)) có hình dạng tứ diện.
- Hình học tam giác lưỡng tháp (Trigonal Bipyramidal)
- Số cặp electron: 5
- Mô tả: Năm cặp electron sẽ sắp xếp thành hai tam giác lưỡng tháp, với ba cặp nằm trong mặt phẳng trung tâm (góc 120 độ) và hai cặp còn lại nằm trên trục vuông góc với mặt phẳng đó (góc 90 độ).
- Ví dụ: Phân tử phosphorus pentachloride (PCl\(_5\)) có hình dạng tam giác lưỡng tháp.
- Hình học bát diện (Octahedral)
- Số cặp electron: 6
- Mô tả: Sáu cặp electron sẽ sắp xếp sao cho mỗi cặp nằm ở đỉnh của một hình bát diện, với góc 90 độ giữa tất cả các cặp electron.
- Ví dụ: Phân tử sulfur hexafluoride (SF\(_6\)) có hình dạng bát diện.
Mỗi dạng Electron Geometry ảnh hưởng đến hình dạng và tính chất của phân tử, từ đó quyết định các đặc điểm hóa học và vật lý của nó. Việc hiểu rõ các dạng hình học này là nền tảng quan trọng trong việc nghiên cứu và dự đoán cấu trúc phân tử.

3. Cách xác định Electron Geometry của phân tử
Để xác định Electron Geometry của một phân tử, cần tuân theo một quy trình cụ thể. Quy trình này giúp chúng ta hiểu rõ cách các cặp electron sắp xếp xung quanh nguyên tử trung tâm, từ đó dự đoán được hình học của phân tử. Dưới đây là các bước chi tiết để xác định Electron Geometry:
- Xác định công thức Lewis của phân tử
Bắt đầu bằng cách vẽ công thức Lewis cho phân tử, trong đó mô tả cấu trúc liên kết giữa các nguyên tử và sự phân bố của các cặp electron hóa trị. Công thức Lewis giúp xác định số lượng cặp electron xung quanh nguyên tử trung tâm.
- Đếm số cặp electron xung quanh nguyên tử trung tâm
Xác định tổng số cặp electron liên kết và cặp electron đơn lẻ (cặp electron không liên kết) xung quanh nguyên tử trung tâm. Các cặp electron này là yếu tố quyết định hình học của phân tử.
- Cặp electron liên kết: Những cặp electron tạo liên kết giữa nguyên tử trung tâm và các nguyên tử khác.
- Cặp electron đơn lẻ: Những cặp electron không tham gia vào liên kết nhưng vẫn ảnh hưởng đến hình học phân tử.
- Áp dụng lý thuyết VSEPR
Lý thuyết đẩy các cặp electron của vỏ hóa trị (VSEPR) được sử dụng để xác định cách các cặp electron sắp xếp để giảm thiểu lực đẩy giữa chúng. Nguyên tắc cơ bản là các cặp electron sẽ đẩy nhau để có khoảng cách lớn nhất có thể, tạo ra cấu trúc hình học ổn định.
- Xác định hình học electron dựa trên số lượng cặp electron
Dựa vào số lượng cặp electron xung quanh nguyên tử trung tâm, xác định hình học electron như sau:
- 2 cặp electron: Hình học thẳng (Linear), góc 180°.
- 3 cặp electron: Hình học tam giác phẳng (Trigonal Planar), góc 120°.
- 4 cặp electron: Hình học tứ diện (Tetrahedral), góc 109.5°.
- 5 cặp electron: Hình học tam giác lưỡng tháp (Trigonal Bipyramidal), góc 90° và 120°.
- 6 cặp electron: Hình học bát diện (Octahedral), góc 90°.
- Xem xét ảnh hưởng của cặp electron đơn lẻ
Nếu có cặp electron đơn lẻ, cần điều chỉnh hình học để phản ánh sự đẩy mạnh hơn giữa cặp electron đơn lẻ với các cặp electron liên kết. Điều này có thể làm thay đổi góc giữa các cặp electron, từ đó ảnh hưởng đến hình học phân tử.
Quá trình này giúp xác định chính xác Electron Geometry của phân tử, đóng vai trò quan trọng trong việc dự đoán và hiểu rõ tính chất hóa học cũng như vật lý của các hợp chất.

4. Ứng dụng của Electron Geometry trong hóa học
Electron Geometry không chỉ giúp dự đoán hình dạng phân tử mà còn có nhiều ứng dụng quan trọng trong hóa học. Hiểu biết về Electron Geometry có thể hỗ trợ các nhà khoa học và nhà nghiên cứu trong việc phân tích, dự đoán, và thiết kế các phân tử với các tính chất cụ thể. Dưới đây là một số ứng dụng của Electron Geometry trong hóa học:
- Dự đoán tính chất hóa học của phân tử
Hình dạng phân tử, được quyết định bởi Electron Geometry, ảnh hưởng trực tiếp đến cách phân tử tương tác với các phân tử khác. Ví dụ, sự sắp xếp của các cặp electron có thể xác định độ phân cực của phân tử, ảnh hưởng đến tính chất vật lý như điểm sôi, điểm nóng chảy, và khả năng hòa tan.
- Xác định độ âm điện và mômen lưỡng cực
Electron Geometry có thể giúp xác định mômen lưỡng cực của một phân tử, từ đó giúp đánh giá sự phân bố điện tích trong phân tử. Mômen lưỡng cực ảnh hưởng đến cách phân tử tương tác với các trường điện từ, đóng vai trò quan trọng trong các phản ứng hóa học và tính chất vật lý.
- Ứng dụng trong hóa học lượng tử
Trong hóa học lượng tử, Electron Geometry là yếu tố cơ bản để mô phỏng và tính toán các tính chất của phân tử. Thông qua việc hiểu rõ sự sắp xếp của các cặp electron, các nhà khoa học có thể dự đoán năng lượng, phân bố điện tử, và các trạng thái kích thích của phân tử, từ đó áp dụng trong việc thiết kế vật liệu mới và nghiên cứu các phản ứng hóa học.
- Thiết kế thuốc và vật liệu mới
Trong ngành công nghiệp dược phẩm và vật liệu, Electron Geometry được sử dụng để thiết kế phân tử với các tính chất mong muốn. Bằng cách điều chỉnh hình dạng phân tử, các nhà khoa học có thể tạo ra các hợp chất với hoạt tính sinh học cao hoặc các vật liệu có tính chất đặc biệt như độ bền, độ dẫn điện, hoặc khả năng chống ăn mòn.
- Phân tích và giải thích phổ học
Electron Geometry còn giúp giải thích các kết quả phổ học, chẳng hạn như phổ hồng ngoại (IR) và phổ tử ngoại khả kiến (UV-Vis). Sự phân bố của các cặp electron trong phân tử có thể ảnh hưởng đến các băng hấp thụ trong phổ, giúp nhận diện và phân tích các cấu trúc phân tử phức tạp.
Nhìn chung, Electron Geometry là một công cụ mạnh mẽ trong hóa học, không chỉ giúp hiểu rõ cấu trúc phân tử mà còn hỗ trợ trong nhiều ứng dụng thực tiễn từ nghiên cứu cơ bản đến phát triển công nghệ.

5. Các công cụ và phương pháp hỗ trợ xác định Electron Geometry
Để xác định Electron Geometry của một phân tử, các nhà khoa học sử dụng nhiều công cụ và phương pháp khác nhau. Những công cụ và phương pháp này giúp cung cấp thông tin chính xác về sự sắp xếp của các cặp electron xung quanh nguyên tử trung tâm, từ đó xác định được hình học của phân tử. Dưới đây là các công cụ và phương pháp phổ biến:
- Phương pháp lý thuyết VSEPR (Valence Shell Electron Pair Repulsion)
Phương pháp VSEPR là một trong những công cụ cơ bản và phổ biến nhất để xác định Electron Geometry. Phương pháp này dựa trên nguyên tắc rằng các cặp electron xung quanh nguyên tử trung tâm sẽ đẩy nhau để đạt được cấu hình không gian với năng lượng thấp nhất, tức là các cặp electron sẽ có khoảng cách lớn nhất có thể.
- Sử dụng phần mềm hóa học lượng tử
Các phần mềm hóa học lượng tử như Gaussian, ORCA, hoặc Spartan cho phép tính toán và mô phỏng cấu trúc phân tử, bao gồm Electron Geometry. Các phần mềm này sử dụng các phương pháp tiên tiến như lý thuyết phiếm hàm mật độ (DFT) hoặc phương pháp Hartree-Fock để dự đoán hình dạng phân tử và sự phân bố của các cặp electron.
- Phân tích phổ học (Spectroscopy)
Các kỹ thuật phổ học như phổ hồng ngoại (IR) và phổ cộng hưởng từ hạt nhân (NMR) có thể được sử dụng để xác định Electron Geometry. Ví dụ, phổ IR cung cấp thông tin về các dao động liên kết, từ đó giúp suy ra sự sắp xếp của các cặp electron. Phổ NMR có thể cung cấp thông tin về môi trường xung quanh các nguyên tử, hỗ trợ xác định cấu trúc phân tử.
- Phương pháp nhiễu xạ tia X (X-ray Crystallography)
Phương pháp này sử dụng tia X để xác định cấu trúc tinh thể của một chất. Thông qua phân tích mô hình nhiễu xạ của các tia X khi chúng đi qua tinh thể, các nhà khoa học có thể xác định được Electron Geometry của phân tử trong pha rắn.
- Mô hình phân tử (Molecular Modeling)
Mô hình phân tử là một phương pháp trực quan và thực nghiệm để xác định Electron Geometry. Bằng cách sử dụng các bộ mô hình phân tử hoặc phần mềm mô phỏng 3D, các nhà hóa học có thể trực tiếp tạo dựng và quan sát hình học của phân tử, từ đó suy ra cấu trúc không gian của các cặp electron.
Những công cụ và phương pháp này cung cấp cho các nhà khoa học một loạt các cách tiếp cận khác nhau để nghiên cứu và xác định Electron Geometry, đóng vai trò quan trọng trong việc hiểu rõ cấu trúc và tính chất của các phân tử trong hóa học.
XEM THÊM:
6. Các ví dụ minh họa về Electron Geometry
Để hiểu rõ hơn về Electron Geometry, hãy cùng xem xét một số ví dụ cụ thể. Những ví dụ này sẽ minh họa cách các cặp electron xung quanh nguyên tử trung tâm quyết định hình học của phân tử. Dưới đây là một số ví dụ điển hình:
- Phân tử BeCl2 - Hình học thẳng (Linear)
Trong phân tử BeCl2, nguyên tử berylium (Be) ở trung tâm có hai cặp electron liên kết với hai nguyên tử clo (Cl). Không có cặp electron đơn lẻ nào trên nguyên tử Be, do đó các cặp electron liên kết đẩy nhau và tạo ra hình học thẳng với góc liên kết 180°.
\[ \text{Be} - \text{Cl} - \text{Cl} \] - Phân tử BF3 - Hình học tam giác phẳng (Trigonal Planar)
Phân tử BF3 có nguyên tử boron (B) làm trung tâm, với ba cặp electron liên kết với ba nguyên tử flo (F). Các cặp electron này sắp xếp sao cho góc giữa các liên kết là 120°, tạo ra một hình tam giác phẳng.
\[ \text{F} \hspace{2mm} \vdash \hspace{2mm} \text{B} \dashv \hspace{2mm} \text{F} \hspace{2mm} \vdash \hspace{2mm} \text{F} \] - Phân tử CH4 - Hình học tứ diện (Tetrahedral)
Trong phân tử CH4 (methane), nguyên tử carbon (C) ở trung tâm có bốn cặp electron liên kết với bốn nguyên tử hydro (H). Các cặp electron này sắp xếp theo cấu trúc tứ diện với góc liên kết khoảng 109.5°.
\[ \text{H} \hspace{2mm} \dashv \hspace{2mm} \text{C} \dashv \text{H} \\ \text{H} \hspace{2mm} \dashv \hspace{2mm} \text{H} \] - Phân tử PCl5 - Hình học tam giác lưỡng tháp (Trigonal Bipyramidal)
Phân tử PCl5 có nguyên tử phospho (P) làm trung tâm, với năm cặp electron liên kết với năm nguyên tử clo (Cl). Các cặp electron này tạo thành hình tam giác lưỡng tháp, với ba cặp trong mặt phẳng tam giác và hai cặp khác nằm vuông góc với mặt phẳng đó.
\[ \begin{array}{ccc} & \text{Cl} & \\ \text{Cl} & - \text{P} - & \text{Cl} \\ & \text{Cl} & \\ & \text{Cl} & \end{array} \] - Phân tử SF6 - Hình học bát diện (Octahedral)
Phân tử SF6 có nguyên tử lưu huỳnh (S) làm trung tâm, với sáu cặp electron liên kết với sáu nguyên tử flo (F). Các cặp electron này tạo thành hình bát diện với các góc liên kết đều bằng 90°.
\[ \text{F} \hspace{2mm} \vdash \hspace{2mm} \text{S} \dashv \text{F} \\ \text{F} \hspace{2mm} \vdash \hspace{2mm} \text{F} \dashv \text{F} \\ \text{F} \hspace{2mm} \dashv \text{F} \]
Những ví dụ trên minh họa cách các cặp electron sắp xếp trong không gian để tạo ra các hình học phân tử khác nhau, từ đó xác định các tính chất vật lý và hóa học của phân tử.

7. Thách thức và xu hướng nghiên cứu mới về Electron Geometry
Trong lĩnh vực hóa học và vật lý, việc nghiên cứu Electron Geometry không ngừng đối mặt với nhiều thách thức cũng như mở ra các xu hướng nghiên cứu mới đầy hứa hẹn. Những thách thức này đặt ra yêu cầu cao đối với các nhà khoa học trong việc hiểu rõ hơn về cấu trúc phân tử và các yếu tố ảnh hưởng đến Electron Geometry.
- Thách thức trong mô phỏng và dự đoán Electron Geometry
Một trong những thách thức lớn nhất là việc mô phỏng và dự đoán chính xác Electron Geometry của các phân tử phức tạp. Các phương pháp truyền thống như lý thuyết VSEPR đôi khi gặp khó khăn trong việc giải thích các hệ thống có nhiều yếu tố tác động, chẳng hạn như các phân tử có liên kết dπ hoặc các hệ thống liên kết bất thường. Điều này đòi hỏi phải có các phương pháp tính toán tiên tiến hơn để đưa ra các dự đoán chính xác hơn.
- Khả năng tương tác của Electron Geometry với môi trường
Môi trường xung quanh phân tử có thể ảnh hưởng mạnh mẽ đến Electron Geometry. Sự tương tác giữa các phân tử và môi trường (như dung môi, nhiệt độ, áp suất) là một trong những yếu tố phức tạp cần được nghiên cứu kỹ lưỡng. Các mô hình hiện tại cần phải tích hợp các yếu tố này để phản ánh chính xác hơn Electron Geometry trong các điều kiện khác nhau.
- Xu hướng nghiên cứu về Electron Geometry trong các hệ thống nano
Với sự phát triển của công nghệ nano, nghiên cứu về Electron Geometry trong các vật liệu nano và phân tử nano đã trở thành một xu hướng nổi bật. Các nhà khoa học đang tìm cách hiểu rõ hơn về cách Electron Geometry ảnh hưởng đến tính chất điện tử, quang học và hóa học của các vật liệu này, từ đó mở ra cơ hội phát triển các ứng dụng mới trong điện tử, y học và môi trường.
- Ứng dụng của trí tuệ nhân tạo (AI) trong nghiên cứu Electron Geometry
Trí tuệ nhân tạo (AI) đang dần trở thành một công cụ mạnh mẽ trong nghiên cứu Electron Geometry. AI có khả năng xử lý lượng dữ liệu lớn và tìm ra các mô hình phức tạp mà các phương pháp truyền thống khó nhận ra. Việc sử dụng AI để dự đoán Electron Geometry và khám phá các chất mới là một trong những xu hướng nghiên cứu tiên tiến hiện nay.
- Phát triển các phương pháp phổ học tiên tiến
Các phương pháp phổ học như phổ X-ray, NMR và quang phổ điện tử đang được cải tiến liên tục để cung cấp thông tin chính xác và chi tiết hơn về Electron Geometry. Sự phát triển này không chỉ giúp hiểu rõ hơn về cấu trúc phân tử mà còn mở ra các ứng dụng mới trong nghiên cứu vật liệu và dược phẩm.
Những thách thức và xu hướng nghiên cứu mới về Electron Geometry không chỉ thúc đẩy sự phát triển của lĩnh vực hóa học mà còn mở ra nhiều cơ hội ứng dụng trong các lĩnh vực khác, từ công nghệ nano đến trí tuệ nhân tạo.