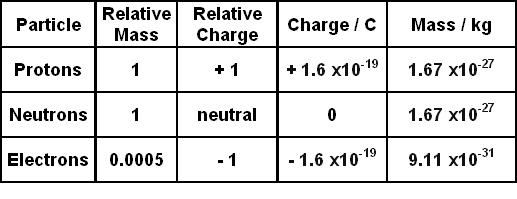
Chủ đề electron affinity: Electron Affinity là một khái niệm quan trọng trong hóa học, giúp hiểu rõ về khả năng của nguyên tử nhận thêm electron và tạo thành ion âm. Bài viết này sẽ cung cấp cái nhìn toàn diện về electron affinity, từ định nghĩa, cách tính toán, đến các ứng dụng thực tế và tầm quan trọng của nó trong nghiên cứu hóa học hiện đại.
Mục lục
- Ái Lực Điện Tử (Electron Affinity)
- 1. Định nghĩa và Ý nghĩa của Ái Lực Điện Tử
- 2. Cách tính toán và Đo lường Ái Lực Điện Tử
- 3. Ái Lực Điện Tử trong Bảng Tuần Hoàn
- 4. Ứng dụng của Ái Lực Điện Tử trong Thực tiễn
- 5. Các nguyên tố có Ái Lực Điện Tử cao
- 6. Thí nghiệm và Đo đạc Ái Lực Điện Tử
- 7. So sánh Ái Lực Điện Tử với các thuộc tính khác
Ái Lực Điện Tử (Electron Affinity)
Ái lực điện tử, hay electron affinity, là một khái niệm trong hóa học lượng tử và vật lý hạt nhân, liên quan đến năng lượng phát ra khi một nguyên tử hoặc phân tử ở trạng thái khí nhận thêm một electron để trở thành ion âm. Khái niệm này giúp hiểu rõ hơn về tính chất hóa học của các nguyên tố, đặc biệt là trong các phản ứng hóa học và quá trình hình thành liên kết ion.
Định nghĩa và Khái niệm Cơ bản
Ái lực điện tử \(\Delta H\) của một nguyên tử hoặc phân tử là năng lượng thay đổi khi một electron được thêm vào nguyên tử hoặc phân tử đó trong trạng thái khí để tạo thành ion âm:
\[
X(g) + e^- \rightarrow X^-(g) + \Delta H
\]
Năng lượng này thường được đo bằng electronvolt (eV) hoặc kilojoule trên mol (kJ/mol). Nếu năng lượng này có giá trị âm, điều đó có nghĩa là quá trình nhận electron là tỏa nhiệt.
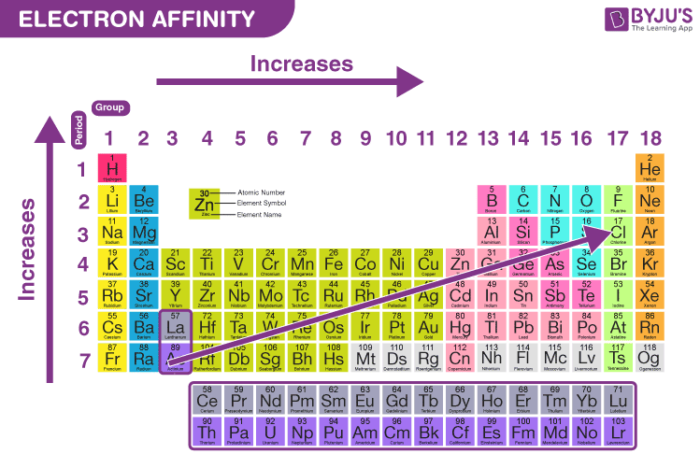
Biến Thiên của Ái Lực Điện Tử Trong Bảng Tuần Hoàn
- Trong một chu kỳ, ái lực điện tử thường tăng dần từ trái sang phải, do bán kính nguyên tử giảm và lực hút giữa hạt nhân với electron thêm vào tăng lên.
- Trong một nhóm, ái lực điện tử thường giảm từ trên xuống dưới do bán kính nguyên tử tăng, làm giảm lực hút giữa hạt nhân với electron thêm vào.
- Các phi kim thường có ái lực điện tử lớn hơn kim loại. Điều này đặc biệt đúng với các nguyên tố halogen như fluor (\(F\)), chlor (\(Cl\)), brom (\(Br\)), và iod (\(I\)), vốn có xu hướng mạnh mẽ trong việc nhận electron.
Ứng Dụng và Ý Nghĩa
Hiểu về ái lực điện tử giúp các nhà khoa học và kỹ sư dự đoán khả năng của các nguyên tố trong việc tham gia vào các phản ứng hóa học, đặc biệt là trong việc hình thành các hợp chất ion. Điều này có ý nghĩa quan trọng trong nghiên cứu hóa học, vật liệu, và cả trong công nghệ sản xuất.
Một Số Giá Trị Ái Lực Điện Tử Tiêu Biểu
| Nguyên tố | Ái lực điện tử (kJ/mol) |
|---|---|
| Fluor (F) | -328 |
| Chlor (Cl) | -349 |
| Oxygen (O) | -141 |
| Sulfur (S) | -200 |
| Phosphorus (P) | -72 |
Kết Luận
Ái lực điện tử là một khái niệm quan trọng trong hóa học giúp hiểu rõ hơn về tính chất và hành vi của các nguyên tố. Việc nắm vững kiến thức này không chỉ giúp trong việc nghiên cứu và phát triển các ứng dụng khoa học mà còn có thể ứng dụng vào các lĩnh vực thực tiễn như vật liệu và công nghệ.
.png)
1. Định nghĩa và Ý nghĩa của Ái Lực Điện Tử
Ái lực điện tử, hay electron affinity, là một khái niệm trong hóa học liên quan đến năng lượng phát ra khi một nguyên tử hoặc phân tử ở trạng thái khí thu nhận thêm một electron để tạo thành ion âm. Quá trình này có thể được mô tả bằng phương trình:
\[
X(g) + e^- \rightarrow X^-(g) + \Delta H
\]
Trong đó, \(\Delta H\) là năng lượng ái lực điện tử. Nếu \(\Delta H\) có giá trị âm, quá trình thu electron sẽ tỏa nhiệt, nghĩa là hệ thống trở nên ổn định hơn. Giá trị này phản ánh mức độ dễ dàng của một nguyên tử trong việc nhận thêm electron.
Ý Nghĩa của Ái Lực Điện Tử
- Ái lực điện tử giúp xác định khả năng của một nguyên tố trong việc trở thành ion âm, từ đó ảnh hưởng đến tính chất hóa học và các phản ứng mà nguyên tố đó tham gia.
- Nó có vai trò quan trọng trong việc dự đoán tính chất của các nguyên tố trong bảng tuần hoàn, đặc biệt là các phi kim như nhóm halogen, vốn có ái lực điện tử cao.
- Hiểu rõ ái lực điện tử còn giúp trong việc nghiên cứu và phát triển các vật liệu mới, chẳng hạn như chất bán dẫn và hợp chất ion.
Như vậy, ái lực điện tử không chỉ là một khái niệm lý thuyết mà còn có ứng dụng thực tiễn rộng rãi trong hóa học và công nghệ.
2. Cách tính toán và Đo lường Ái Lực Điện Tử
Ái lực điện tử là một đại lượng có thể được xác định thông qua các thí nghiệm hoặc tính toán lý thuyết. Việc đo lường ái lực điện tử đòi hỏi sự chính xác cao và thường sử dụng các phương pháp khoa học tiên tiến.
2.1. Phương Pháp Thực Nghiệm
Để đo lường ái lực điện tử thực nghiệm, các nhà khoa học thường sử dụng các kỹ thuật như quang phổ điện tử và phổ khối. Dưới đây là quy trình cơ bản:
- Chuẩn bị mẫu nguyên tử hoặc phân tử ở trạng thái khí, thường ở nhiệt độ rất thấp để hạn chế chuyển động nhiệt.
- Chiếu một chùm electron vào mẫu để kích thích và thu nhận electron.
- Sử dụng các thiết bị đo năng lượng, như máy quang phổ điện tử, để xác định năng lượng giải phóng khi electron được thêm vào nguyên tử.
Kết quả của quá trình này sẽ cho ta biết giá trị ái lực điện tử, thường được đo bằng đơn vị electronvolt (eV).
2.2. Tính Toán Lý Thuyết
Các phương pháp tính toán lý thuyết cũng rất hữu ích trong việc xác định ái lực điện tử, đặc biệt khi việc đo lường thực nghiệm gặp khó khăn. Một số phương pháp phổ biến bao gồm:
- Phương pháp lý thuyết phiếm hàm mật độ (DFT): Sử dụng để tính toán năng lượng của nguyên tử trước và sau khi nhận electron.
- Phương pháp Hartree-Fock: Một kỹ thuật tính toán lượng tử học, cho phép xác định cấu hình điện tử của nguyên tử và từ đó tính toán ái lực điện tử.
Các phương pháp này dựa trên các nguyên tắc cơ bản của cơ học lượng tử và thường được thực hiện bằng các phần mềm chuyên dụng.
2.3. Một số Ví dụ Về Ái Lực Điện Tử
| Nguyên tố | Ái lực điện tử (eV) |
|---|---|
| Fluor (F) | 3.45 |
| Chlor (Cl) | 3.61 |
| Oxygen (O) | 1.46 |
| Sulfur (S) | 2.07 |
Các giá trị này cho thấy mức độ ái lực điện tử khác nhau giữa các nguyên tố, phản ánh sự khác biệt về khả năng nhận electron của chúng.

3. Ái Lực Điện Tử trong Bảng Tuần Hoàn
Ái lực điện tử của các nguyên tố có sự biến đổi rõ rệt khi di chuyển qua các chu kỳ và nhóm trong bảng tuần hoàn. Hiểu được sự biến thiên này giúp chúng ta dễ dàng dự đoán tính chất hóa học và hành vi của các nguyên tố trong các phản ứng hóa học.
3.1. Biến Thiên Ái Lực Điện Tử Theo Chu Kỳ
Trong một chu kỳ của bảng tuần hoàn, ái lực điện tử thường có xu hướng tăng dần từ trái sang phải. Điều này là do khi di chuyển từ trái sang phải, bán kính nguyên tử giảm và lực hút giữa hạt nhân với electron thêm vào trở nên mạnh hơn. Ví dụ, nhóm halogen như Fluor (\(F\)) và Chlor (\(Cl\)) có ái lực điện tử rất cao, vì chúng rất dễ dàng nhận thêm một electron để đạt được cấu hình electron bền vững.
3.2. Biến Thiên Ái Lực Điện Tử Theo Nhóm
Trong một nhóm, ái lực điện tử thường giảm dần từ trên xuống dưới. Nguyên nhân là do bán kính nguyên tử tăng lên khi số lớp electron tăng, khiến lực hút giữa hạt nhân và electron thêm vào yếu đi. Ví dụ, trong nhóm halogen, ái lực điện tử của Fluor (\(F\)) cao hơn hẳn so với Iod (\(I\)) do Fluor có bán kính nguyên tử nhỏ hơn.
3.3. Các Nhóm Nguyên Tố Đặc Biệt
- Nhóm Halogen: Các nguyên tố trong nhóm halogen (F, Cl, Br, I) đều có ái lực điện tử rất cao do nhu cầu nhận thêm một electron để đạt được cấu hình electron ổn định. Điều này giải thích tính chất hóa học mạnh mẽ và khả năng phản ứng cao của chúng.
- Các Kim Loại Kiềm: Ngược lại, các kim loại kiềm (Li, Na, K) có ái lực điện tử thấp hơn nhiều so với các phi kim, vì chúng có xu hướng mất electron hơn là nhận thêm electron.
3.4. Bảng Tổng Hợp Ái Lực Điện Tử Một Số Nguyên Tố
| Nguyên tố | Ái lực điện tử (kJ/mol) |
|---|---|
| Fluor (F) | -328 |
| Chlor (Cl) | -349 |
| Brom (Br) | -325 |
| Iod (I) | -295 |
| Oxygen (O) | -141 |
Như vậy, ái lực điện tử là một thuộc tính quan trọng, ảnh hưởng đến tính chất và hành vi của các nguyên tố trong bảng tuần hoàn. Việc nắm rõ sự biến thiên của ái lực điện tử trong bảng tuần hoàn giúp dự đoán và giải thích được nhiều hiện tượng hóa học phức tạp.
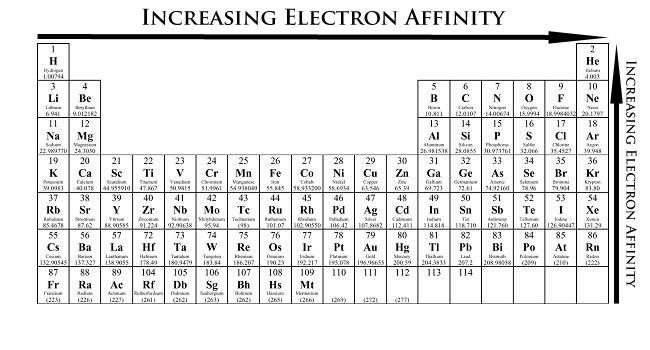
4. Ứng dụng của Ái Lực Điện Tử trong Thực tiễn
Ái lực điện tử là một khái niệm quan trọng không chỉ trong lý thuyết hóa học mà còn có nhiều ứng dụng thực tiễn trong các ngành công nghiệp và nghiên cứu khoa học. Dưới đây là một số ứng dụng điển hình:
4.1. Trong Tổng Hợp Hóa Học
- Tạo chất xúc tác: Ái lực điện tử được sử dụng để thiết kế các chất xúc tác hiệu quả trong các phản ứng hóa học, đặc biệt là trong các quá trình công nghiệp như sản xuất phân bón và hóa chất.
- Sản xuất hợp chất ion: Các nguyên tố có ái lực điện tử cao dễ dàng tạo thành các hợp chất ion, được ứng dụng trong sản xuất muối, pin điện hóa, và vật liệu bán dẫn.
4.2. Trong Công Nghệ Vật Liệu
- Phát triển vật liệu bán dẫn: Ái lực điện tử đóng vai trò quan trọng trong việc lựa chọn và phát triển các vật liệu bán dẫn, được sử dụng trong vi mạch, transistor, và các thiết bị điện tử khác.
- Thiết kế màng lọc: Các vật liệu với ái lực điện tử cụ thể được sử dụng trong việc thiết kế màng lọc có khả năng lọc chọn lọc các ion hoặc phân tử, ứng dụng trong xử lý nước và công nghiệp hóa chất.
4.3. Trong Nghiên Cứu và Phát Triển
- Nghiên cứu hóa học lượng tử: Ái lực điện tử là một trong những thông số quan trọng trong nghiên cứu hóa học lượng tử, giúp mô phỏng và dự đoán các phản ứng hóa học ở cấp độ nguyên tử và phân tử.
- Phát triển công nghệ pin: Hiểu biết về ái lực điện tử giúp cải thiện hiệu suất của pin lithium-ion và các loại pin tiên tiến khác, thông qua việc tối ưu hóa các vật liệu điện cực.
Tóm lại, ái lực điện tử không chỉ là một khái niệm lý thuyết mà còn có nhiều ứng dụng thực tiễn quan trọng, từ công nghiệp hóa chất đến công nghệ vật liệu và nghiên cứu khoa học.

5. Các nguyên tố có Ái Lực Điện Tử cao
Ái lực điện tử của một nguyên tố cho biết khả năng của nguyên tố đó khi thu nhận một electron. Những nguyên tố có ái lực điện tử cao thường là các phi kim nằm ở phía trên bên phải của bảng tuần hoàn, nơi lực hút giữa hạt nhân và electron mạnh nhất. Dưới đây là một số nguyên tố tiêu biểu có ái lực điện tử cao:
5.1. Fluor (\(F\))
Fluor là nguyên tố có ái lực điện tử cao nhất trong bảng tuần hoàn. Với giá trị ái lực điện tử vào khoảng \(-328\) kJ/mol, Fluor rất dễ dàng nhận thêm một electron để đạt được cấu hình electron bền vững như khí hiếm. Điều này giải thích tính phản ứng mạnh mẽ và khả năng oxy hóa cao của nó.
5.2. Chlor (\(Cl\))
Chlor là nguyên tố tiếp theo trong nhóm halogen có ái lực điện tử cao, đạt giá trị khoảng \(-349\) kJ/mol. Chlor, giống như Fluor, có xu hướng mạnh mẽ trong việc thu nhận electron, làm cho nó trở thành một chất oxy hóa mạnh và thường được sử dụng trong các phản ứng hóa học.
5.3. Brom (\(Br\))
Brom có ái lực điện tử cao, với giá trị vào khoảng \(-325\) kJ/mol. Mặc dù thấp hơn Fluor và Chlor, Brom vẫn thể hiện tính chất hóa học đặc trưng của nhóm halogen và thường được sử dụng trong các hợp chất hữu cơ và các phản ứng hóa học.
5.4. Oxygen (\(O\))
Oxygen là một phi kim quan trọng với ái lực điện tử khoảng \(-141\) kJ/mol. Mặc dù ái lực điện tử của Oxygen không cao bằng các halogen, nó vẫn đóng vai trò quan trọng trong các phản ứng oxy hóa khử và là một nguyên tố thiết yếu cho sự sống.
5.5. Các Nguyên Tố khác
- Iod (\(I\)): Có ái lực điện tử khoảng \(-295\) kJ/mol, thấp hơn các halogen khác nhưng vẫn đáng chú ý.
- Sulfur (\(S\)): Ái lực điện tử của Sulfur là \(-200\) kJ/mol, và nó thường tham gia vào các phản ứng hóa học quan trọng, đặc biệt trong hợp chất lưu huỳnh hữu cơ.
Những nguyên tố trên đều có đặc điểm chung là có khả năng mạnh mẽ trong việc thu nhận electron, điều này không chỉ quyết định tính chất hóa học của chúng mà còn ảnh hưởng đến cách chúng tham gia vào các phản ứng hóa học.
XEM THÊM:
6. Thí nghiệm và Đo đạc Ái Lực Điện Tử
Thí nghiệm đo đạc ái lực điện tử là quá trình xác định năng lượng giải phóng khi một nguyên tử trung hòa nhận thêm một electron. Để tiến hành, các bước chính thường bao gồm:
6.1. Thiết bị và quy trình đo lường
- Nguồn electron: Để tạo ra chùm electron, thường sử dụng nguồn phát electron nhiệt hoặc trường.
- Phổ khối: Dùng để xác định khối lượng và tỉ lệ giữa các ion tạo thành. Thiết bị phổ khối có thể phát hiện và đo đạc ion âm sinh ra khi nguyên tử nhận electron.
- Buồng chân không: Đảm bảo rằng các phép đo diễn ra trong môi trường không bị nhiễu bởi các yếu tố bên ngoài, giữ cho quá trình tạo ion diễn ra thuận lợi.
- Quy trình:
- Nguyên tử hoặc phân tử được đưa vào buồng chân không.
- Chùm electron được chiếu vào, làm cho nguyên tử nhận electron và trở thành ion âm.
- Phổ khối ghi nhận và phân tích các ion âm, từ đó xác định ái lực điện tử dựa trên sự phân tách năng lượng.
6.2. Kết quả thực nghiệm và phân tích
Kết quả thu được từ phổ khối cho thấy giá trị năng lượng của ái lực điện tử. Các phân tích tiếp theo sẽ liên quan đến việc so sánh giá trị này với các lý thuyết hiện có, giúp hiểu rõ hơn về cấu trúc và tính chất của nguyên tử hoặc phân tử.

7. So sánh Ái Lực Điện Tử với các thuộc tính khác
Ái lực điện tử (Electron Affinity) là một đại lượng quan trọng trong hóa học, thường được so sánh với các thuộc tính khác của nguyên tử như độ âm điện (Electronegativity) và năng lượng ion hóa (Ionization Energy) để hiểu rõ hơn về tính chất và hành vi của các nguyên tố hóa học.
7.1. So sánh với Độ âm điện
Độ âm điện đo lường khả năng của một nguyên tử hút electron về phía mình trong một liên kết hóa học, trong khi đó ái lực điện tử đo năng lượng giải phóng khi một nguyên tử cô lập nhận thêm một electron. Mặc dù cả hai đại lượng đều liên quan đến việc hấp thụ electron, chúng khác nhau ở ngữ cảnh: Độ âm điện tập trung vào tương tác trong liên kết, còn ái lực điện tử lại đánh giá một nguyên tử độc lập.
- Nguyên tố có độ âm điện cao thường có ái lực điện tử cao, nhưng không phải lúc nào cũng vậy.
- Ví dụ, Flo có độ âm điện lớn nhất nhưng ái lực điện tử của nó thấp hơn Clo do ảnh hưởng của sự suy yếu tương tác giữa các electron trong phân lớp.
7.2. So sánh với Năng lượng ion hóa
Năng lượng ion hóa là năng lượng cần thiết để loại bỏ một electron khỏi nguyên tử trung hòa, trong khi ái lực điện tử là năng lượng giải phóng khi nguyên tử nhận thêm một electron. Hai đại lượng này thường có mối quan hệ nghịch biến:
- Năng lượng ion hóa cao thường đi kèm với ái lực điện tử cao, do nguyên tử khó mất electron nhưng lại dễ nhận thêm electron.
- Tuy nhiên, sự so sánh này không phải luôn đúng cho mọi nguyên tố. Ví dụ, oxy có năng lượng ion hóa cao hơn lưu huỳnh, nhưng ái lực điện tử của nó lại thấp hơn do những ảnh hưởng về cấu trúc phân tử.
Những sự so sánh này giúp các nhà hóa học dự đoán và giải thích các tính chất hóa học của nguyên tố, cũng như xu hướng liên kết và phản ứng của chúng trong các hợp chất.