Chủ đề liên kết phân cực mạnh nhất: Liên kết phân cực mạnh nhất không chỉ giúp chúng ta hiểu sâu hơn về hóa học mà còn mở ra nhiều ứng dụng trong cuộc sống. Bài viết này sẽ cung cấp thông tin chi tiết và dễ hiểu nhất về liên kết phân cực, giúp bạn nắm bắt kiến thức một cách nhanh chóng và hiệu quả.
Mục lục
- Liên Kết Phân Cực Mạnh Nhất
- 1. Định Nghĩa và Khái Niệm Cơ Bản về Liên Kết Phân Cực
- 2. Liên Kết Phân Cực Trong Các Phản Ứng Hóa Học
- 3. So Sánh Liên Kết Phân Cực và Liên Kết Ion
- 4. Mối Quan Hệ Giữa Liên Kết Phân Cực và Tính Chất Vật Lý Của Chất
- 5. Các Phương Pháp Xác Định Liên Kết Phân Cực
- 6. Bài Tập và Lời Giải về Liên Kết Phân Cực
Liên Kết Phân Cực Mạnh Nhất
Liên kết phân cực là loại liên kết hóa học mà trong đó cặp electron liên kết không được chia đều giữa các nguyên tử tham gia liên kết. Độ phân cực của liên kết phụ thuộc vào sự chênh lệch độ âm điện giữa hai nguyên tử. Độ phân cực càng cao, liên kết càng mạnh.
Độ Âm Điện và Sự Phân Cực
Độ phân cực của một liên kết được xác định chủ yếu bởi sự khác biệt trong độ âm điện (\(\Delta\chi\)) giữa các nguyên tử. Độ âm điện là thước đo khả năng hút electron của một nguyên tử trong một liên kết hóa học. Nếu sự chênh lệch này lớn, liên kết sẽ có tính phân cực mạnh.
Các cặp nguyên tử phổ biến với liên kết phân cực mạnh bao gồm:
- Liên kết Na-F: Đây là một trong những liên kết có độ phân cực mạnh nhất do sự chênh lệch độ âm điện rất lớn giữa Na (0.93) và F (3.98).
- Liên kết H-F: Một ví dụ kinh điển của liên kết phân cực mạnh với độ chênh lệch âm điện lớn giữa H (2.20) và F (3.98).
- Liên kết H-Cl: Liên kết giữa H và Cl cũng là một liên kết phân cực mạnh do Cl có độ âm điện cao hơn đáng kể so với H.
Liên Kết Ion và Phân Cực
Liên kết ion là một trường hợp đặc biệt của liên kết phân cực mạnh, nơi mà electron được chuyển hoàn toàn từ nguyên tử có độ âm điện thấp sang nguyên tử có độ âm điện cao. Điều này tạo ra các ion dương và âm, hình thành nên liên kết ion.
| Loại Liên Kết | Ví Dụ | Độ Chênh Lệch Độ Âm Điện (\(\Delta\chi\)) |
|---|---|---|
| Liên Kết Cộng Hóa Trị Phân Cực | H-F | 1.78 |
| Liên Kết Ion | Na-F | 3.05 |
| Liên Kết Cộng Hóa Trị Không Phân Cực | H-H | 0.0 |
Kết Luận
Liên kết phân cực mạnh nhất thường gặp là liên kết ion giữa các nguyên tố có sự chênh lệch độ âm điện lớn, như liên kết giữa natri (Na) và flo (F). Những liên kết này có vai trò quan trọng trong nhiều phản ứng hóa học và tạo ra các tính chất vật lý đặc biệt cho các hợp chất.
.png)
1. Định Nghĩa và Khái Niệm Cơ Bản về Liên Kết Phân Cực
Liên kết phân cực là một dạng liên kết hóa học trong đó cặp electron chung bị kéo về phía một nguyên tử nhiều hơn, tạo nên sự chênh lệch điện tích giữa hai đầu của liên kết. Điều này xảy ra khi hai nguyên tử tham gia vào liên kết có độ âm điện khác nhau đáng kể.
Độ âm điện của một nguyên tử biểu thị khả năng hút electron của nguyên tử đó trong một liên kết hóa học. Khi độ âm điện của hai nguyên tử khác nhau, cặp electron dùng chung sẽ bị lệch về phía nguyên tử có độ âm điện lớn hơn, làm cho liên kết trở nên phân cực.
Liên kết phân cực được biểu diễn bằng một vector dipole với đầu mũi tên chỉ về phía nguyên tử có độ âm điện lớn hơn. Sự phân cực này làm cho một đầu của liên kết trở nên dương hơn và đầu kia trở nên âm hơn.
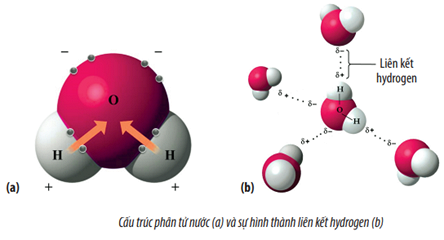
Ví dụ về liên kết phân cực phổ biến là liên kết giữa các nguyên tử trong phân tử nước (H₂O). Oxy có độ âm điện cao hơn hydro, do đó cặp electron liên kết bị kéo về phía nguyên tử oxy, tạo nên một liên kết phân cực mạnh.
- Liên kết phân cực là sự kết hợp giữa tính chất của liên kết cộng hóa trị và liên kết ion.
- Các liên kết có độ phân cực cao thường dẫn đến các tính chất vật lý và hóa học đặc biệt như điểm sôi và điểm nóng chảy cao.
| Yếu tố | Định nghĩa |
| Độ âm điện | Khả năng của một nguyên tử hút electron trong một liên kết. |
| Vector dipole | Vector biểu diễn sự phân bố điện tích trong một liên kết phân cực. |
2. Liên Kết Phân Cực Trong Các Phản Ứng Hóa Học
Trong các phản ứng hóa học, liên kết phân cực đóng vai trò quan trọng trong việc xác định cơ chế phản ứng và sản phẩm cuối cùng. Khi một liên kết phân cực bị phá vỡ, cặp electron chung có thể được chuyển hoàn toàn sang một nguyên tử, tạo ra ion hoặc tạo điều kiện cho các phản ứng khác xảy ra.
Các phản ứng có sự tham gia của liên kết phân cực thường liên quan đến việc chuyển giao điện tích hoặc trao đổi các nhóm chức năng, làm thay đổi sự phân bố điện tích trong các phân tử tham gia. Điều này có thể làm thay đổi năng lượng của hệ thống, dẫn đến việc hình thành các sản phẩm mới.
Ví dụ, trong phản ứng cộng nucleophilic vào một liên kết đôi C=O phân cực, phần electron-rich của liên kết tấn công vào nguyên tử carbon dương, dẫn đến sự mở rộng của liên kết và tạo thành sản phẩm mới:
- Phản ứng này thường thấy trong các quá trình tổng hợp hữu cơ, như phản ứng tạo alcohol từ aldehyde hoặc ketone.
- Liên kết phân cực cũng ảnh hưởng đến độ hoạt động của các chất tham gia phản ứng, làm tăng hoặc giảm tốc độ phản ứng tùy thuộc vào môi trường xung quanh.
| Loại Phản Ứng | Vai Trò của Liên Kết Phân Cực |
| Phản ứng cộng nucleophilic | Cung cấp điểm tấn công cho tác nhân nucleophilic, dẫn đến sự hình thành sản phẩm mới. |
| Phản ứng thế electrophilic | Liên kết phân cực xác định vị trí tấn công của tác nhân electrophilic trong phản ứng. |

3. So Sánh Liên Kết Phân Cực và Liên Kết Ion
Liên kết phân cực và liên kết ion là hai dạng liên kết hóa học quan trọng, nhưng chúng có những đặc điểm khác biệt rõ rệt. Dưới đây là sự so sánh giữa hai loại liên kết này để làm rõ hơn về tính chất và vai trò của chúng trong các phản ứng hóa học.
- Bản chất của liên kết:
- Liên kết phân cực: Được hình thành khi có sự chia sẻ không đều của cặp electron giữa hai nguyên tử có độ âm điện khác nhau. Điều này dẫn đến sự xuất hiện của các cực dương và âm trong phân tử.
- Liên kết ion: Được hình thành khi một nguyên tử chuyển hoàn toàn electron của mình sang một nguyên tử khác, tạo ra ion dương và ion âm. Các ion này sau đó hút nhau bằng lực tĩnh điện mạnh.
- Độ bền liên kết:
- Liên kết phân cực: Độ bền của liên kết phân cực phụ thuộc vào mức độ phân cực, tức là sự chênh lệch độ âm điện giữa các nguyên tử liên kết. Liên kết phân cực có thể bị phá vỡ trong các điều kiện phản ứng nhất định.
- Liên kết ion: Liên kết ion thường mạnh hơn liên kết phân cực do lực hút tĩnh điện mạnh giữa các ion. Tuy nhiên, chúng có thể bị phá vỡ trong dung dịch nước, khi các ion bị phân ly.
- Tính chất vật lý:
- Liên kết phân cực: Các hợp chất có liên kết phân cực thường có nhiệt độ nóng chảy và sôi trung bình, chúng cũng có khả năng hòa tan trong các dung môi phân cực.
- Liên kết ion: Các hợp chất ion thường có nhiệt độ nóng chảy và sôi cao, và chúng thường dễ tan trong nước, tạo ra các dung dịch điện ly có khả năng dẫn điện.
| Tiêu Chí | Liên Kết Phân Cực | Liên Kết Ion |
| Bản chất liên kết | Chia sẻ electron không đều | Chuyển giao hoàn toàn electron |
| Độ bền liên kết | Trung bình, phụ thuộc vào độ phân cực | Rất bền, dễ phân ly trong dung dịch |
| Tính chất vật lý | Nhiệt độ nóng chảy và sôi trung bình | Nhiệt độ nóng chảy và sôi cao |
Từ sự so sánh trên, có thể thấy rằng cả liên kết phân cực và liên kết ion đều có vai trò quan trọng trong việc hình thành và ổn định các hợp chất hóa học, tùy thuộc vào đặc điểm và điều kiện cụ thể của từng phản ứng.

4. Mối Quan Hệ Giữa Liên Kết Phân Cực và Tính Chất Vật Lý Của Chất
Liên kết phân cực ảnh hưởng trực tiếp đến tính chất vật lý của các chất, bao gồm độ tan, nhiệt độ nóng chảy, nhiệt độ sôi, và độ dẫn điện. Các yếu tố này có thể được hiểu rõ hơn thông qua việc phân tích cụ thể từng đặc điểm của liên kết phân cực.
- Độ tan: Các chất có liên kết phân cực thường tan tốt trong các dung môi phân cực như nước, nhờ vào sự tương tác giữa các cực của phân tử và dung môi.
- Nhiệt độ nóng chảy và nhiệt độ sôi: Liên kết phân cực mạnh tạo ra lực hút giữa các phân tử, làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của chất. Các chất phân cực có nhiệt độ sôi và nóng chảy cao hơn so với các chất không phân cực có khối lượng phân tử tương đương.
- Độ dẫn điện: Trong dung dịch, các chất phân cực có khả năng tạo ra ion, giúp dung dịch dẫn điện tốt. Đặc tính này được thể hiện rõ ràng trong các dung dịch muối và axit phân cực.
Để hiểu rõ hơn về mối quan hệ giữa liên kết phân cực và tính chất vật lý của chất, cần xem xét cụ thể từng trường hợp và điều kiện môi trường của các phản ứng hóa học liên quan.

5. Các Phương Pháp Xác Định Liên Kết Phân Cực
Để xác định liên kết phân cực trong một phân tử, các phương pháp sau đây thường được áp dụng. Mỗi phương pháp mang lại một góc nhìn khác nhau về bản chất của liên kết và giúp đưa ra những kết luận chính xác nhất về tính chất phân cực.
- Độ âm điện: Một trong những phương pháp cơ bản nhất để xác định liên kết phân cực là so sánh độ âm điện của các nguyên tố trong phân tử. Nếu độ chênh lệch độ âm điện giữa hai nguyên tố lớn hơn 0.4 và nhỏ hơn 1.7, liên kết giữa chúng có khả năng là phân cực. Ký hiệu \(\Delta EN\) thể hiện độ chênh lệch độ âm điện.
- Mômen lưỡng cực: Liên kết phân cực có thể được nhận biết thông qua giá trị mômen lưỡng cực, ký hiệu là \(\mu\). Mômen lưỡng cực thể hiện sự phân bố không đồng đều của điện tích trong phân tử. Mômen lưỡng cực càng lớn, độ phân cực của liên kết càng mạnh.
- Hình dạng phân tử: Hình dạng phân tử cũng đóng vai trò quan trọng trong việc xác định tính phân cực. Ví dụ, các phân tử có hình dạng bất đối xứng như hình chữ V hoặc hình tam giác sẽ có xu hướng phân cực do sự phân bố không đồng đều của các cặp điện tử không liên kết.
- Kết quả thực nghiệm: Các kết quả thực nghiệm như đo độ tan, nhiệt độ nóng chảy, và nhiệt độ sôi cũng cung cấp thông tin về tính phân cực của liên kết. Những chất có tính phân cực cao thường có nhiệt độ nóng chảy và sôi cao hơn, và dễ tan trong các dung môi phân cực.
Các phương pháp trên khi được sử dụng kết hợp sẽ giúp xác định chính xác và đầy đủ tính chất phân cực của liên kết trong các phân tử.
XEM THÊM:
6. Bài Tập và Lời Giải về Liên Kết Phân Cực
Phần này cung cấp các bài tập thực hành về liên kết phân cực nhằm giúp bạn củng cố kiến thức đã học. Mỗi bài tập đi kèm với lời giải chi tiết, giúp bạn hiểu rõ hơn về bản chất và đặc điểm của các liên kết phân cực.
- Bài tập 1: Xác định loại liên kết phân cực giữa các nguyên tử trong phân tử HCl. Sử dụng độ âm điện của các nguyên tố để xác định độ phân cực.
Lời giải: Độ âm điện của H là 2.1 và của Cl là 3.0. Chênh lệch độ âm điện \(\Delta EN = 3.0 - 2.1 = 0.9\), vì vậy liên kết H-Cl là liên kết phân cực.
- Bài tập 2: Dựa vào mômen lưỡng cực, giải thích tại sao phân tử nước (H₂O) có tính phân cực mạnh.
Lời giải: Phân tử nước có hình dạng gấp khúc, với mômen lưỡng cực \(\mu\) lớn do sự phân bố không đều của các cặp electron không liên kết. Điều này làm cho nước có tính phân cực mạnh.
- Bài tập 3: Cho phân tử CO₂, dựa vào cấu trúc và độ âm điện để xác định liệu CO₂ có phân cực hay không.
Lời giải: Mặc dù có sự chênh lệch độ âm điện giữa C và O, nhưng do cấu trúc phân tử CO₂ là đối xứng nên các mômen lưỡng cực triệt tiêu lẫn nhau, dẫn đến phân tử CO₂ không phân cực.
Các bài tập này giúp bạn nắm vững cách xác định và phân tích liên kết phân cực, hỗ trợ trong việc học và ứng dụng kiến thức vào thực tế.