Chủ đề bảng độ phân cực của các dung môi: Bài viết này cung cấp thông tin chi tiết về bảng độ phân cực của các dung môi, từ khái niệm cơ bản đến ứng dụng trong thực tiễn. Khám phá những yếu tố ảnh hưởng, cách đo lường, và cách chọn dung môi phù hợp cho các phản ứng hóa học. Đây là tài liệu không thể bỏ qua cho những ai quan tâm đến lĩnh vực hóa học.
Mục lục
- Bảng Độ Phân Cực Của Các Dung Môi
- Mục Lục Tổng Hợp Về Bảng Độ Phân Cực Của Các Dung Môi
- Dạng Bài Tập Hóa Học Về Độ Phân Cực
- Bài Tập 1: Xác Định Độ Phân Cực Của Một Số Hợp Chất
- Bài Tập 2: So Sánh Độ Phân Cực Của Dung Môi A Và Dung Môi B
- Bài Tập 3: Phân Tích Ảnh Hưởng Của Độ Phân Cực Đến Phản Ứng SN1
- Bài Tập 4: Tính Toán Nhiệt Độ Sôi Dựa Trên Độ Phân Cực
- Bài Tập 5: Ứng Dụng Độ Phân Cực Trong Quá Trình Chiết
- Bài Tập 6: Xác Định Loại Dung Môi Phù Hợp Cho Phản Ứng SN2
- Bài Tập 7: Xác Định Độ Phân Cực Của Hợp Chất Thông Qua Cấu Trúc
- Bài Tập 8: Phân Tích Tác Động Của Độ Phân Cực Đến Hằng Số Điện Môi
- Bài Tập 9: Tính Toán Sự Ổn Định Của Sản Phẩm Dựa Trên Độ Phân Cực
- Bài Tập 10: So Sánh Độ Phân Cực Của Các Dung Môi Protic Và Aprotic
Bảng Độ Phân Cực Của Các Dung Môi
Bảng độ phân cực của các dung môi là công cụ quan trọng trong hóa học, giúp xác định tính chất phân cực của các dung môi khác nhau. Độ phân cực của dung môi có thể ảnh hưởng đến khả năng hòa tan của chất khác trong dung môi đó, từ đó ứng dụng trong các lĩnh vực như hóa hữu cơ, phân tích hóa học và nhiều lĩnh vực khác. Dưới đây là bảng độ phân cực của một số dung môi phổ biến.
Danh Sách Dung Môi và Độ Phân Cực
| Dung Môi | Công Thức Hóa Học | Nhiệt Độ Sôi (°C) | Độ Phân Cực (Debye) |
|---|---|---|---|
| Tetrahydrofuran (THF) | \(\text{CH}_2\text{CH}_2\text{OCH}_2\text{CH}_2\) | 66 | 1.75 |
| Acetone | \(\text{CH}_3\text{COCH}_3\) | 56 | 2.88 |
| Dimethylformamide (DMF) | \(\text{HCON(CH}_3\text{)}_2\) | 153 | 3.82 |
| Acetonitrile (MeCN) | \(\text{CH}_3\text{CN}\) | 82 | 3.92 |
| Dimethyl Sulfoxide (DMSO) | \(\text{CH}_3\text{SOCH}_3\) | 189 | 3.96 |
| Nước | \(\text{H}_2\text{O}\) | 100 | 1.85 |
Phân Loại Dung Môi Theo Tính Phân Cực
- Dung Môi Phân Cực Aprotic: Các dung môi không có khả năng tạo liên kết hydro nhưng có mô-men lưỡng cực mạnh, ví dụ: Acetonitrile, Dimethylformamide.
- Dung Môi Phân Cực Protic: Các dung môi có khả năng tạo liên kết hydro, ví dụ: Nước, Metanol, Etanol.
- Dung Môi Không Phân Cực: Các dung môi không có hoặc có mô-men lưỡng cực rất thấp, ví dụ: Hexane, Benzen.
Ứng Dụng Của Độ Phân Cực Trong Thực Tiễn
Độ phân cực của dung môi đóng vai trò quan trọng trong việc lựa chọn dung môi phù hợp cho các phản ứng hóa học, quá trình tách chiết, và phân tích. Ví dụ, dung môi phân cực aprotic thường được sử dụng trong phản ứng SN2 vì chúng ổn định anion và không tương tác với nucleophile. Trong khi đó, dung môi phân cực protic thích hợp cho phản ứng SN1 vì chúng có khả năng ổn định ion carbocation.
Kết Luận
Bảng độ phân cực của các dung môi là công cụ hữu ích cho các nhà hóa học trong việc lựa chọn và tối ưu hóa các quy trình hóa học. Hiểu rõ độ phân cực của dung môi không chỉ giúp cải thiện hiệu quả phản ứng mà còn đảm bảo an toàn và hiệu quả trong các ứng dụng thực tế.

.png)
Mục Lục Tổng Hợp Về Bảng Độ Phân Cực Của Các Dung Môi
Độ phân cực của các dung môi là một yếu tố quan trọng trong nhiều ứng dụng khoa học và công nghiệp. Bài viết này sẽ cung cấp cho bạn cái nhìn tổng quan về bảng độ phân cực của các dung môi phổ biến, giúp bạn hiểu rõ hơn về tính chất hóa học của chúng và ứng dụng trong các lĩnh vực khác nhau.
- 1. Giới Thiệu Về Độ Phân Cực Của Dung Môi:
Độ phân cực của dung môi đề cập đến sự phân bố điện tích trong phân tử, ảnh hưởng đến khả năng hòa tan của dung môi với các chất khác. Các dung môi có độ phân cực cao thường hòa tan tốt trong nước và các dung môi có độ phân cực thấp thường hòa tan tốt trong dầu.
- 2. Phân Loại Dung Môi Theo Độ Phân Cực:
Các dung môi được phân thành hai nhóm chính: dung môi phân cực và dung môi không phân cực. Mỗi loại có ứng dụng và đặc tính riêng biệt:
- Dung Môi Phân Cực: Nước, methanol, acetone, acetonitrile.
- Dung Môi Không Phân Cực: Hexane, toluene, chloroform, ether.
- 3. Bảng Độ Phân Cực Của Một Số Dung Môi Thông Dụng:
Dung Môi Công Thức Hóa Học Độ Phân Cực Nước \(H_2O\) 2.7 Methanol \(CH_3OH\) 5.1 Acetone \(C_3H_6O\) 5.4 Hexane \(C_6H_{14}\) 0.0 - 4. Ứng Dụng Của Các Dung Môi Theo Độ Phân Cực:
Dựa trên độ phân cực, các dung môi được sử dụng trong các quy trình công nghệ khác nhau. Ví dụ, dung môi phân cực như methanol thường được dùng trong ngành hóa dược, trong khi các dung môi không phân cực như hexane được dùng trong công nghiệp dầu mỏ.
- 5. Kết Luận:
Bảng độ phân cực của các dung môi là công cụ hữu ích trong nghiên cứu và ứng dụng thực tiễn. Việc lựa chọn dung môi phù hợp dựa trên độ phân cực không chỉ giúp tối ưu hóa quá trình phản ứng mà còn đảm bảo hiệu quả và an toàn trong sản xuất công nghiệp.
Dạng Bài Tập Hóa Học Về Độ Phân Cực
Độ phân cực của các dung môi là một khái niệm quan trọng trong hóa học, đặc biệt khi nghiên cứu về các phản ứng hóa học và tính chất của các chất tan trong dung môi. Việc hiểu rõ về độ phân cực giúp chúng ta giải quyết được nhiều dạng bài tập liên quan đến dung môi và phản ứng hóa học. Dưới đây là một số dạng bài tập phổ biến:
- Xác định loại dung môi: Cho biết công thức phân tử và yêu cầu xác định dung môi là phân cực hay không phân cực. Ví dụ: CH₃OH là dung môi phân cực.
- Phân loại theo độ phân cực: Dựa vào cấu trúc hóa học, hãy phân loại các dung môi thành dung môi phân cực protic, dung môi phân cực aprotic và dung môi không phân cực.
- Ảnh hưởng của dung môi lên phản ứng: Giải thích tại sao dung môi phân cực lại có khả năng ảnh hưởng đến tốc độ và cơ chế của phản ứng SN1 và SN2.
- Tính toán độ phân cực: Sử dụng công thức và dữ liệu đã cho để tính toán độ phân cực của một số dung môi nhất định.
- Thực nghiệm về độ phân cực: Thực hiện một thí nghiệm đơn giản để xác định độ phân cực của một dung môi, sau đó giải thích kết quả dựa trên lý thuyết.
Những dạng bài tập này không chỉ giúp học sinh nắm vững lý thuyết về độ phân cực mà còn rèn luyện kỹ năng áp dụng vào các tình huống thực tiễn, từ đó củng cố kiến thức một cách hiệu quả.
| Dung Môi | Loại Dung Môi | Độ Phân Cực |
|---|---|---|
| Nước (H₂O) | Phân cực protic | Cao |
| Acetone (CH₃COCH₃) | Phân cực aprotic | Trung bình |
| Hexane (C₆H₁₄) | Không phân cực | Thấp |

Bài Tập 1: Xác Định Độ Phân Cực Của Một Số Hợp Chất
Trong bài tập này, chúng ta sẽ đi sâu vào việc xác định độ phân cực của một số hợp chất dựa trên các đặc tính hóa học của chúng. Đây là một kỹ năng quan trọng trong hóa học, giúp chúng ta hiểu rõ hơn về cách các phân tử tương tác với nhau.
Bước 1: Xác định loại dung môi
- Xác định xem hợp chất là dung môi phân cực hay không phân cực. Điều này có thể thực hiện bằng cách kiểm tra hằng số điện môi của hợp chất đó.
- Nếu hằng số điện môi lớn hơn 15, hợp chất đó là dung môi phân cực. Nếu nhỏ hơn 15, đó là dung môi không phân cực.
Bước 2: Xác định độ phân cực của hợp chất
- Sử dụng cấu trúc phân tử để xác định sự phân bố điện tích trong phân tử.
- Nếu các nguyên tử trong phân tử có sự chênh lệch lớn về độ âm điện, hợp chất sẽ có momen lưỡng cực và được coi là phân cực.
- Ví dụ, nước (H2O) có độ âm điện cao giữa oxy và hydro, dẫn đến sự phân cực mạnh.
Bước 3: Áp dụng vào thực tế
Áp dụng kiến thức về độ phân cực để giải quyết các bài tập liên quan đến hòa tan, pha chế, và tương tác giữa các hợp chất trong dung dịch. Khả năng hòa tan của một chất trong dung môi phụ thuộc rất nhiều vào tính chất phân cực của cả hai chất đó.
Bài tập mẫu:
Xác định xem các hợp chất sau đây có phân cực hay không: Methanol (CH3OH), Benzene (C6H6), Acetone (CH3COCH3).
- Methanol: Phân cực vì có liên kết hydro giữa oxy và hydro.
- Benzene: Không phân cực do cấu trúc vòng và sự phân bố đều của các điện tử.
- Acetone: Phân cực do nhóm carbonyl (C=O) tạo ra momen lưỡng cực.
Bằng cách làm quen với các bài tập này, bạn sẽ nắm vững hơn về cách xác định độ phân cực của các hợp chất và ứng dụng chúng trong các bài toán hóa học thực tế.
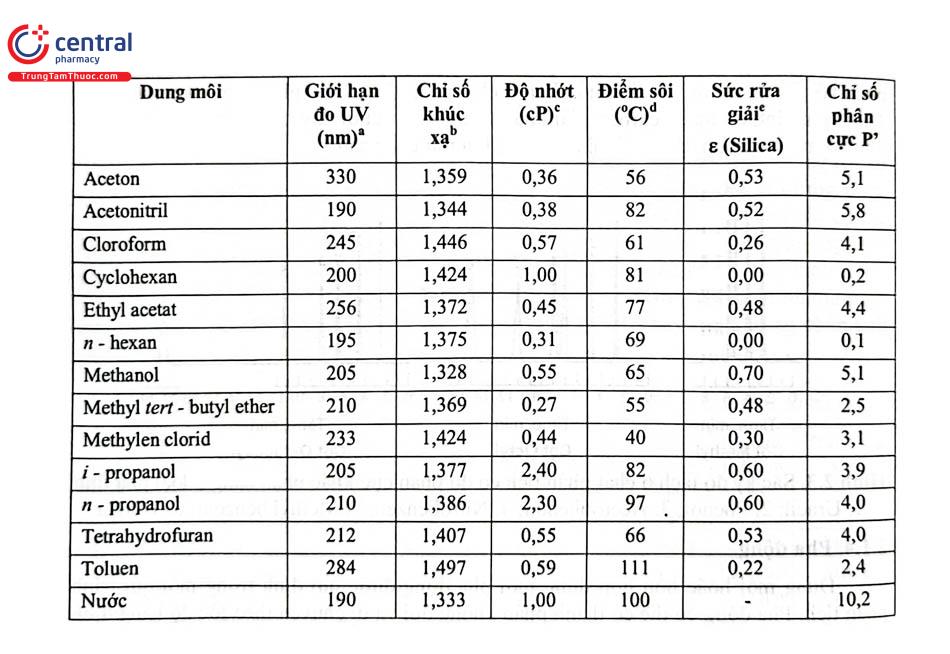
XEM THÊM:
Bài Tập 2: So Sánh Độ Phân Cực Của Dung Môi A Và Dung Môi B
Trong bài tập này, chúng ta sẽ tiến hành so sánh độ phân cực của hai dung môi, cụ thể là Dung Môi A và Dung Môi B. Độ phân cực của dung môi là một yếu tố quan trọng quyết định khả năng hòa tan các chất trong dung môi đó. Hãy bắt đầu với một số bước cơ bản để xác định và so sánh độ phân cực.
-
Bước 1: Xác định hằng số điện môi của các dung môi
Hằng số điện môi \(\varepsilon\) là một thước đo quan trọng phản ánh độ phân cực của dung môi. Bạn có thể tìm thấy hằng số điện môi của nhiều dung môi trong các bảng số liệu. Ví dụ:
Dung Môi A 20.7 Dung Môi B 37.5 Dung môi có hằng số điện môi lớn hơn thường có độ phân cực cao hơn.
-
Bước 2: So sánh mômen lưỡng cực
Mômen lưỡng cực của một dung môi cũng là một chỉ số quan trọng để xác định độ phân cực. Mômen lưỡng cực càng lớn thì dung môi càng phân cực. Chúng ta có thể so sánh mômen lưỡng cực của Dung Môi A và Dung Môi B như sau:
Dung Môi A 2.88 D Dung Môi B 3.92 D Từ bảng trên, có thể thấy rằng Dung Môi B có mômen lưỡng cực lớn hơn, cho thấy nó phân cực mạnh hơn so với Dung Môi A.
-
Bước 3: Kết luận
Từ các thông số trên, chúng ta có thể kết luận rằng Dung Môi B có độ phân cực cao hơn Dung Môi A, nhờ vào hằng số điện môi và mômen lưỡng cực lớn hơn.

Bài Tập 3: Phân Tích Ảnh Hưởng Của Độ Phân Cực Đến Phản Ứng SN1
Phản ứng SN1 (Substitution Nucleophilic Unimolecular) là một loại phản ứng thế trong hóa học hữu cơ, đặc biệt chịu ảnh hưởng lớn bởi độ phân cực của dung môi. Dưới đây là phân tích chi tiết về cách độ phân cực của dung môi ảnh hưởng đến phản ứng SN1:
- Bước 1: Sự tách rời của nhóm rời
- Bước 2: Ảnh hưởng của dung môi phân cực
- Bước 3: So sánh với dung môi không phân cực
- Kết luận
Trong phản ứng SN1, bước đầu tiên là sự tách rời của nhóm rời (leaving group) để tạo ra một ion cacbocation. Dung môi phân cực có thể ổn định ion này bằng cách tương tác với các điện tích dương của cacbocation, qua đó làm giảm năng lượng kích hoạt của bước này.
Dung môi phân cực, đặc biệt là các dung môi có khả năng tạo liên kết hydro, sẽ tương tác mạnh mẽ với cacbocation, qua đó làm tăng tốc độ phản ứng SN1. Ví dụ, nước (H2O) hoặc ethanol (C2H5OH) là những dung môi thường được sử dụng để thúc đẩy phản ứng này do khả năng hòa tan và ổn định các ion trong dung dịch.
Ngược lại, trong môi trường dung môi không phân cực, phản ứng SN1 diễn ra chậm hơn đáng kể. Điều này do dung môi không phân cực không cung cấp được môi trường ổn định cho sự hình thành của cacbocation, do đó năng lượng kích hoạt cần thiết cho phản ứng cao hơn.
Như vậy, có thể thấy rằng độ phân cực của dung môi đóng vai trò quan trọng trong việc điều chỉnh tốc độ và hiệu quả của phản ứng SN1. Việc lựa chọn dung môi thích hợp có thể tối ưu hóa phản ứng, làm giảm năng lượng kích hoạt và tăng hiệu suất sản phẩm mong muốn.
Bài tập yêu cầu các bạn phân tích và so sánh tốc độ phản ứng SN1 trong các dung môi phân cực và không phân cực để hiểu rõ hơn về cơ chế của phản ứng này.
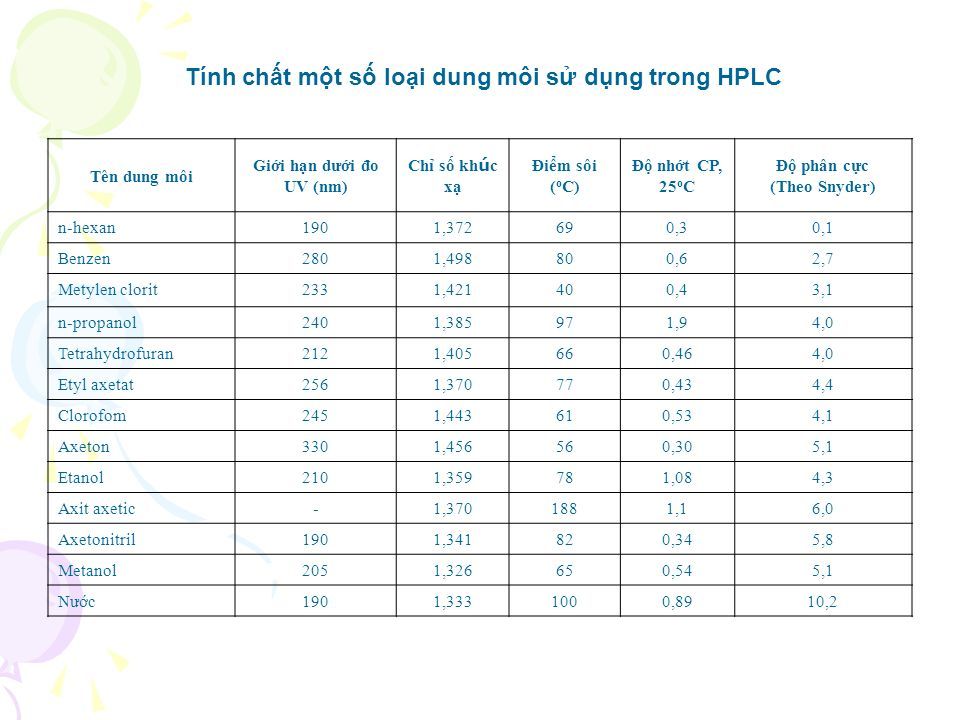
Bài Tập 4: Tính Toán Nhiệt Độ Sôi Dựa Trên Độ Phân Cực
Trong bài tập này, chúng ta sẽ tiến hành tính toán nhiệt độ sôi của các chất dựa trên độ phân cực của chúng. Độ phân cực của dung môi là một yếu tố quan trọng ảnh hưởng đến các tính chất vật lý, đặc biệt là nhiệt độ sôi.
1. Bảng Độ Phân Cực của Các Dung Môi
Trước khi thực hiện tính toán, chúng ta cần xem xét bảng độ phân cực của một số dung môi thông dụng:
| Dung Môi | Công Thức Hóa Học | Độ Phân Cực |
|---|---|---|
| Nước | \[ H_2O \] | 1.85 D |
| Etanol | \[ C_2H_5OH \] | 1.69 D |
| Aceton | \[ CH_3COCH_3 \] | 2.88 D |
| Xylen | \[ C_8H_{10} \] | 0.07 D |
| Toluene | \[ C_7H_8 \] | 0.36 D |
2. Công Thức Tính Nhiệt Độ Sôi
Nhiệt độ sôi của một chất có thể được tính toán bằng cách sử dụng công thức Clausius-Clapeyron:
Trong đó:
- \(P_1, P_2\) là áp suất của chất tại nhiệt độ \(T_1, T_2\) tương ứng.
- \(\Delta H_{vap}\) là nhiệt hóa hơi của chất (J/mol).
- \(R\) là hằng số khí lý tưởng (\(8.314 J/(mol·K)\)).
- \(T_1, T_2\) là nhiệt độ tuyệt đối (Kelvin).
3. Ví Dụ Cụ Thể
Giả sử chúng ta muốn tính toán nhiệt độ sôi của Etanol trong điều kiện khí quyển tiêu chuẩn. Biết rằng độ phân cực của Etanol là 1.69 D và nhiệt hóa hơi của Etanol là 38.56 kJ/mol, chúng ta có thể áp dụng công thức trên để tìm ra nhiệt độ sôi tương ứng.
4. Kết Luận
Qua bài tập này, chúng ta thấy rằng độ phân cực của dung môi có ảnh hưởng trực tiếp đến nhiệt độ sôi của nó. Những dung môi có độ phân cực cao thường có nhiệt độ sôi cao hơn do lực tương tác giữa các phân tử mạnh hơn, đòi hỏi nhiều năng lượng hơn để phá vỡ liên kết và chuyển sang pha khí.
Bài Tập 5: Ứng Dụng Độ Phân Cực Trong Quá Trình Chiết
Độ phân cực của dung môi đóng vai trò quan trọng trong quá trình chiết, ảnh hưởng đến khả năng hòa tan các hợp chất khác nhau. Trong bài tập này, chúng ta sẽ áp dụng kiến thức về độ phân cực để tính toán và tối ưu hóa quá trình chiết các chất tan.
Bước 1: Xác định độ phân cực của các dung môi sử dụng trong quá trình chiết. Độ phân cực có thể được biểu thị bằng hằng số điện môi (\(\epsilon\)). Dung môi có hằng số điện môi càng cao, độ phân cực càng lớn.
- Ví dụ: Nước có hằng số điện môi là 80,10, cho thấy đây là dung môi phân cực mạnh.
- Dung môi không phân cực như hexan có hằng số điện môi chỉ là 1,88.
Bước 2: Lựa chọn dung môi thích hợp dựa trên tính chất phân cực của chất tan cần chiết. Các chất tan phân cực thường hòa tan tốt trong dung môi phân cực, và ngược lại.
- Nếu chất cần chiết là phân cực (ví dụ như muối), hãy chọn dung môi phân cực như nước hoặc ethanol.
- Nếu chất cần chiết là không phân cực (ví dụ như dầu), hãy chọn dung môi không phân cực như hexan.
Bước 3: Tiến hành chiết và theo dõi hiệu suất chiết dựa trên sự hòa tan của chất tan trong dung môi. Hiệu suất chiết phụ thuộc vào mức độ tương hợp giữa độ phân cực của dung môi và chất tan.
Bước 4: Tối ưu hóa quá trình chiết bằng cách điều chỉnh tỷ lệ giữa các dung môi hoặc thay đổi nhiệt độ để tăng cường khả năng hòa tan.
Kết quả thu được sẽ cho thấy sự ảnh hưởng trực tiếp của độ phân cực dung môi đến hiệu suất chiết, giúp tối ưu hóa các quá trình chiết trong thực tế.

Bài Tập 6: Xác Định Loại Dung Môi Phù Hợp Cho Phản Ứng SN2
Trong phản ứng SN2 (Substitution Nucleophilic Bimolecular), lựa chọn dung môi là yếu tố quan trọng để đảm bảo hiệu quả của quá trình. Phản ứng SN2 thường ưu tiên các dung môi không phân cực và dung môi aprotic để tăng cường khả năng tấn công của tác nhân nucleophile. Để xác định loại dung môi phù hợp cho phản ứng SN2, bạn cần nắm vững các nguyên tắc sau:
-
Chọn dung môi không có nhóm –OH hoặc –NH:
Các dung môi protic như methanol (CH3OH) hoặc nước (H2O) thường tạo liên kết hydrogen với nucleophile, làm giảm khả năng phản ứng của nó. Ngược lại, dung môi aprotic như acetonitrile (CH3CN) không hình thành liên kết hydrogen, giúp tăng cường hiệu quả phản ứng SN2.
-
Xem xét tính phân cực của dung môi:
Độ phân cực của dung môi ảnh hưởng lớn đến sự ổn định của trạng thái chuyển tiếp trong phản ứng SN2. Các dung môi có độ phân cực cao thường ổn định trạng thái chuyển tiếp, từ đó làm tăng tốc độ phản ứng. Một số dung môi phổ biến cho phản ứng SN2 là acetonitrile (ACN), dimethyl sulfoxide (DMSO), và acetone (C3H6O).
-
Kiểm tra bảng độ phân cực của các dung môi:
Để chọn dung môi phù hợp, bạn nên tham khảo bảng độ phân cực của các dung môi thường dùng. Ví dụ, độ phân cực của acetonitrile cao hơn so với methanol, giúp tăng cường khả năng phản ứng của nucleophile trong môi trường này.
-
Thử nghiệm thực tế:
Sau khi xác định dung môi tiềm năng dựa trên lý thuyết, bạn nên tiến hành thử nghiệm thực tế để kiểm tra hiệu quả của dung môi trong phản ứng cụ thể của mình. Điều này giúp tối ưu hóa điều kiện phản ứng và đảm bảo kết quả mong muốn.
Với các nguyên tắc trên, bạn sẽ có thể xác định loại dung môi phù hợp nhất cho phản ứng SN2 của mình, đảm bảo quá trình diễn ra hiệu quả và đạt được kết quả tốt nhất.
Bài Tập 7: Xác Định Độ Phân Cực Của Hợp Chất Thông Qua Cấu Trúc
Trong bài tập này, chúng ta sẽ học cách xác định độ phân cực của một hợp chất hóa học thông qua cấu trúc phân tử của nó. Độ phân cực của hợp chất là một yếu tố quan trọng quyết định khả năng hòa tan trong các dung môi khác nhau và ảnh hưởng đến tính chất hóa học của hợp chất đó.
1. Các Yếu Tố Quyết Định Độ Phân Cực
- Độ Âm Điện: Độ phân cực thường được quyết định bởi sự chênh lệch độ âm điện giữa các nguyên tử trong phân tử. Nếu có sự chênh lệch lớn, liên kết giữa các nguyên tử sẽ trở nên phân cực.
- Hình Dạng Phân Tử: Cấu trúc không đối xứng của phân tử cũng có thể tạo ra một moment lưỡng cực, làm cho phân tử trở nên phân cực. Ví dụ, nước (H2O) là một phân tử có độ phân cực cao do cấu trúc hình góc của nó.
- Moment Lưỡng Cực: Moment lưỡng cực \(\vec{μ}\) được tính toán dựa trên sản phẩm của điện tích và khoảng cách giữa các tâm điện tích. Moment lưỡng cực càng lớn, độ phân cực của phân tử càng cao.
2. Phân Tích Độ Phân Cực Thông Qua Ví Dụ Cụ Thể
Hãy xét phân tử chloromethane (CH3Cl). Đây là một ví dụ điển hình của một phân tử phân cực:
- Nguyên tử Cl có độ âm điện cao hơn C, do đó, liên kết C-Cl sẽ có sự phân cực với Cl mang điện tích âm và C mang điện tích dương.
- Cấu trúc phân tử không đối xứng, dẫn đến việc tạo ra một moment lưỡng cực dọc theo trục C-Cl.
Do đó, CH3Cl là một phân tử phân cực, và nó sẽ hòa tan tốt trong các dung môi phân cực như nước.
3. Bài Tập Thực Hành
Hãy xác định độ phân cực của các hợp chất sau dựa trên cấu trúc của chúng:
- CO2 (carbon dioxide)
- NH3 (ammonia)
- CH3OH (methanol)
Gợi ý: Hãy xem xét cả độ âm điện và hình dạng của phân tử để xác định độ phân cực của chúng.
Kết quả bài tập sẽ giúp bạn hiểu rõ hơn về cách độ phân cực của phân tử ảnh hưởng đến tính chất hóa học và khả năng hòa tan của nó trong các dung môi khác nhau.
Bài Tập 8: Phân Tích Tác Động Của Độ Phân Cực Đến Hằng Số Điện Môi
Trong bài tập này, chúng ta sẽ phân tích mối quan hệ giữa độ phân cực của các dung môi và hằng số điện môi của chúng. Hằng số điện môi (kí hiệu là \(\varepsilon\)) là một đại lượng đặc trưng cho khả năng của một chất làm giảm cường độ điện trường trong nó. Độ phân cực cao thường liên quan đến hằng số điện môi cao, vì các phân tử có cực tính mạnh có thể tạo ra hiệu ứng che chắn đối với điện trường.
1. Định nghĩa và tầm quan trọng của hằng số điện môi
- Hằng số điện môi (\(\varepsilon\)): Là thước đo khả năng một vật liệu có thể làm giảm cường độ của một điện trường trong nó. Được tính bằng tỉ lệ giữa cường độ điện trường trong chân không và trong chất đó.
- Tầm quan trọng: Hằng số điện môi đóng vai trò quan trọng trong việc dự đoán hành vi của các phân tử trong các dung môi khác nhau và trong quá trình điện li.
2. Mối quan hệ giữa độ phân cực và hằng số điện môi
Độ phân cực và hằng số điện môi có mối quan hệ mật thiết với nhau. Các phân tử phân cực có moment lưỡng cực cao, dẫn đến khả năng tương tác mạnh với điện trường và do đó có hằng số điện môi cao hơn. Các dung môi phân cực, như nước (\(\varepsilon \approx 80\)), có khả năng hòa tan các chất ion tốt hơn so với các dung môi không phân cực.
3. Các bước phân tích tác động của độ phân cực đến hằng số điện môi
- Xác định độ phân cực của dung môi thông qua cấu trúc phân tử và moment lưỡng cực.
- Đo hằng số điện môi của dung môi bằng cách sử dụng các phương pháp đo đạc như sử dụng tụ điện.
- So sánh các giá trị hằng số điện môi với độ phân cực của dung môi để xác định mối quan hệ tương quan.
- Đưa ra kết luận về ảnh hưởng của độ phân cực đến hằng số điện môi dựa trên kết quả so sánh.
4. Ví dụ minh họa
| Dung Môi | Độ Phân Cực | Hằng Số Điện Môi (\(\varepsilon\)) |
| Nước | Rất cao | 80 |
| Metanol | Cao | 33 |
| Benzen | Thấp | 2.3 |
| Hexan | Rất thấp | 1.9 |
5. Kết luận
Qua bảng trên, chúng ta thấy rằng độ phân cực của dung môi càng cao, thì hằng số điện môi cũng càng cao. Điều này cho thấy rằng các dung môi phân cực mạnh có khả năng làm giảm cường độ của điện trường trong chúng nhiều hơn, điều này quan trọng trong các ứng dụng hóa học và công nghiệp, nơi sự lựa chọn dung môi có thể ảnh hưởng đến kết quả của các phản ứng hóa học.
Bài Tập 9: Tính Toán Sự Ổn Định Của Sản Phẩm Dựa Trên Độ Phân Cực
Độ phân cực của dung môi là một yếu tố quan trọng trong việc tính toán và đánh giá sự ổn định của sản phẩm hóa học. Các dung môi có thể được phân loại thành dung môi phân cực và dung môi không phân cực dựa trên hằng số điện môi của chúng. Để thực hiện bài tập này, chúng ta sẽ sử dụng bảng độ phân cực của các dung môi để xác định sự ổn định của sản phẩm khi kết hợp với các dung môi khác nhau.
1. Khái niệm về Độ Phân Cực của Dung Môi
- Độ phân cực được xác định bởi hằng số điện môi của dung môi, giá trị này cho biết mức độ mà dung môi có thể hòa tan các chất khác dựa trên momen lưỡng cực.
- Dung môi phân cực thường có hằng số điện môi lớn hơn 15 và có khả năng hòa tan tốt các chất có tính chất phân cực.
- Dung môi không phân cực có hằng số điện môi nhỏ hơn 15 và thích hợp cho việc hòa tan các chất không phân cực.
2. Bảng Độ Phân Cực của Các Dung Môi Thông Dụng
| Dung Môi | Công Thức Hóa Học | Độ Phân Cực |
|---|---|---|
| Nước | H2O | Rất phân cực (hằng số điện môi ≈ 80) |
| Metanol | CH3OH | Phân cực (hằng số điện môi ≈ 33) |
| Benzen | C6H6 | Không phân cực (hằng số điện môi ≈ 2.3) |
| Aceton | (CH3)2CO | Phân cực (hằng số điện môi ≈ 21) |
3. Các Bước Tính Toán Sự Ổn Định Dựa Trên Độ Phân Cực
- Xác định dung môi đang được sử dụng: Đầu tiên, kiểm tra thành phần dung môi của sản phẩm và ghi lại các thông số cần thiết như hằng số điện môi.
- So sánh độ phân cực: Sử dụng bảng trên để so sánh độ phân cực của dung môi đã chọn với các chất hòa tan trong sản phẩm. Ví dụ, nếu sản phẩm chứa các hợp chất phân cực, hãy chọn dung môi có độ phân cực cao để đảm bảo sự hòa tan tối ưu.
- Tính toán khả năng hòa tan: Áp dụng các công thức vật lý và hóa học để tính toán sự hòa tan và phân tán của các thành phần trong sản phẩm. Các công thức có thể bao gồm: \[ \text{Khả năng hòa tan} = f(\text{Độ phân cực}, \text{Nhiệt độ}, \text{Áp suất}) \]
- Đánh giá sự ổn định: Dựa trên các tính toán, đánh giá xem sản phẩm có ổn định không và có cần thay đổi dung môi để cải thiện tính chất của sản phẩm hay không.
Bằng cách áp dụng các bước này, chúng ta có thể đảm bảo rằng sự ổn định của sản phẩm được tối ưu hóa thông qua việc chọn lựa và sử dụng đúng loại dung môi phù hợp với tính chất phân cực của chúng.
Bài Tập 10: So Sánh Độ Phân Cực Của Các Dung Môi Protic Và Aprotic
Trong hóa học, dung môi được chia thành hai loại chính dựa trên khả năng phân cực: dung môi protic và dung môi aprotic. Việc hiểu rõ sự khác biệt về độ phân cực giữa chúng là quan trọng để ứng dụng trong các phản ứng hóa học cụ thể. Bài tập này sẽ hướng dẫn bạn cách so sánh độ phân cực của các dung môi protic và aprotic thông qua các đặc điểm cơ bản sau đây:
- Dung môi Protic: Là các dung môi có khả năng hình thành liên kết hydro với chất tan nhờ vào sự hiện diện của nhóm -OH hoặc -NH. Các dung môi này có khả năng hòa tan tốt các chất phân cực và ion. Ví dụ điển hình của dung môi protic bao gồm nước (\(H_2O\)) và methanol (\(CH_3OH\)). Độ phân cực cao của chúng giúp tăng cường khả năng hòa tan các chất mang điện tích âm.
- Dung môi Aprotic: Không có khả năng tạo liên kết hydro, nhưng vẫn có thể có momen lưỡng cực mạnh. Chúng thường hòa tan tốt các chất có tính phân cực cao nhưng không có khả năng hình thành ion. Ví dụ về dung môi aprotic là acetone (\(CH_3COCH_3\)) và dichloromethane (\(CH_2Cl_2\)). Dung môi aprotic thường được sử dụng trong các phản ứng mà sự tạo thành liên kết hydro không mong muốn.
Để so sánh độ phân cực, chúng ta có thể dựa vào hằng số điện môi (\(\epsilon\)), là chỉ số đo mức độ một chất có khả năng giảm điện trường của môi trường xung quanh:
| Dung Môi | Loại | Hằng Số Điện Môi (\(\epsilon\)) |
|---|---|---|
| Nước (\(H_2O\)) | Protic | 80.1 |
| Methanol (\(CH_3OH\)) | Protic | 33.0 |
| Acetone (\(CH_3COCH_3\)) | Aprotic | 20.7 |
| Dichloromethane (\(CH_2Cl_2\)) | Aprotic | 8.9 |
Các dữ liệu trên cho thấy dung môi protic thường có hằng số điện môi cao hơn so với dung môi aprotic. Điều này minh chứng rằng dung môi protic có khả năng tương tác mạnh với các phân tử phân cực khác, làm tăng sự hòa tan của chúng. Dung môi aprotic, mặc dù có momen lưỡng cực, thường ít hòa tan các chất tan có tính ion hơn so với dung môi protic.
Bài tập: Sử dụng bảng trên để phân tích và so sánh độ hòa tan của các chất tan trong các dung môi khác nhau, đồng thời giải thích sự ổn định của sản phẩm trong mỗi dung môi.



















