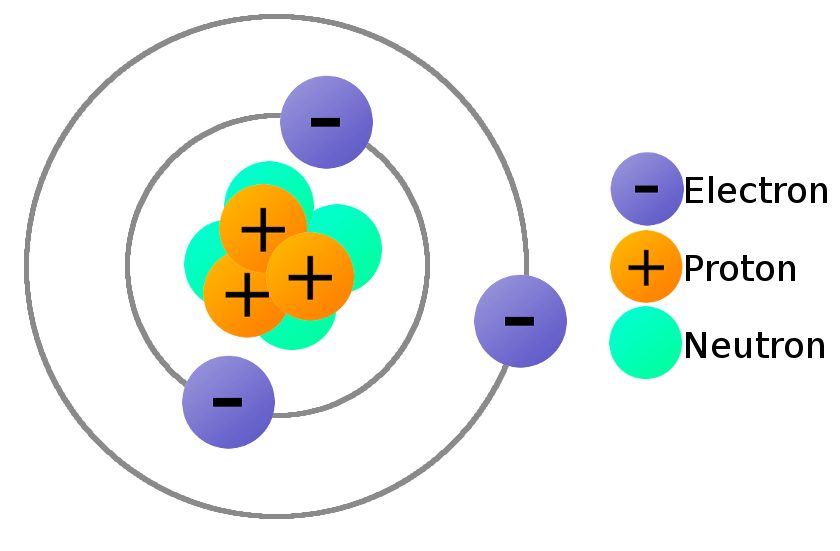
Chủ đề định luật bảo toàn electron là gì: Định luật bảo toàn electron là một nguyên lý quan trọng trong hóa học, đặc biệt là trong các phản ứng oxi hóa - khử. Bài viết này sẽ giúp bạn hiểu rõ hơn về khái niệm, cách áp dụng định luật này trong cân bằng phương trình hóa học, cũng như khám phá những ứng dụng thực tế của nó trong nhiều lĩnh vực khoa học và công nghệ.
Mục lục
Định Luật Bảo Toàn Electron
Định luật bảo toàn electron là một nguyên lý cơ bản trong hóa học, đặc biệt là trong các phản ứng oxi hóa - khử. Nguyên lý này phát biểu rằng tổng số electron được nhường bởi chất khử phải bằng tổng số electron nhận được bởi chất oxi hóa trong một phản ứng hóa học.
Nguyên Lý Hoạt Động
Trong một phản ứng hóa học, các electron không tự sinh ra hay mất đi, mà chỉ chuyển từ chất này sang chất khác. Định luật bảo toàn electron giúp cân bằng các phương trình hóa học và đảm bảo rằng tổng số electron trước và sau phản ứng là bằng nhau.
Các Bước Cân Bằng Phản Ứng Oxi Hóa - Khử
- Xác định chất oxi hóa và chất khử trong phản ứng.
- Viết các phương trình bán phản ứng cho quá trình oxi hóa và khử.
- Sử dụng định luật bảo toàn electron để thiết lập phương trình cân bằng số electron nhường và nhận.
- Cân bằng các nguyên tố khác và hoàn chỉnh phương trình hóa học.
Ví Dụ Minh Họa
Xét phản ứng giữa kẽm và ion đồng:
\[
\text{Zn} + \text{Cu}^{2+} \rightarrow \text{Zn}^{2+} + \text{Cu}
\]
Trong phản ứng này, kẽm (Zn) nhường 2 electron để trở thành ion kẽm (Zn2+), trong khi ion đồng (Cu2+) nhận 2 electron để trở thành đồng kim loại (Cu). Tổng số electron nhường và nhận đều bằng 2, tuân thủ đúng định luật bảo toàn electron.
Ứng Dụng Của Định Luật Bảo Toàn Electron
- Giúp cân bằng các phương trình hóa học liên quan đến phản ứng oxi hóa - khử.
- Ứng dụng trong thiết kế và vận hành các loại pin và ắc quy, nơi mà các phản ứng oxi hóa - khử đóng vai trò quan trọng.
- Hỗ trợ trong việc phân tích cơ chế của các phản ứng hóa học phức tạp.
- Được sử dụng trong ngành luyện kim và công nghiệp điện hóa học để kiểm soát và tối ưu hóa các quá trình sản xuất.
Kết Luận
Định luật bảo toàn electron là một công cụ mạnh mẽ và cần thiết trong hóa học, giúp hiểu rõ hơn về cách các phản ứng hóa học diễn ra và đảm bảo tính chính xác trong các phép tính. Nó có nhiều ứng dụng thực tiễn trong các ngành công nghiệp và nghiên cứu khoa học.

.png)
1. Khái Niệm Về Định Luật Bảo Toàn Electron
Định luật bảo toàn electron là một nguyên lý cơ bản trong hóa học, đặc biệt là trong các phản ứng oxi hóa - khử. Định luật này phát biểu rằng tổng số electron nhường bởi chất khử phải bằng tổng số electron nhận bởi chất oxi hóa trong một phản ứng hóa học. Điều này đảm bảo rằng không có electron nào bị mất đi hoặc được tạo ra trong quá trình phản ứng.
Cụ thể, định luật bảo toàn electron có thể được biểu diễn bằng công thức:
\[
\sum e_{nhường} = \sum e_{nhận}
\]
Trong đó, \(\sum e_{nhường}\) là tổng số electron được nhường bởi chất khử và \(\sum e_{nhận}\) là tổng số electron nhận bởi chất oxi hóa.
Định luật này giúp chúng ta cân bằng các phản ứng hóa học, đặc biệt là các phản ứng oxi hóa - khử, bằng cách đảm bảo rằng số lượng electron không thay đổi trong suốt quá trình phản ứng. Điều này rất quan trọng trong việc phân tích và tính toán các chất tham gia và sản phẩm trong các phản ứng hóa học.
2. Các Bước Cân Bằng Phản Ứng Oxi Hóa - Khử
Để cân bằng một phản ứng oxi hóa - khử, chúng ta cần thực hiện theo các bước cụ thể nhằm đảm bảo tổng số electron nhường và nhận là bằng nhau. Dưới đây là quy trình chi tiết các bước cân bằng phản ứng:
-
Xác định số oxi hóa của các nguyên tố trong phản ứng: Trước hết, ta cần xác định số oxi hóa của các nguyên tố trong cả chất phản ứng và sản phẩm để nhận biết quá trình oxi hóa (tăng số oxi hóa) và quá trình khử (giảm số oxi hóa).
-
Viết các phương trình bán phản ứng: Phân chia phản ứng tổng thành hai bán phản ứng riêng biệt: một phản ứng oxi hóa và một phản ứng khử. Mỗi bán phản ứng sẽ biểu diễn quá trình nhường hoặc nhận electron.
-
Cân bằng số electron trong mỗi bán phản ứng: Sử dụng định luật bảo toàn electron để cân bằng số lượng electron nhường và nhận trong từng bán phản ứng. Điều này có thể bao gồm việc thêm hệ số thích hợp trước các chất phản ứng và sản phẩm.
-
Cân bằng các nguyên tố khác: Sau khi đã cân bằng số electron, tiến hành cân bằng các nguyên tố khác, đặc biệt là oxy và hydro. Thông thường, ta thêm nước (H2O) để cân bằng oxy và ion H+ để cân bằng hydro.
-
Kết hợp hai bán phản ứng: Gộp hai bán phản ứng lại thành một phương trình phản ứng tổng thể, đảm bảo rằng số electron nhường và nhận đã được triệt tiêu hoàn toàn.
-
Kiểm tra lại phương trình cân bằng: Cuối cùng, kiểm tra lại để đảm bảo rằng tất cả các nguyên tố và điện tích đã được cân bằng đúng trong phương trình phản ứng hoàn chỉnh.
Việc tuân thủ đầy đủ các bước này sẽ giúp bạn cân bằng các phản ứng oxi hóa - khử một cách chính xác và hiệu quả, đặc biệt trong các bài toán hóa học phức tạp.

3. Ví Dụ Minh Họa Về Định Luật Bảo Toàn Electron
Để hiểu rõ hơn về định luật bảo toàn electron, chúng ta sẽ xem xét một số ví dụ minh họa cụ thể dưới đây. Các ví dụ này sẽ giúp bạn thấy cách định luật được áp dụng trong việc cân bằng phản ứng hóa học.
Ví Dụ 1: Phản Ứng Giữa Kẽm Và Ion Đồng
Phản ứng giữa kim loại kẽm (\( \text{Zn} \)) và ion đồng (\( \text{Cu}^{2+} \)) là một ví dụ điển hình của phản ứng oxi hóa - khử:
\[
\text{Zn} + \text{Cu}^{2+} \rightarrow \text{Zn}^{2+} + \text{Cu}
\]
Trong phản ứng này, kẽm nhường 2 electron để trở thành ion kẽm (\( \text{Zn}^{2+} \)), trong khi ion đồng nhận 2 electron để trở thành đồng kim loại (\( \text{Cu} \)). Quá trình này có thể được chia thành các bán phản ứng như sau:
- Phản ứng oxi hóa: \( \text{Zn} \rightarrow \text{Zn}^{2+} + 2e^- \)
- Phản ứng khử: \( \text{Cu}^{2+} + 2e^- \rightarrow \text{Cu} \)
Tổng số electron nhường và nhận đều bằng 2, thể hiện sự tuân thủ của định luật bảo toàn electron.
Ví Dụ 2: Phản Ứng Giữa Sắt Và Axit Cloric
Trong phản ứng giữa sắt (\( \text{Fe} \)) và axit cloric (\( \text{HCl} \)), sắt bị oxi hóa thành ion sắt (\( \text{Fe}^{2+} \)), đồng thời ion H+ trong HCl bị khử thành khí hidro (\( \text{H}_2 \)):
\[
\text{Fe} + 2\text{HCl} \rightarrow \text{FeCl}_2 + \text{H}_2
\]
Các bán phản ứng sẽ như sau:
- Phản ứng oxi hóa: \( \text{Fe} \rightarrow \text{Fe}^{2+} + 2e^- \)
- Phản ứng khử: \( 2\text{H}^+ + 2e^- \rightarrow \text{H}_2 \)
Ở đây, sắt nhường 2 electron và hai ion H+ nhận 2 electron để tạo thành khí hidro. Điều này cũng tuân thủ định luật bảo toàn electron.
Ví Dụ 3: Phản Ứng Oxi Hóa - Khử Trong Dung Dịch Kiềm
Xét phản ứng giữa \( \text{MnO}_4^- \) và \( \text{Fe}^{2+} \) trong dung dịch kiềm, ta có:
\[
\text{MnO}_4^- + 5\text{Fe}^{2+} + 8\text{H}^+ \rightarrow \text{Mn}^{2+} + 5\text{Fe}^{3+} + 4\text{H}_2\text{O}
\]
Ở đây, mangan (\( \text{Mn} \)) bị khử từ trạng thái oxi hóa +7 xuống +2, trong khi sắt (\( \text{Fe} \)) bị oxi hóa từ +2 lên +3. Phản ứng này cũng thể hiện sự cân bằng của electron, với tổng số electron nhường và nhận là bằng nhau.
Các ví dụ trên minh họa rõ ràng cách áp dụng định luật bảo toàn electron trong việc cân bằng các phản ứng hóa học, đặc biệt là trong các phản ứng oxi hóa - khử. Điều này không chỉ giúp hiểu rõ hơn về bản chất của các phản ứng mà còn đóng vai trò quan trọng trong việc giải quyết các bài toán hóa học phức tạp.
4. Ứng Dụng Của Định Luật Bảo Toàn Electron
Định luật bảo toàn electron không chỉ là một nguyên lý quan trọng trong hóa học lý thuyết mà còn có nhiều ứng dụng thực tiễn trong các lĩnh vực khác nhau. Dưới đây là những ứng dụng chính của định luật này:
-
Cân bằng phương trình hóa học: Định luật bảo toàn electron được sử dụng để cân bằng các phương trình oxi hóa - khử. Bằng cách đảm bảo rằng tổng số electron nhường và nhận trong phản ứng là bằng nhau, ta có thể thiết lập các hệ số cân bằng cho các chất tham gia và sản phẩm.
-
Điện phân và điện hóa học: Trong các quá trình điện phân, định luật bảo toàn electron giúp xác định lượng chất được tạo ra tại các điện cực. Đặc biệt, trong các pin và ắc quy, việc hiểu và áp dụng định luật này là cơ sở để tính toán điện lượng, thế điện cực và dòng điện.
-
Phân tích hóa học: Định luật bảo toàn electron là công cụ quan trọng trong phân tích hóa học, đặc biệt là trong các phép đo đạc nồng độ ion trong dung dịch, thông qua các phương pháp chuẩn độ oxi hóa - khử. Nó giúp đảm bảo độ chính xác của các phản ứng phân tích, từ đó đưa ra kết quả đáng tin cậy.
-
Công nghiệp luyện kim: Trong ngành luyện kim, định luật bảo toàn electron được áp dụng để kiểm soát quá trình oxi hóa và khử kim loại, từ đó tinh chế và sản xuất các kim loại có độ tinh khiết cao. Điều này đóng vai trò quan trọng trong việc cải thiện chất lượng và hiệu suất sản xuất.
-
Bảo vệ môi trường: Định luật bảo toàn electron còn được ứng dụng trong các quá trình xử lý môi trường, chẳng hạn như xử lý nước thải thông qua các phản ứng oxi hóa - khử. Việc cân bằng các phản ứng này giúp loại bỏ các chất gây ô nhiễm và bảo vệ môi trường sống.
Nhờ vào sự ứng dụng rộng rãi trong nhiều lĩnh vực, định luật bảo toàn electron đã trở thành một nguyên lý không thể thiếu trong cả nghiên cứu khoa học lẫn sản xuất công nghiệp và bảo vệ môi trường.

5. Phương Pháp Giải Bài Tập Về Định Luật Bảo Toàn Electron
Khi giải các bài tập liên quan đến định luật bảo toàn electron, bạn cần áp dụng các bước cụ thể để đảm bảo rằng quá trình oxi hóa và khử trong phản ứng được cân bằng đúng. Dưới đây là phương pháp giải bài tập theo từng bước chi tiết:
-
Xác định số oxi hóa: Trước tiên, cần xác định số oxi hóa của các nguyên tố trong chất phản ứng và sản phẩm. Điều này giúp xác định chất nào bị oxi hóa và chất nào bị khử.
-
Viết các bán phản ứng: Phân tách phản ứng chính thành hai bán phản ứng: một bán phản ứng oxi hóa (nhường electron) và một bán phản ứng khử (nhận electron).
-
Cân bằng số electron: Cân bằng số electron nhường và nhận trong mỗi bán phản ứng bằng cách thêm hệ số thích hợp trước các chất trong bán phản ứng.
-
Kết hợp hai bán phản ứng: Sau khi đã cân bằng số electron, gộp hai bán phản ứng lại thành một phương trình hoàn chỉnh. Chú ý đảm bảo rằng số lượng electron trong phản ứng tổng thể đã được triệt tiêu.
-
Cân bằng các nguyên tố khác: Nếu có nguyên tố khác ngoài oxi và hidro, cần cân bằng chúng. Thông thường, cân bằng số lượng nguyên tử oxi bằng cách thêm nước (\( \text{H}_2\text{O} \)) và cân bằng số nguyên tử hidro bằng cách thêm ion \( \text{H}^+ \) hoặc \( \text{OH}^- \) tùy vào môi trường của phản ứng.
-
Kiểm tra lại: Cuối cùng, kiểm tra lại toàn bộ phương trình để đảm bảo rằng các nguyên tố và điện tích đã được cân bằng đúng.
Phương pháp này không chỉ giúp bạn giải quyết các bài toán oxi hóa - khử một cách chính xác mà còn tăng cường khả năng tư duy logic và hệ thống trong hóa học.
XEM THÊM:
6. Kết Luận
Định luật bảo toàn electron là một trong những nguyên tắc cơ bản và quan trọng nhất trong hóa học, đặc biệt trong các phản ứng oxi hóa - khử. Định luật này không chỉ giúp chúng ta hiểu rõ hơn về sự chuyển đổi năng lượng trong các phản ứng mà còn là công cụ quan trọng để cân bằng phương trình hóa học và giải quyết các bài toán phức tạp liên quan.
Định luật bảo toàn electron khẳng định rằng trong bất kỳ phản ứng oxi hóa - khử nào, tổng số electron được nhường bởi chất khử luôn bằng tổng số electron nhận bởi chất oxi hóa. Điều này có nghĩa là không có sự mất mát hay tạo thêm electron trong suốt quá trình phản ứng, giúp đảm bảo sự cân bằng năng lượng và vật chất.
Về mặt ứng dụng, định luật bảo toàn electron đóng vai trò quan trọng trong nhiều lĩnh vực khoa học và công nghệ. Trong công nghiệp, định luật này được sử dụng để tối ưu hóa các quy trình luyện kim và sản xuất pin, từ đó nâng cao hiệu suất và tính bền vững của sản phẩm. Trong lĩnh vực môi trường, nó giúp phát triển các phương pháp xử lý chất thải và ô nhiễm hiệu quả hơn.
Qua những ví dụ và ứng dụng thực tế, chúng ta có thể thấy rằng định luật bảo toàn electron không chỉ là một lý thuyết trừu tượng mà còn là một công cụ thực tiễn mạnh mẽ, hỗ trợ đắc lực trong việc giải quyết các vấn đề thực tế. Sự hiểu biết sâu sắc về định luật này sẽ giúp chúng ta áp dụng nó một cách hiệu quả trong nhiều lĩnh vực khác nhau của cuộc sống.
Trong tương lai, với sự phát triển của khoa học và công nghệ, định luật bảo toàn electron hứa hẹn sẽ tiếp tục được ứng dụng rộng rãi hơn nữa, góp phần vào sự tiến bộ của xã hội và sự phát triển bền vững của môi trường.