Chủ đề co2 electron dot structure: Cấu trúc electron dot của CO2 là một chủ đề quan trọng trong hóa học, giúp chúng ta hiểu rõ hơn về liên kết hóa học và hình học phân tử. Bài viết này sẽ hướng dẫn chi tiết cách vẽ và phân tích cấu trúc Lewis của CO2, đồng thời khám phá các ứng dụng của nó trong nghiên cứu và đời sống.
Mục lục
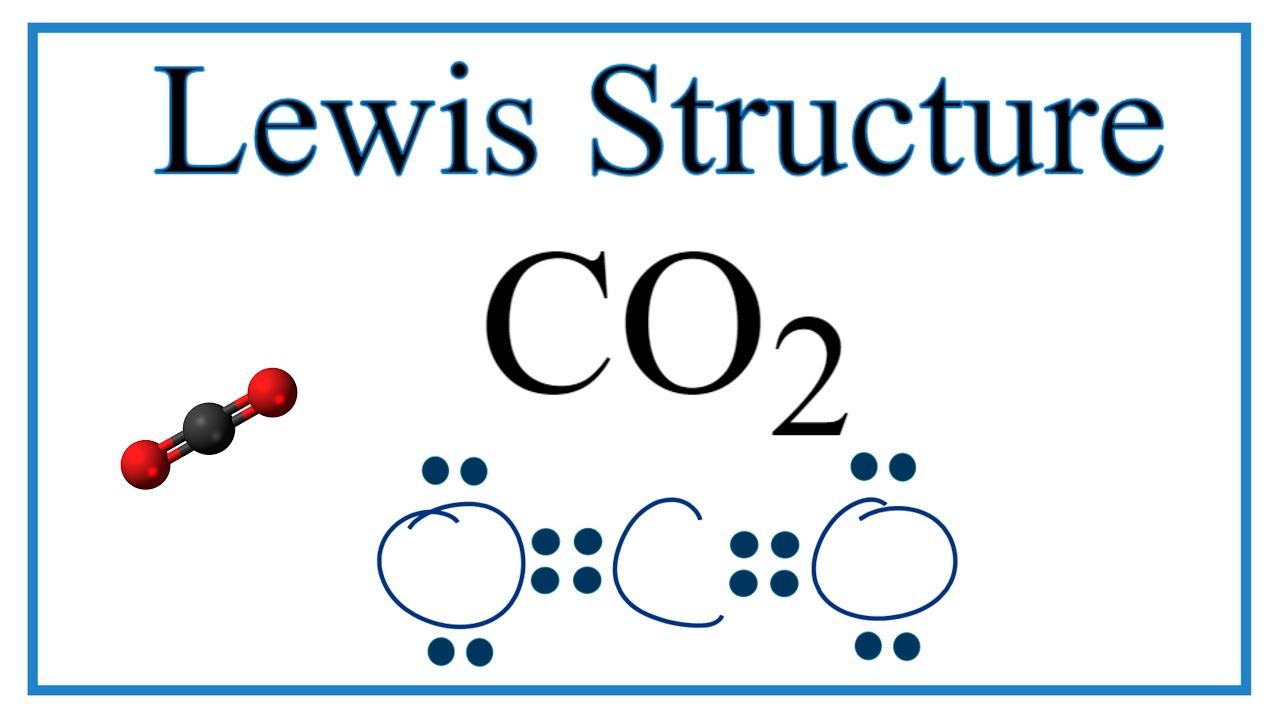
Cấu trúc Electron Dot của CO2
Cấu trúc electron dot (hay còn gọi là cấu trúc Lewis) là một phương pháp biểu diễn sự sắp xếp của các electron xung quanh nguyên tử trong phân tử. Đối với phân tử CO2 (carbon dioxide), cấu trúc này giúp mô tả liên kết giữa các nguyên tử carbon và oxy thông qua cặp electron chung.
Cấu trúc Lewis của CO2
Phân tử CO2 bao gồm một nguyên tử carbon (C) nằm giữa hai nguyên tử oxy (O). Mỗi nguyên tử oxy liên kết với nguyên tử carbon qua liên kết đôi, nghĩa là mỗi liên kết đôi gồm hai cặp electron chia sẻ.
- Carbon (C) có 4 electron hóa trị.
- Mỗi nguyên tử oxy (O) có 6 electron hóa trị.
- Tổng số electron hóa trị trong phân tử CO2 là: \(4 + 2 \times 6 = 16\) electron.
Biểu diễn cấu trúc Lewis
Trong cấu trúc Lewis của CO2, mỗi nguyên tử oxy chia sẻ hai cặp electron với nguyên tử carbon, tạo thành hai liên kết đôi. Điều này đảm bảo rằng nguyên tử carbon có đủ 8 electron trong lớp vỏ ngoài cùng (theo quy tắc bát tử), và mỗi nguyên tử oxy cũng có đủ 8 electron bao quanh.
Cấu trúc Lewis của CO2 có thể được biểu diễn như sau:
O=C=O
Tính đối xứng của phân tử CO2
Phân tử CO2 có cấu trúc đối xứng tuyến tính với góc liên kết 180 độ. Điều này làm cho CO2 là một phân tử không có momen lưỡng cực, vì các lực liên kết đối xứng nhau và triệt tiêu lẫn nhau.
Ý nghĩa và ứng dụng
Cấu trúc Lewis của CO2 không chỉ quan trọng trong việc hiểu rõ liên kết hóa học mà còn trong việc dự đoán hình dạng hình học của phân tử. CO2 là một khí nhà kính quan trọng và hiểu biết về cấu trúc của nó giúp trong các nghiên cứu liên quan đến môi trường, hóa học và khí hậu.
 2" style="object-fit:cover; margin-right: 20px;" width="760px" height="428">
2" style="object-fit:cover; margin-right: 20px;" width="760px" height="428">.png)
Giới thiệu về cấu trúc Electron Dot
Cấu trúc Electron Dot, hay còn gọi là cấu trúc Lewis, là một phương pháp biểu diễn các electron hóa trị của nguyên tử trong phân tử. Phương pháp này giúp hình dung cách các nguyên tử liên kết với nhau và sự sắp xếp của các cặp electron xung quanh các nguyên tử.
Trong cấu trúc Electron Dot, mỗi nguyên tử được biểu diễn bằng ký hiệu hóa học của nó, và các electron hóa trị được biểu diễn bằng các dấu chấm xung quanh ký hiệu đó. Cấu trúc này cho thấy cách các nguyên tử chia sẻ hoặc chuyển nhượng electron để tạo thành liên kết hóa học.
- Cách biểu diễn: Các electron hóa trị được vẽ xung quanh ký hiệu của nguyên tử, với các cặp electron tạo thành liên kết đơn, đôi hoặc ba giữa các nguyên tử.
- Quy tắc Bát tử: Nguyên tử trong các phân tử thường có xu hướng đạt được 8 electron trong lớp vỏ ngoài cùng, ngoại trừ một số trường hợp đặc biệt như Heli (He).
- Ứng dụng: Cấu trúc Electron Dot rất hữu ích trong việc dự đoán hình học phân tử, độ bền của liên kết, và khả năng phản ứng của các hợp chất hóa học.
Ví dụ, trong phân tử CO2, cấu trúc Electron Dot cho thấy nguyên tử carbon ở giữa và liên kết với hai nguyên tử oxy bằng các liên kết đôi, mỗi liên kết đôi bao gồm hai cặp electron được chia sẻ giữa carbon và oxy. Đây là minh họa rõ ràng cho quy tắc Bát tử, khi cả carbon và oxy đều đạt được cấu hình electron ổn định.
Phân tích cấu trúc Lewis của CO2
Cấu trúc Lewis của CO2 (carbon dioxide) là một ví dụ điển hình của phân tử có cấu trúc đối xứng và liên kết đôi. Để hiểu rõ hơn, chúng ta sẽ phân tích chi tiết cấu trúc này theo từng bước.
- Xác định số lượng electron hóa trị:
- Carbon (C) có 4 electron hóa trị.
- Mỗi nguyên tử oxy (O) có 6 electron hóa trị.
- Tổng số electron hóa trị của phân tử CO2 là \(4 + 6 \times 2 = 16\) electron.
- Vẽ khung phân tử:
Carbon là nguyên tử trung tâm, liên kết với hai nguyên tử oxy. Do đó, chúng ta có khung phân tử O-C-O.
- Phân phối electron:
- Mỗi liên kết giữa C và O sẽ bao gồm 2 electron (liên kết đơn), tức là 4 electron được sử dụng.
- 12 electron còn lại được phân phối xung quanh các nguyên tử oxy để mỗi nguyên tử đạt được 8 electron (theo quy tắc Bát tử).
- Tạo liên kết đôi:
Vì nguyên tử carbon cần 8 electron trong lớp vỏ ngoài cùng, nên mỗi liên kết đơn sẽ trở thành liên kết đôi để cung cấp thêm electron cho carbon. Điều này sẽ chuyển 2 cặp electron không chia sẻ ở mỗi nguyên tử oxy thành liên kết đôi với carbon.
- Cấu trúc Lewis hoàn chỉnh:
Cấu trúc Lewis của CO2 bao gồm một nguyên tử carbon ở trung tâm với hai liên kết đôi nối với hai nguyên tử oxy ở hai bên, được biểu diễn như sau:
O=C=O
Cấu trúc này cho thấy rằng cả carbon và oxy đều tuân thủ quy tắc Bát tử, với 8 electron xung quanh mỗi nguyên tử, giúp phân tử CO2 đạt được sự ổn định.

Tính đối xứng và hình học phân tử CO2
Phân tử CO2 có tính đối xứng và hình học đặc biệt, phản ánh sự sắp xếp các nguyên tử trong không gian ba chiều. Cùng phân tích chi tiết để hiểu rõ hơn về tính đối xứng và hình học của phân tử này.
Tính đối xứng của phân tử CO2
Phân tử CO2 có cấu trúc đối xứng theo hình tuyến tính. Điều này có nghĩa là hai nguyên tử oxy nằm ở hai phía đối diện của nguyên tử carbon trung tâm, tạo thành một đường thẳng. Do đó, CO2 có tính đối xứng qua một mặt phẳng ngang đi qua nguyên tử carbon. Sự đối xứng này làm cho phân tử không có momen lưỡng cực, do các lực liên kết đối xứng nhau và triệt tiêu lẫn nhau.
Hình học phân tử CO2
Phân tử CO2 có hình học tuyến tính với góc liên kết giữa hai liên kết C=O là 180 độ. Sự phân bố này là kết quả của việc sử dụng lai hóa sp của nguyên tử carbon, trong đó một orbital s và một orbital p kết hợp với nhau để tạo thành hai orbital sp lai hóa. Những orbital này nằm thẳng hàng và liên kết với các nguyên tử oxy thông qua các liên kết đôi.
Step by Step: Xác định hình học phân tử CO2
- Xác định số lượng vùng electron quanh nguyên tử trung tâm: Carbon trong CO2 có hai vùng electron (hai liên kết đôi với oxy).
- Xác định kiểu lai hóa của carbon: Với hai vùng electron, carbon sử dụng lai hóa sp.
- Xác định hình học: Do có hai orbital lai hóa sp thẳng hàng, hình học của phân tử CO2 là tuyến tính với góc liên kết 180 độ.
Kết quả là phân tử CO2 không chỉ có tính đối xứng hoàn hảo mà còn có hình học đơn giản, đặc trưng của các phân tử có liên kết đôi và sự lai hóa sp. Điều này giúp CO2 trở thành một phân tử ổn định và không phân cực trong điều kiện thông thường.

Ứng dụng của cấu trúc Electron Dot trong nghiên cứu
Cấu trúc Electron Dot, hay cấu trúc Lewis, không chỉ là một công cụ cơ bản trong việc giảng dạy và học tập hóa học mà còn có nhiều ứng dụng quan trọng trong nghiên cứu khoa học. Dưới đây là các ứng dụng chính của cấu trúc Electron Dot trong nghiên cứu:
Dự đoán hình dạng phân tử
Cấu trúc Electron Dot giúp xác định cách các nguyên tử trong một phân tử sắp xếp trong không gian, từ đó dự đoán hình dạng phân tử. Ví dụ, bằng cách sử dụng cấu trúc Lewis, ta có thể dự đoán phân tử CO2 có hình dạng tuyến tính do sự sắp xếp đối xứng của các electron xung quanh nguyên tử carbon.
Xác định loại và số lượng liên kết hóa học
Cấu trúc Electron Dot cho phép nhận biết loại và số lượng liên kết trong một phân tử. Các cặp electron dùng chung giữa hai nguyên tử sẽ tạo thành liên kết đơn, đôi hoặc ba. Điều này rất quan trọng trong việc xác định tính chất hóa học của các hợp chất, chẳng hạn như độ bền của liên kết và khả năng phản ứng.
Phân tích độ bền và tính ổn định của phân tử
Cấu trúc Lewis cũng được sử dụng để phân tích độ bền và tính ổn định của các phân tử. Bằng cách đánh giá số lượng và sự phân bố của các electron hóa trị, các nhà nghiên cứu có thể dự đoán phân tử có bền vững hay không. Ví dụ, phân tử CO2 với cấu trúc đối xứng và các liên kết đôi bền vững giữa carbon và oxy, cho thấy đây là một phân tử rất ổn định.
Hỗ trợ trong nghiên cứu hóa học tính toán
Cấu trúc Electron Dot là cơ sở cho các phương pháp tính toán trong hóa học, chẳng hạn như lý thuyết Orbital phân tử (Molecular Orbital Theory) và phương pháp tính toán mật độ chức năng (Density Functional Theory - DFT). Những phương pháp này dựa vào cấu trúc Lewis để xây dựng các mô hình phức tạp hơn, giúp phân tích sâu hơn về tính chất và hành vi của các phân tử.
Ứng dụng trong nghiên cứu môi trường và sinh học
Trong nghiên cứu môi trường, cấu trúc Electron Dot của các phân tử như CO2 giúp hiểu rõ hơn về cơ chế phản ứng trong khí quyển và vai trò của các khí nhà kính trong biến đổi khí hậu. Trong sinh học, cấu trúc Lewis được sử dụng để nghiên cứu các phản ứng sinh hóa và chức năng của các phân tử sinh học.
Nhờ những ứng dụng này, cấu trúc Electron Dot trở thành một công cụ không thể thiếu trong nghiên cứu khoa học, giúp các nhà nghiên cứu hiểu rõ hơn về bản chất của các phân tử và các phản ứng hóa học.

Phương pháp vẽ và kiểm tra cấu trúc Lewis của CO2
Vẽ và kiểm tra cấu trúc Lewis của CO2 là một kỹ năng quan trọng trong việc học và nghiên cứu hóa học. Dưới đây là hướng dẫn chi tiết từng bước để vẽ và kiểm tra cấu trúc này.
1. Xác định tổng số electron hóa trị
Đầu tiên, cần tính toán tổng số electron hóa trị có trong phân tử CO2. Carbon có 4 electron hóa trị và mỗi nguyên tử oxy có 6 electron hóa trị.
- Tổng số electron hóa trị của CO2 = 4 (C) + 6 × 2 (O) = 16 electron
2. Vẽ khung xương phân tử
Tiếp theo, vẽ khung xương phân tử với carbon làm nguyên tử trung tâm và oxy ở hai đầu.
O - C - O
Liên kết giữa các nguyên tử trong khung xương ban đầu được biểu diễn bằng các liên kết đơn.
3. Phân phối các electron còn lại
Sau khi vẽ khung xương, chúng ta sử dụng các electron hóa trị còn lại để hoàn thành lớp vỏ ngoài của các nguyên tử oxy, tuân thủ quy tắc bát tử. Ban đầu, mỗi liên kết đơn sử dụng 2 electron, vì vậy 4 electron đã được sử dụng, còn lại 12 electron.
- Đặt 6 electron (3 cặp) xung quanh mỗi nguyên tử oxy để đạt quy tắc bát tử.
4. Hình thành liên kết đôi
Do carbon cần thêm electron để đạt được quy tắc bát tử, chúng ta sẽ chuyển các cặp electron không liên kết trên oxy thành các liên kết đôi với carbon.
O=C=O
5. Kiểm tra cấu trúc
Sau khi vẽ xong, kiểm tra lại cấu trúc bằng cách đảm bảo rằng:
- Mỗi nguyên tử oxy có 8 electron (2 liên kết đôi và 2 cặp electron không chia sẻ).
- Carbon cũng có 8 electron từ hai liên kết đôi.
6. Đánh giá tính hợp lý của cấu trúc
Cấu trúc Lewis của CO2 với các liên kết đôi là cấu trúc ổn định nhất và tuân thủ quy tắc bát tử. Tính đối xứng của cấu trúc cũng góp phần vào sự ổn định của phân tử này.
Việc vẽ và kiểm tra cấu trúc Lewis của CO2 không chỉ giúp hiểu rõ liên kết trong phân tử mà còn là nền tảng để nghiên cứu sâu hơn về các tính chất hóa học và vật lý của CO2.