Chủ đề cách tính phần trăm khối lượng nguyên tử: Bài viết này sẽ hướng dẫn bạn cách tính phần trăm khối lượng nguyên tử trong các hợp chất một cách chi tiết và dễ hiểu. Qua các bước đơn giản, bạn sẽ nắm vững phương pháp tính toán, giúp bạn hiểu rõ hơn về thành phần hóa học của các chất mà bạn đang học.
Mục lục
- Cách Tính Phần Trăm Khối Lượng Nguyên Tử
- Ví Dụ Bài Tập
- Ví Dụ Bài Tập
- 1. Giới Thiệu Về Khái Niệm Khối Lượng Nguyên Tử
- 2. Cách Xác Định Nguyên Tử Khối Từ Bảng Tuần Hoàn
- 3. Phương Pháp Tính Phần Trăm Khối Lượng Nguyên Tử Trong Hợp Chất
- 4. Ví Dụ Thực Tế Về Tính Phần Trăm Khối Lượng
- 5. Các Bài Tập Thực Hành
- 6. Các Sai Lầm Thường Gặp Khi Tính Toán
- 7. Kết Luận
Cách Tính Phần Trăm Khối Lượng Nguyên Tử
Trong hóa học, việc tính phần trăm khối lượng của một nguyên tố trong một hợp chất là một kỹ năng quan trọng giúp hiểu rõ thành phần hóa học của hợp chất đó. Để tính phần trăm khối lượng, bạn cần thực hiện các bước sau:
1. Xác Định Nguyên Tử Khối
Xác định nguyên tử khối của từng nguyên tố trong hợp chất từ bảng tuần hoàn hóa học. Ví dụ, nguyên tử khối của Carbon là 12 g/mol, Oxygen là 16 g/mol.
2. Tìm Phân Tử Khối Của Hợp Chất
Cộng tất cả các nguyên tử khối của các nguyên tố trong hợp chất lại để tìm phân tử khối của hợp chất đó. Ví dụ, với hợp chất \( CO_2 \), phân tử khối sẽ là:
\[
\text{Phân tử khối của } CO_2 = (12 \, g/mol) + 2 \times (16 \, g/mol) = 44 \, g/mol
\]
3. Tính Khối Lượng Của Nguyên Tố Cụ Thể
Tính khối lượng của nguyên tố cần tìm trong hợp chất. Ví dụ, với Carbon trong \( CO_2 \), khối lượng của Carbon là:
\[
\text{Khối lượng của Carbon} = 12 \, g/mol
\]
4. Tính Phần Trăm Khối Lượng
Phần trăm khối lượng của nguyên tố trong hợp chất được tính bằng cách chia khối lượng của nguyên tố đó cho phân tử khối của hợp chất, sau đó nhân với 100:
\[
\text{Phần trăm khối lượng của Carbon trong } CO_2 = \left(\frac{12 \, g/mol}{44 \, g/mol}\right) \times 100 = 27.27\%
\]
5. Ứng Dụng và Bài Tập
Phương pháp này có thể áp dụng để tính phần trăm khối lượng của bất kỳ nguyên tố nào trong bất kỳ hợp chất nào. Hãy luyện tập với các hợp chất khác để nắm vững kỹ năng này.

.png)
Ví Dụ Bài Tập
Cho hợp chất \( H_2O \), tính phần trăm khối lượng của Hydrogen và Oxygen.
- Xác định nguyên tử khối: Hydrogen = 1 g/mol, Oxygen = 16 g/mol.
- Tính phân tử khối của \( H_2O \): \( 2 \times 1 \, g/mol + 16 \, g/mol = 18 \, g/mol \).
- Tính phần trăm khối lượng của Hydrogen: \[ \left(\frac{2 \, g/mol}{18 \, g/mol}\right) \times 100 = 11.11\% \]
- Tính phần trăm khối lượng của Oxygen: \[ \left(\frac{16 \, g/mol}{18 \, g/mol}\right) \times 100 = 88.89\% \]
Chúc các bạn học tập tốt!
Ví Dụ Bài Tập
Cho hợp chất \( H_2O \), tính phần trăm khối lượng của Hydrogen và Oxygen.
- Xác định nguyên tử khối: Hydrogen = 1 g/mol, Oxygen = 16 g/mol.
- Tính phân tử khối của \( H_2O \): \( 2 \times 1 \, g/mol + 16 \, g/mol = 18 \, g/mol \).
- Tính phần trăm khối lượng của Hydrogen: \[ \left(\frac{2 \, g/mol}{18 \, g/mol}\right) \times 100 = 11.11\% \]
- Tính phần trăm khối lượng của Oxygen: \[ \left(\frac{16 \, g/mol}{18 \, g/mol}\right) \times 100 = 88.89\% \]
Chúc các bạn học tập tốt!

1. Giới Thiệu Về Khái Niệm Khối Lượng Nguyên Tử
Khối lượng nguyên tử là khái niệm cơ bản trong hóa học, dùng để mô tả khối lượng của một nguyên tử đơn lẻ so với khối lượng của một đồng vị cụ thể của nguyên tố carbon-12. Đơn vị đo khối lượng nguyên tử được sử dụng là đơn vị khối lượng nguyên tử (amu) hoặc Daltons (Da).
Khối lượng nguyên tử được tính toán dựa trên trọng lượng trung bình của tất cả các đồng vị của một nguyên tố, theo công thức:
\[
\text{Khối lượng nguyên tử trung bình} = \sum (\text{Tỷ lệ đồng vị} \times \text{Khối lượng đồng vị})
\]
Điều này có nghĩa là khối lượng nguyên tử không phải là một con số cố định mà thay đổi dựa trên các đồng vị của nguyên tố đó. Hiểu rõ khối lượng nguyên tử giúp ta có cái nhìn chính xác hơn về các phản ứng hóa học, từ đó áp dụng vào thực tiễn một cách hiệu quả.

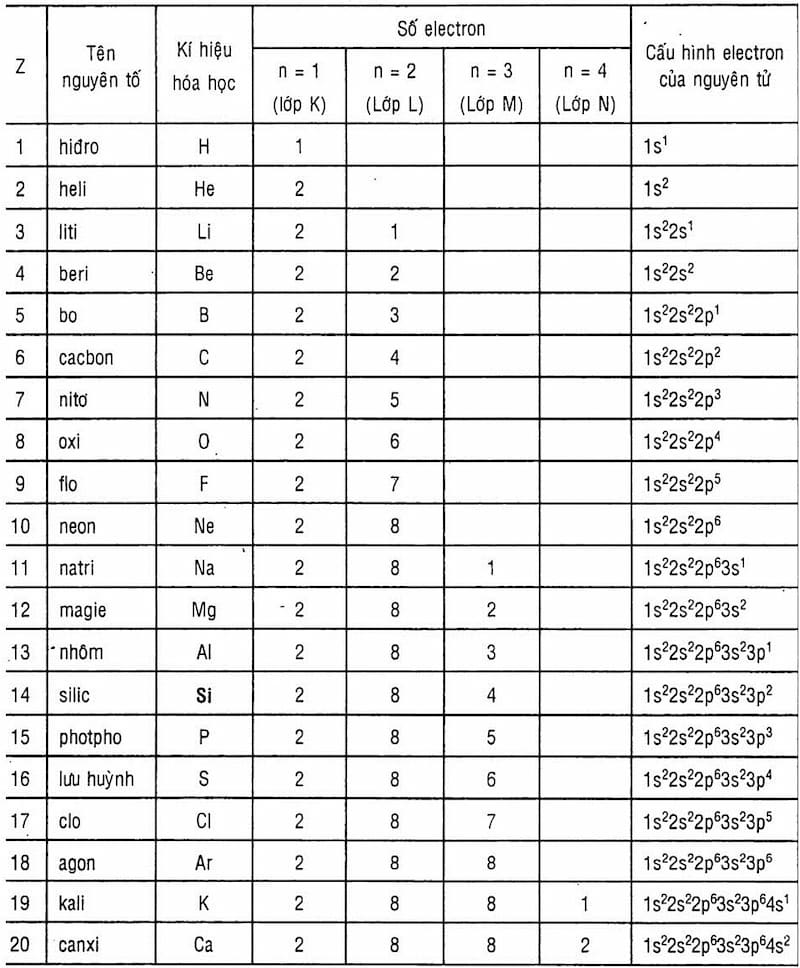
2. Cách Xác Định Nguyên Tử Khối Từ Bảng Tuần Hoàn
Nguyên tử khối của một nguyên tố là khối lượng của một nguyên tử của nguyên tố đó, được tính theo đơn vị u (đơn vị khối lượng nguyên tử). Nguyên tử khối có thể được xác định một cách dễ dàng từ bảng tuần hoàn các nguyên tố hóa học.
- Bước 1: Xác định ký hiệu hóa học của nguyên tố
- Bước 2: Xác định vị trí của nguyên tố trong bảng tuần hoàn
- Bước 3: Xác định nguyên tử khối của nguyên tố
- Bước 4: Áp dụng công thức để tính khối lượng mol
- Bước 5: Xác định tỉ lệ phần trăm khối lượng của từng nguyên tố trong hợp chất
Mỗi nguyên tố trong bảng tuần hoàn đều có một ký hiệu hóa học riêng, ví dụ như H cho Hydro, O cho Oxi. Hãy xác định ký hiệu của nguyên tố cần tính toán.
Nguyên tử khối của nguyên tố thường được ghi ở góc dưới của ô nguyên tố trong bảng tuần hoàn. Đây chính là giá trị cần tìm.
Sử dụng bảng tuần hoàn, tra cứu giá trị nguyên tử khối của nguyên tố. Ví dụ, nguyên tử khối của Cacbon (\(C\)) là 12 u, của Oxi (\(O\)) là 16 u.
Khi biết nguyên tử khối của các nguyên tố, bạn có thể tính khối lượng mol của hợp chất bằng cách cộng tổng nguyên tử khối của các nguyên tố trong công thức hóa học của hợp chất đó. Ví dụ, khối lượng mol của hợp chất Glucozo \(\text{C}_{6}\text{H}_{12}\text{O}_{6}\) được tính như sau:
| C (6 nguyên tử) | \(6 \times 12 = 72\) u |
| H (12 nguyên tử) | \(12 \times 1 = 12\) u |
| O (6 nguyên tử) | \(6 \times 16 = 96\) u |
| Tổng khối lượng mol của Glucozo | \(72 + 12 + 96 = 180\) u |
Để tính tỉ lệ phần trăm khối lượng của một nguyên tố trong hợp chất, sử dụng công thức:
\[
\% m_X = \left(\frac{m_X}{m_{\text{hợp chất}}}\right) \times 100
\]
Ví dụ, tỉ lệ phần trăm khối lượng của Cacbon trong Glucozo \(\text{C}_{6}\text{H}_{12}\text{O}_{6}\) là:
\[
\% m_C = \left(\frac{72}{180}\right) \times 100 \approx 40\%
\]

3. Phương Pháp Tính Phần Trăm Khối Lượng Nguyên Tử Trong Hợp Chất
Để tính phần trăm khối lượng của một nguyên tử trong một hợp chất, bạn cần tuân theo các bước sau:
Xác định khối lượng mol của hợp chất: Tổng hợp khối lượng nguyên tử của tất cả các nguyên tố có mặt trong hợp chất. Công thức chung:
\[ M = \sum n_i \times A_i \]
- Với \( M \) là khối lượng mol của hợp chất.
- \( n_i \) là số nguyên tử của nguyên tố thứ \( i \) trong hợp chất.
- \( A_i \) là khối lượng nguyên tử của nguyên tố thứ \( i \).
Tính khối lượng của nguyên tố cần tìm trong hợp chất: Dựa trên số lượng nguyên tử và khối lượng nguyên tử của nguyên tố đó.
\[ m_i = n_i \times A_i \]
- Với \( m_i \) là khối lượng của nguyên tố \( i \) trong hợp chất.
- \( n_i \) là số nguyên tử của nguyên tố \( i \) trong hợp chất.
- \( A_i \) là khối lượng nguyên tử của nguyên tố \( i \).
Tính phần trăm khối lượng của nguyên tố trong hợp chất: Chia khối lượng của nguyên tố cần tìm cho khối lượng mol của hợp chất, sau đó nhân với 100 để tính ra phần trăm.
\[ \text{Phần trăm khối lượng} = \left( \frac{m_i}{M} \right) \times 100\% \]
Bằng cách sử dụng các bước trên, bạn có thể xác định được phần trăm khối lượng của bất kỳ nguyên tố nào trong hợp chất, điều này rất hữu ích trong việc phân tích và đánh giá các tính chất hóa học của chất đó.
XEM THÊM:
4. Ví Dụ Thực Tế Về Tính Phần Trăm Khối Lượng
Dưới đây là một ví dụ cụ thể về cách tính phần trăm khối lượng của một nguyên tố trong hợp chất:
Ví dụ: Tính phần trăm khối lượng của nguyên tố carbon (C) trong hợp chất \( CO_2 \) (carbon dioxide).
Bước 1: Xác định khối lượng mol của hợp chất \( CO_2 \).
Carbon có khối lượng nguyên tử là 12 g/mol, Oxygen có khối lượng nguyên tử là 16 g/mol.
Khối lượng mol của \( CO_2 \) là:\[ M_{CO_2} = 12 \, \text{g/mol} + 2 \times 16 \, \text{g/mol} = 44 \, \text{g/mol} \]
Bước 2: Tính khối lượng của carbon trong hợp chất \( CO_2 \).
Trong một phân tử \( CO_2 \), có một nguyên tử carbon. Vậy khối lượng của carbon trong hợp chất là:
\[ m_C = 12 \, \text{g/mol} \]
Bước 3: Tính phần trăm khối lượng của carbon trong \( CO_2 \).
Phần trăm khối lượng của carbon được tính bằng công thức:
\[ \text{Phần trăm khối lượng của C} = \left( \frac{m_C}{M_{CO_2}} \right) \times 100\% \]
Thay số vào:
\[ \text{Phần trăm khối lượng của C} = \left( \frac{12}{44} \right) \times 100\% \approx 27.27\% \]
Vậy, trong hợp chất \( CO_2 \), carbon chiếm khoảng 27.27% khối lượng.

5. Các Bài Tập Thực Hành
Dưới đây là một số bài tập giúp bạn luyện tập cách tính phần trăm khối lượng nguyên tử trong các hợp chất khác nhau. Mỗi bài tập sẽ bao gồm các bước chi tiết để bạn có thể dễ dàng thực hiện và kiểm tra kết quả của mình.
5.1 Bài Tập Với Các Hợp Chất Đơn Giản
- Bài 1: Tính phần trăm khối lượng của nguyên tố Natri (Na) trong hợp chất NaCl.
- Xác định khối lượng phân tử của NaCl: \[M_{\text{NaCl}} = M_{\text{Na}} + M_{\text{Cl}} = 23 + 35.5 = 58.5 \, \text{amu}\]
- Tính phần trăm khối lượng của Na: \[\% \, \text{Na} = \left(\frac{M_{\text{Na}}}{M_{\text{NaCl}}}\right) \times 100 = \left(\frac{23}{58.5}\right) \times 100 \approx 39.32\%\]
- Bài 2: Tính phần trăm khối lượng của nguyên tố Sắt (Fe) trong hợp chất Fe2O3.
- Xác định khối lượng phân tử của Fe2O3: \[M_{\text{Fe}_2\text{O}_3} = 2M_{\text{Fe}} + 3M_{\text{O}} = 2(56) + 3(16) = 160 \, \text{amu}\]
- Tính phần trăm khối lượng của Fe: \[\% \, \text{Fe} = \left(\frac{2M_{\text{Fe}}}{M_{\text{Fe}_2\text{O}_3}}\right) \times 100 = \left(\frac{2(56)}{160}\right) \times 100 = 70\%\]
Hướng dẫn:
Hướng dẫn:
5.2 Bài Tập Với Các Hợp Chất Phức Tạp
- Bài 1: Tính phần trăm khối lượng của nguyên tố Nitơ (N) trong hợp chất NH4NO3.
- Xác định khối lượng phân tử của NH4NO3: \[M_{\text{NH}_4\text{NO}_3} = M_{\text{N}} + 4M_{\text{H}} + M_{\text{N}} + 3M_{\text{O}} = 14 + 4(1) + 14 + 3(16) = 80 \, \text{amu}\]
- Tính phần trăm khối lượng của N: \[\% \, \text{N} = \left(\frac{2M_{\text{N}}}{M_{\text{NH}_4\text{NO}_3}}\right) \times 100 = \left(\frac{2(14)}{80}\right) \times 100 = 35\%\]
- Bài 2: Tính phần trăm khối lượng của nguyên tố Cacbon (C) trong hợp chất C6H12O6.
- Xác định khối lượng phân tử của C6H12O6: \[M_{\text{C}_6\text{H}_{12}\text{O}_6} = 6M_{\text{C}} + 12M_{\text{H}} + 6M_{\text{O}} = 6(12) + 12(1) + 6(16) = 180 \, \text{amu}\]
- Tính phần trăm khối lượng của C: \[\% \, \text{C} = \left(\frac{6M_{\text{C}}}{M_{\text{C}_6\text{H}_{12}\text{O}_6}}\right) \times 100 = \left(\frac{6(12)}{180}\right) \times 100 = 40\%\]
Hướng dẫn:
Hướng dẫn:

6. Các Sai Lầm Thường Gặp Khi Tính Toán
Khi tính toán phần trăm khối lượng nguyên tử, có một số sai lầm phổ biến mà học sinh thường mắc phải. Dưới đây là những lỗi thường gặp và cách khắc phục:
- Không xác định chính xác khối lượng mol của các nguyên tố: Một trong những lỗi đầu tiên là không tính đúng khối lượng mol của các nguyên tố. Điều này có thể do không tra cứu chính xác từ bảng tuần hoàn hoặc nhầm lẫn trong việc nhân số mol.
- Không tính đúng khối lượng của hợp chất: Nhiều học sinh thường bỏ qua bước tính khối lượng tổng của hợp chất, dẫn đến việc sai sót khi tính phần trăm khối lượng của từng nguyên tố.
- Nhầm lẫn giữa tử số và mẫu số trong phương trình: Khi tính phần trăm khối lượng, việc nhầm lẫn giữa khối lượng của nguyên tố cần tính và tổng khối lượng của hợp chất có thể dẫn đến kết quả sai lệch.
- Quên nhân tỷ số mol của các nguyên tố: Tỷ số mol (chỉ số nhỏ dưới công thức hóa học) cần được nhân với khối lượng mol của từng nguyên tố. Quên bước này sẽ làm sai lệch hoàn toàn kết quả.
- Không làm tròn kết quả: Việc không làm tròn kết quả một cách hợp lý có thể dẫn đến những sai số nhỏ nhưng quan trọng trong các bài tập hóa học.
Để tránh các sai lầm trên, học sinh cần tuân thủ các bước tính toán cơ bản và kiểm tra kỹ từng bước trước khi kết luận.
Ví dụ, với hợp chất \( \text{Fe}_2(\text{SO}_4)_3 \):
- Khối lượng mol của \( \text{Fe}_2(\text{SO}_4)_3 \) là \[ M_{Fe_2(SO_4)_3} = 56 \times 2 + (32 + 16 \times 4) \times 3 = 400 \, \text{g/mol} \]
- Phần trăm khối lượng của S là \[ \% S = \frac{m_S}{M_{Fe_2(SO_4)_3}} \times 100 = \frac{96}{400} \times 100 = 24\% \]
Bằng cách thực hiện đúng các bước và kiểm tra kỹ, bạn có thể tránh được các sai lầm phổ biến và đạt kết quả chính xác trong các bài tập tính phần trăm khối lượng nguyên tử.
7. Kết Luận
Việc tính toán phần trăm khối lượng nguyên tử trong một hợp chất là một phần quan trọng trong hóa học, giúp xác định tỷ lệ của từng nguyên tố trong hợp chất đó. Để đạt được kết quả chính xác, cần tuân thủ đúng quy trình tính toán và tránh các sai lầm phổ biến.
Nhìn chung, cách tính phần trăm khối lượng nguyên tử dựa vào công thức:
\[
\text{Phần trăm khối lượng} = \left( \frac{\text{Khối lượng mol nguyên tử}}{\text{Khối lượng phân tử của hợp chất}} \right) \times 100
\]
Trong đó:
- Khối lượng mol nguyên tử là khối lượng của một nguyên tử tính bằng gam.
- Khối lượng phân tử của hợp chất là tổng khối lượng của tất cả các nguyên tố trong hợp chất.
Thông qua việc áp dụng đúng các bước tính toán và công thức trên, chúng ta có thể dễ dàng tính được phần trăm khối lượng của bất kỳ nguyên tử nào trong hợp chất. Tuy nhiên, điều quan trọng là cần kiểm tra kỹ các giá trị và công thức hóa học sử dụng để tránh các sai sót không đáng có.
Trong các bài tập thực hành, việc tính toán phần trăm khối lượng nguyên tử không chỉ giúp củng cố kiến thức lý thuyết mà còn phát triển kỹ năng tính toán và tư duy logic trong lĩnh vực hóa học.
Tóm lại, phần trăm khối lượng nguyên tử cung cấp một cái nhìn sâu sắc về thành phần của hợp chất, giúp chúng ta hiểu rõ hơn về cấu trúc hóa học và tính chất của chúng. Việc luyện tập và nắm vững phương pháp tính toán này sẽ là nền tảng vững chắc cho những nghiên cứu và ứng dụng phức tạp hơn trong tương lai.