Chủ đề cho biết số hiệu nguyên tử cr là 24: Cho biết số hiệu nguyên tử Cr là 24, crom là nguyên tố kim loại quan trọng trong bảng tuần hoàn với nhiều ứng dụng thực tế. Bài viết này sẽ giúp bạn khám phá các đặc tính vật lý, hóa học, và ứng dụng phổ biến của crom, đồng thời tìm hiểu cách điều chế và vai trò của nguyên tố này trong cuộc sống và công nghiệp hiện đại.
Mục lục
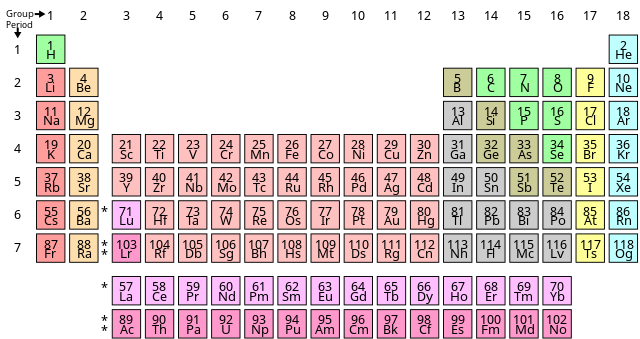
Số Hiệu Nguyên Tử Của Nguyên Tố Crom (Cr)
Nguyên tố Crom (ký hiệu hóa học là Cr) có số hiệu nguyên tử là 24. Đây là một kim loại chuyển tiếp quan trọng trong bảng tuần hoàn, thuộc chu kì 4 và nhóm VIB. Vị trí của Cr trong bảng tuần hoàn hóa học được xác định dựa trên số lượng proton trong hạt nhân nguyên tử.
Vị Trí Trong Bảng Tuần Hoàn
- Số hiệu nguyên tử: 24
- Chu kì: 4
- Nhóm: VIB
- Phân lớp điện tử ngoài cùng: \(3d^{5}4s^{1}\)
Cấu Hình Electron Của Nguyên Tố Crom
Cấu hình electron của Crom được viết như sau:
- Cấu hình electron đầy đủ: \(1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{5}4s^{1}\)
- Cấu hình electron rút gọn: \([Ar]3d^{5}4s^{1}\)
Ở trạng thái cơ bản, nguyên tử Crom có sự sắp xếp điện tử khác biệt khi một electron từ phân lớp 4s di chuyển vào phân lớp 3d, tạo thành cấu hình bán bão hòa, giúp nguyên tử ổn định hơn.
Tính Chất Hóa Học Của Crom
Crom là một kim loại chuyển tiếp với nhiều mức oxi hóa phổ biến, bao gồm:
- Mức oxi hóa +2, +3, +6
- Các hợp chất oxit như CrO, Cr₂O₃, CrO₃
Trong công nghiệp, Crom được ứng dụng rộng rãi trong luyện kim, đặc biệt trong việc chế tạo thép không gỉ và các hợp kim chống ăn mòn.
Ví Dụ Minh Họa
Xét vị trí của Cr trong bảng tuần hoàn:
| Nguyên tố | Chu kì | Nhóm | Số electron |
|---|---|---|---|
| Cr | 4 | VIB | 24 |
Công Thức Liên Quan
Để xác định các mức oxi hóa của Cr trong hợp chất, ta sử dụng các công thức hóa học:
- Cr2O3: Crom ở mức oxi hóa +3
- CrO3: Crom ở mức oxi hóa +6
Như vậy, Crom là một nguyên tố quan trọng trong hóa học với nhiều ứng dụng thực tế trong các ngành công nghiệp và nghiên cứu khoa học.

.png)
Mục Lục
1. Số hiệu nguyên tử Cr là 24 - Khám phá Crom trong bảng tuần hoàn
2. Đặc tính vật lý và hóa học của nguyên tố Crom
3. Ứng dụng của Crom trong công nghiệp và đời sống
4. Cấu hình electron của Cr: Bản chất và sự sắp xếp electron
5. Vị trí của Crom trong chu kỳ và nhóm: Sự quan trọng trong hóa học vô cơ
6. Điều chế và sản xuất Crom - Quy trình công nghiệp
7. Tổng kết: Vai trò của Crom trong phát triển công nghệ
Giới Thiệu Về Nguyên Tố Crom (Cr)
Crom (Cr) là một nguyên tố hóa học có số hiệu nguyên tử là 24. Đây là một kim loại cứng, giòn với màu trắng bạc và có khả năng chống oxy hóa cao. Trong bảng tuần hoàn, crom nằm ở chu kỳ 4 và thuộc nhóm VI B. Tính chất hóa học của crom rất phong phú, với các trạng thái oxi hóa phổ biến là +2, +3 và +6. Crom đóng vai trò quan trọng trong nhiều ngành công nghiệp như luyện kim, sản xuất thép không gỉ, và công nghiệp nhuộm.
Cấu hình electron của Crom
Nguyên tử crom có 24 electron được sắp xếp trong các phân lớp như sau: \(1s^2 2s^2 2p^6 3s^2 3p^6 3d^5 4s^1\). Cấu hình này cho thấy tính chất hóa học của crom, với trạng thái bán bão hòa giúp nó ổn định hơn.
Vị trí của Crom trong bảng tuần hoàn
- Ô: Số 24
- Nhóm: VI B
- Chu kỳ: 4
Tính chất vật lý của Crom
- Màu sắc: Trắng bạc
- Độ cứng: Cứng nhất trong số các kim loại, có thể rạch được kính.
- Khối lượng riêng: \(d = 7,2 g/cm^3\)
- Nhiệt độ nóng chảy: \(1890^{o}C\)
Tính chất hóa học của Crom
- Crom có tính khử mạnh, phản ứng với phi kim và hợp chất.
- Trong hợp chất, crom tồn tại ở nhiều trạng thái oxi hóa như +2, +3 và +6.
- Crom tạo màng oxit bảo vệ, chống lại sự ăn mòn trong không khí và nước.

Tính Chất Vật Lí và Hóa Học Của Crom
Crom (Cr) là một nguyên tố kim loại chuyển tiếp nằm ở nhóm VIB trong bảng tuần hoàn, với số hiệu nguyên tử 24. Nó có một số tính chất vật lý và hóa học đặc biệt, đóng vai trò quan trọng trong nhiều ứng dụng công nghiệp.
- Tính chất vật lý:
- Crom có màu trắng xanh, bề mặt sáng bóng và rất cứng.
- Khối lượng riêng của crom là \( \rho = 7.19 \, g/cm^3 \).
- Nhiệt độ nóng chảy cao: \( T_m = 1907^\circ C \).
- Crom có tính dẫn điện và dẫn nhiệt tốt.
- Tính chất hóa học:
- Crom là kim loại dễ bị oxy hóa và có nhiều mức oxi hóa, trong đó +2, +3 và +6 là phổ biến nhất.
- Crom phản ứng mạnh với axit clohydric (HCl), tạo ra khí hidro (H₂) và muối crom (II) clorua.
- Trong không khí, crom tạo thành lớp oxit bảo vệ mỏng giúp chống lại quá trình ăn mòn.

Trạng Thái Tự Nhiên và Điều Chế Crom
Crom (Cr) là một kim loại được tìm thấy trong tự nhiên chủ yếu dưới dạng quặng. Trạng thái tự nhiên của crom đóng vai trò quan trọng trong quá trình điều chế và ứng dụng công nghiệp. Dưới đây là chi tiết về trạng thái tự nhiên và các phương pháp điều chế crom.
- Trạng thái tự nhiên:
- Crom không tồn tại ở dạng nguyên chất trong tự nhiên mà chủ yếu xuất hiện dưới dạng hợp chất. Quặng phổ biến nhất chứa crom là chromit \((FeCr_2O_4)\).
- Crom thường được khai thác từ các mỏ quặng nằm ở Nam Phi, Kazakhstan, và Ấn Độ.
- Điều chế crom:
- Crom được điều chế chủ yếu bằng cách khử oxit crom \((Cr_2O_3)\) với nhôm theo phương pháp nhiệt nhôm: \[ Cr_2O_3 + 2Al \rightarrow 2Cr + Al_2O_3 \]
- Quá trình này tạo ra crom ở dạng nguyên chất.
- Một phương pháp khác để điều chế crom là điện phân dung dịch muối crom hoặc oxit crom.

Ứng Dụng Của Crom Trong Công Nghiệp và Đời Sống
Crom là một kim loại có nhiều ứng dụng quan trọng trong cả công nghiệp và đời sống hàng ngày nhờ vào các tính chất đặc biệt của nó như độ cứng, khả năng chống ăn mòn, và màu sắc sáng bóng.
- Trong công nghiệp:
- Thép không gỉ: Crom là thành phần chính trong sản xuất thép không gỉ, giúp chống ăn mòn và tạo độ bền cho hợp kim.
- Mạ điện: Crom được sử dụng để mạ các bề mặt kim loại, tạo độ bóng và bảo vệ chống lại quá trình oxy hóa và mài mòn.
- Sản xuất hợp kim: Crom được dùng để tạo ra các hợp kim có độ cứng cao, chịu nhiệt tốt, ứng dụng trong ngành hàng không và chế tạo máy.
- Trong đời sống:
- Trang trí: Các sản phẩm mạ crom như linh kiện xe hơi, đồ trang sức thường được ưa chuộng vì vẻ ngoài sáng bóng và sang trọng.
- Mỹ phẩm: Các hợp chất crom đôi khi được sử dụng trong sản xuất mỹ phẩm, tạo màu sắc cho son môi và phấn mắt.
- Ngành dệt may: Crom cũng có vai trò trong việc nhuộm và xử lý vải.
XEM THÊM:
Crom Và Các Hợp Chất Phổ Biến
Crom tồn tại dưới nhiều dạng hợp chất khác nhau, mỗi hợp chất có ứng dụng và đặc tính riêng. Các hợp chất của crom thường được sử dụng rộng rãi trong nhiều lĩnh vực công nghiệp và đời sống.
- Crom(III) Oxit \((Cr_2O_3)\):
- Được sử dụng làm chất màu trong công nghiệp sơn và gốm sứ.
- Có tính chất chống ăn mòn và làm lớp phủ bảo vệ trên các bề mặt kim loại.
- Crom(VI) Oxit \((CrO_3)\):
- Là chất oxy hóa mạnh, thường được dùng trong mạ crom và sản xuất chất nhuộm.
- Tuy nhiên, Crom(VI) có tính độc hại cao và cần được xử lý cẩn thận.
- Kali Dichromat \((K_2Cr_2O_7)\):
- Là một chất oxy hóa mạnh, thường được sử dụng trong ngành hóa phân tích và công nghiệp sản xuất thuốc nhuộm.
- Kali dichromat cũng có tính độc hại và cần được sử dụng trong điều kiện kiểm soát.
- Crom(III) Sulfat \((Cr_2(SO_4)_3)\):
- Được dùng trong công nghiệp thuộc da và sản xuất chất xúc tác.
- Là hợp chất ít độc hơn so với Crom(VI), an toàn hơn trong các ứng dụng công nghiệp.

Kết Luận
Crom (Cr) với số hiệu nguyên tử 24 là một nguyên tố hóa học quan trọng có nhiều ứng dụng trong công nghiệp và đời sống. Đặc biệt, Crom nổi bật với tính chất chống ăn mòn và khả năng tạo ra hợp kim có độ bền cao, chẳng hạn như thép không gỉ. Điều này giúp tăng cường khả năng sử dụng trong các ngành công nghiệp từ luyện kim đến sản xuất hàng tiêu dùng.
Nhờ khả năng chống oxi hóa mạnh mẽ, Crom không chỉ được dùng để bảo vệ các bề mặt kim loại mà còn đóng vai trò quan trọng trong việc sản xuất các hợp chất hóa học đặc biệt như CrO₃, Cr₂O₃, và muối crom. Những hợp chất này có mặt trong các ngành công nghiệp từ da thuộc, nhuộm màu, cho đến sản xuất thủy tinh.
Trạng thái tự nhiên của Crom phổ biến ở dạng quặng cromit (FeCr₂O₄), là nguồn tài nguyên chủ yếu để sản xuất Crom kim loại qua phương pháp nhiệt nhôm. Từ những đặc tính vượt trội, Crom đã trở thành một trong những nguyên tố không thể thiếu trong việc phát triển công nghệ và sản xuất hiện đại, đồng thời góp phần nâng cao chất lượng sản phẩm và cuộc sống.