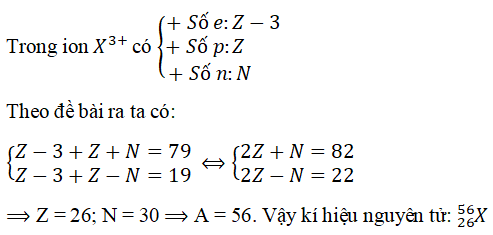Chủ đề số hiệu nguyên tử 11: Số hiệu nguyên tử 11 đại diện cho nguyên tố Natri (Na), một kim loại kiềm phổ biến với nhiều ứng dụng quan trọng trong đời sống và công nghiệp. Với đặc tính mềm, màu trắng bạc và khả năng phản ứng mạnh với nước, Natri đóng vai trò thiết yếu trong sản xuất hóa chất, làm sạch kim loại, và là thành phần chính trong muối ăn. Cùng khám phá chi tiết về nguyên tố này trong bài viết!
Mục lục
- Số Hiệu Nguyên Tử 11 - Natri (Na)
- 1. Giới Thiệu Về Số Hiệu Nguyên Tử 11
- 2. Cấu Hình Electron và Tính Chất Của Natri
- 3. Tính Chất Vật Lý của Natri
- 4. Phản Ứng Hóa Học Của Natri
- 5. Ứng Dụng Của Natri Trong Đời Sống
- 6. Tác Động Môi Trường Của Natri
- 7. So Sánh Natri Với Các Kim Loại Kiềm Khác
- 8. Bài Tập Thực Hành và Câu Hỏi Ôn Tập
- 9. Kết Luận
Số Hiệu Nguyên Tử 11 - Natri (Na)
Số hiệu nguyên tử 11 thuộc về nguyên tố Natri, ký hiệu hóa học là Na. Đây là một kim loại kiềm nằm trong chu kỳ 3 và nhóm I của bảng tuần hoàn các nguyên tố hóa học.
Đặc Điểm Cấu Tạo Nguyên Tử
- Cấu tạo: Nguyên tử của Natri bao gồm 11 proton, 11 electron và một số neutron nhất định tùy thuộc vào đồng vị.
- Vỏ electron: Natri có 3 lớp electron với cấu hình electron là 1s2 2s2 2p6 3s1.
Tính Chất Hóa Học
- Natri là một kim loại hoạt động mạnh, dễ phản ứng với nước tạo ra khí hydro và hydroxide natri (\( NaOH \)).
- Phản ứng mạnh với các phi kim như clo tạo ra muối natri clorua (\( NaCl \)).
- Là một trong những kim loại có tính khử mạnh, thường được dùng trong các phản ứng trao đổi ion.
Tầm Quan Trọng Của Số Hiệu Nguyên Tử
- Xác định vị trí trong bảng tuần hoàn: Số hiệu nguyên tử giúp xác định chính xác vị trí của nguyên tố trong bảng tuần hoàn.
- Quyết định tính chất hóa học: Tính chất hóa học của Natri phụ thuộc trực tiếp vào số lượng proton và cách sắp xếp các electron.
- Phân biệt với các nguyên tố khác: Mỗi nguyên tố có số hiệu nguyên tử duy nhất, giúp phân biệt rõ ràng với các nguyên tố khác.
Ví Dụ Về Các Nguyên Tố Khác Với Số Hiệu Nguyên Tử
| Nguyên Tố | Ký Hiệu | Số Hiệu Nguyên Tử |
|---|---|---|
| Hydro | H | 1 |
| Heli | He | 2 |
| Lithium | Li | 3 |
| Natri | Na | 11 |
Kết Luận
Số hiệu nguyên tử là một khái niệm cơ bản nhưng vô cùng quan trọng trong hóa học. Đối với Natri, số hiệu nguyên tử 11 không chỉ xác định vị trí của nó trong bảng tuần hoàn mà còn quyết định tính chất hóa học, giúp chúng ta hiểu rõ hơn về vai trò và ứng dụng của nó trong đời sống và công nghiệp.

.png)
1. Giới Thiệu Về Số Hiệu Nguyên Tử 11
Số hiệu nguyên tử 11 là đặc trưng của nguyên tố Natri (Na), một kim loại kiềm thuộc nhóm IA trong bảng tuần hoàn các nguyên tố hóa học. Natri có ký hiệu hóa học là Na, được lấy từ từ “Natrium” trong tiếng Latinh. Với số hiệu nguyên tử là 11, Natri có 11 proton trong hạt nhân và thường có 11 electron xung quanh.
Natri là một kim loại mềm, màu trắng bạc và có khả năng phản ứng mạnh, đặc biệt với nước, tạo ra khí hydro và dung dịch kiềm. Natri là một trong những kim loại phổ biến nhất và thường tồn tại dưới dạng hợp chất, chẳng hạn như Natri clorua (NaCl) - muối ăn, rất quan trọng trong đời sống hàng ngày.
- Vị trí trong bảng tuần hoàn: Nhóm 1, chu kỳ 3.
- Cấu hình electron: \( 1s^2 2s^2 2p^6 3s^1 \).
- Khối lượng nguyên tử: 22.99 u.
- Trạng thái vật lý ở nhiệt độ phòng: Rắn.
Với các tính chất nổi bật như tính dẫn điện tốt và phản ứng mạnh với nước, Natri đóng vai trò quan trọng trong nhiều ngành công nghiệp, từ sản xuất hóa chất, xà phòng, thủy tinh đến làm sạch kim loại. Các hợp chất của Natri cũng được sử dụng rộng rãi trong y tế và thực phẩm, làm cho nó trở thành một nguyên tố không thể thiếu trong cuộc sống hàng ngày.
2. Cấu Hình Electron và Tính Chất Của Natri
Natri (Na) là một nguyên tố thuộc nhóm IA trong bảng tuần hoàn, với số hiệu nguyên tử là 11. Cấu hình electron của natri cho thấy cách các electron được phân bố trong các lớp vỏ xung quanh hạt nhân nguyên tử, từ đó xác định vị trí và tính chất của nguyên tố này.
- Cấu hình electron của Natri:
- Cấu hình electron của nguyên tử natri là \( 1s^2 2s^2 2p^6 3s^1 \).
- Viết gọn: [Ne]\( 3s^1 \).
- Cấu hình electron này cho thấy natri có 11 electron được phân bố trong ba lớp: lớp thứ nhất chứa 2 electron, lớp thứ hai chứa 8 electron, và lớp thứ ba chứa 1 electron.
Tính chất của Natri:
- Natri là một kim loại kiềm thuộc nhóm IA, có tính khử mạnh do có một electron hóa trị ở lớp ngoài cùng (3s1).
- Trong các phản ứng hóa học, natri thường nhường 1 electron để đạt cấu hình bền vững của neon (Ne), thể hiện tính khử mạnh của kim loại này:
- \( Na \rightarrow Na^+ + e^- \)
- Các phản ứng hóa học tiêu biểu:
- Phản ứng với nước: Natri phản ứng mạnh với nước tạo thành natri hydroxide (\( NaOH \)) và khí hydro (\( H_2 \)).
- \[ 2Na + 2H_2O \rightarrow 2NaOH + H_2 \]
- Phản ứng với oxy: Tùy thuộc vào điều kiện, natri có thể tạo thành natri oxide (\( Na_2O \)) hoặc natri peroxide (\( Na_2O_2 \)).
- \[ 4Na + O_2 \rightarrow 2Na_2O \]
- \[ 2Na + O_2 \rightarrow Na_2O_2 \]
- Phản ứng với halogen: Natri dễ dàng phản ứng với clo để tạo ra muối natri chloride (\( NaCl \)).
- \[ 2Na + Cl_2 \rightarrow 2NaCl \]
- Natri có nhiệt độ nóng chảy là 97.8°C và nhiệt độ sôi là 883°C.
Tính chất hóa học đặc biệt của natri, như khả năng phản ứng mạnh với nước và oxy, đã khiến nó trở thành một nguyên tố quan trọng trong công nghiệp và đời sống, như sản xuất xà phòng, thủy tinh, và nhiều hợp chất hóa học khác.

3. Tính Chất Vật Lý của Natri
Natri (Na) là một kim loại kiềm mềm, màu trắng bạc, thuộc nhóm IA trong bảng tuần hoàn. Dưới đây là một số tính chất vật lý nổi bật của natri:
- Trạng thái và màu sắc: Natri tồn tại ở trạng thái rắn ở nhiệt độ phòng. Kim loại này có màu trắng bạc, ánh kim, và sáng bóng khi vừa mới cắt.
- Độ mềm: Natri là kim loại rất mềm, dễ cắt bằng dao. Điều này là do cấu trúc tinh thể của nó khá yếu với liên kết kim loại không bền vững.
- Nhiệt độ nóng chảy và sôi: Natri có nhiệt độ nóng chảy thấp khoảng \(98 \, ^\circ \text{C}\) và nhiệt độ sôi là \(883 \, ^\circ \text{C}\). Điều này khiến natri dễ dàng chuyển đổi trạng thái khi gặp nhiệt độ cao.
- Khối lượng riêng: Natri có khối lượng riêng thấp, khoảng \(0.97 \, \text{g/cm}^3\), nhẹ hơn nước, cho phép nó nổi trên bề mặt chất lỏng.
- Độ dẫn điện và dẫn nhiệt: Natri là một chất dẫn điện và dẫn nhiệt tốt, do các electron tự do di chuyển dễ dàng trong cấu trúc kim loại.
Các tính chất này làm cho natri trở nên đặc biệt và có nhiều ứng dụng trong công nghiệp, như sử dụng trong sản xuất các hợp chất hóa học và trong các loại pin.

XEM THÊM:
4. Phản Ứng Hóa Học Của Natri
Natri là một kim loại kiềm có tính phản ứng rất mạnh, đặc biệt là với nước và các phi kim. Do có chỉ số điện tích hạt nhân nhỏ, natri dễ mất electron, từ đó tham gia vào nhiều phản ứng hóa học với tính khử mạnh. Dưới đây là một số phản ứng hóa học tiêu biểu của natri:
- Phản ứng với nước: Natri phản ứng mạnh với nước tạo ra natri hydroxide và khí hydro, đồng thời giải phóng nhiệt lượng lớn. Phương trình phản ứng: \[ 2Na + 2H_2O \rightarrow 2NaOH + H_2 \uparrow \] Phản ứng này rất mãnh liệt, có thể gây nổ nếu không kiểm soát cẩn thận.
- Phản ứng với oxy: Khi đốt trong không khí, natri phản ứng với oxy tạo ra natri oxit (\(Na_2O\)) hoặc natri peroxit (\(Na_2O_2\)) tùy thuộc vào điều kiện. Phương trình phản ứng:
- Natri oxit: \[ 4Na + O_2 \rightarrow 2Na_2O \]
- Natri peroxit: \[ 2Na + O_2 \rightarrow Na_2O_2 \]
- Phản ứng với halogen: Natri phản ứng trực tiếp với các halogen (F, Cl, Br, I) tạo ra muối halogenua tương ứng như natri clorua (\(NaCl\)), natri bromua (\(NaBr\)). Phương trình phản ứng với clo: \[ 2Na + Cl_2 \rightarrow 2NaCl \] Phản ứng này thường xảy ra nhanh chóng và phát ra ánh sáng.
- Phản ứng với axit: Natri phản ứng với axit mạnh như axit hydrochloric (\(HCl\)) tạo ra muối natri clorua và khí hydro: \[ 2Na + 2HCl \rightarrow 2NaCl + H_2 \uparrow \] Đây là một phản ứng nhanh và sinh khí.
Ngoài ra, natri còn có thể phản ứng với nhiều chất khác như anhidrit, các kim loại khác trong phản ứng khử, và đóng vai trò quan trọng trong nhiều phản ứng hóa học công nghiệp.

5. Ứng Dụng Của Natri Trong Đời Sống
Natri (Na) là một kim loại kiềm có số hiệu nguyên tử là 11. Đây là nguyên tố đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp. Dưới đây là những ứng dụng phổ biến của natri:
- 1. Sử dụng trong ngành hóa chất: Natri là một chất khử mạnh và thường được sử dụng để điều chế các kim loại khác thông qua quá trình khử hóa học. Natri kim loại được dùng trong các phản ứng tổng hợp hóa học để sản xuất hợp chất hữu cơ và vô cơ.
- 2. Ứng dụng trong ngành công nghiệp thực phẩm: Natri clorua (muối ăn) là một hợp chất của natri không thể thiếu trong cuộc sống hằng ngày. Ngoài việc là gia vị trong nấu ăn, natri clorua còn được sử dụng trong quá trình bảo quản thực phẩm.
- 3. Sử dụng trong y tế: Natri bicarbonate (baking soda) được dùng như một chất kháng acid giúp điều trị chứng khó tiêu, ợ nóng và các vấn đề liên quan đến axit dạ dày. Bên cạnh đó, natri clorua được dùng trong dung dịch tiêm truyền để cung cấp điện giải cho cơ thể.
- 4. Ứng dụng trong sản xuất xà phòng và chất tẩy rửa: Natri hydroxide (NaOH) là thành phần quan trọng trong sản xuất xà phòng, chất tẩy rửa, và nhiều sản phẩm làm sạch khác.
- 5. Sử dụng trong ngành công nghiệp năng lượng: Natri kim loại được dùng trong một số loại pin và hệ thống làm mát của các lò phản ứng hạt nhân nhờ khả năng dẫn nhiệt tốt và không phản ứng với nơtron.
Nhờ những đặc tính nổi bật, natri đã trở thành một nguyên tố thiết yếu với vai trò đa dạng trong nhiều lĩnh vực, góp phần cải thiện chất lượng cuộc sống và thúc đẩy sự phát triển của ngành công nghiệp.
6. Tác Động Môi Trường Của Natri
Natri, dù có nhiều ứng dụng quan trọng trong đời sống và công nghiệp, cũng gây ra một số tác động đến môi trường. Dưới đây là một số ảnh hưởng chính của natri đối với môi trường:
- 1. Ảnh hưởng đến nguồn nước: Natri, khi thải ra môi trường, có thể hòa tan vào nguồn nước. Đặc biệt, natri từ muối đường hay từ các hoạt động công nghiệp có thể làm thay đổi độ mặn và độ pH của nước, gây hại cho các loài thủy sinh.
- 2. Gây xói mòn đất: Natri trong nước tưới có thể làm tăng độ mặn của đất, gây xói mòn và giảm độ phì nhiêu. Điều này ảnh hưởng tiêu cực đến nông nghiệp, làm giảm năng suất cây trồng.
- 3. Ảnh hưởng đến đời sống động thực vật: Nồng độ natri cao trong môi trường có thể gây độc cho nhiều loài động thực vật, đặc biệt là những loài nhạy cảm với thay đổi độ mặn. Điều này có thể dẫn đến sự suy giảm đa dạng sinh học.
- 4. Gây ô nhiễm không khí: Natri kim loại phản ứng mạnh với không khí, tạo ra khói và các hợp chất có thể gây ô nhiễm không khí, ảnh hưởng đến sức khỏe con người và động vật.
- 5. Khả năng tích tụ trong sinh vật: Natri có thể tích tụ trong chuỗi thức ăn, ảnh hưởng đến các loài động vật cao cấp hơn. Việc kiểm soát và quản lý chất thải chứa natri là cần thiết để bảo vệ môi trường.
Nhằm giảm thiểu tác động môi trường của natri, cần có các biện pháp quản lý và xử lý chất thải khoa học, đồng thời nâng cao nhận thức về việc sử dụng hợp lý các hợp chất chứa natri trong sản xuất và sinh hoạt.

7. So Sánh Natri Với Các Kim Loại Kiềm Khác
7.1. So Sánh Với Lithium và Kali
Natri (Na), Lithium (Li), và Kali (K) đều là các kim loại kiềm thuộc nhóm IA trong bảng tuần hoàn, có cấu trúc electron tương tự nhau với một electron ở lớp ngoài cùng. Tuy nhiên, chúng có một số khác biệt đáng chú ý:
- Khối lượng nguyên tử: Natri có khối lượng nguyên tử lớn hơn Lithium nhưng nhỏ hơn Kali.
- Năng lượng ion hóa: Natri có năng lượng ion hóa thấp hơn Lithium nhưng cao hơn Kali, do đó nó dễ dàng mất electron hơn so với Lithium nhưng khó hơn so với Kali.
- Độ âm điện: Độ âm điện của Natri thấp hơn Lithium nhưng cao hơn Kali, cho thấy khả năng hút electron của Natri ở mức trung bình so với hai kim loại còn lại.
- Tính chất vật lý: Natri mềm hơn Lithium nhưng cứng hơn Kali, đồng thời có nhiệt độ nóng chảy thấp hơn Lithium nhưng cao hơn Kali.
7.2. Đặc Điểm Khác Biệt Trong Phản Ứng Hóa Học
Các kim loại kiềm như Natri, Lithium, và Kali đều phản ứng mạnh với nước, tạo ra hydro và một dung dịch kiềm. Tuy nhiên, mức độ phản ứng của chúng khác nhau:
- Phản ứng với nước: Natri phản ứng với nước nhanh hơn Lithium nhưng chậm hơn Kali. Phản ứng của Natri tạo ra dung dịch natri hydroxit (NaOH) và khí hydro (H2).
- Phản ứng với oxy: Natri dễ dàng bị oxy hóa tạo thành natri oxit (Na2O), trong khi Lithium tạo thành lithium oxit (Li2O) và Kali tạo thành kali oxit (K2O).
- Phản ứng với halogen: Natri, giống như Lithium và Kali, phản ứng mạnh với các halogen như clo (Cl2), tạo ra muối natri clorua (NaCl).
7.3. Ứng Dụng Đặc Thù Của Từng Nguyên Tố
Mỗi kim loại kiềm có những ứng dụng đặc thù dựa trên tính chất hóa học và vật lý của chúng:
- Natri (Na): Được sử dụng rộng rãi trong sản xuất muối ăn (NaCl), xà phòng, và natri hydroxit (NaOH). Natri cũng được dùng làm chất khử trong nhiều phản ứng hóa học.
- Lithium (Li): Được sử dụng trong pin lithium-ion, hợp kim nhẹ, và trong ngành công nghiệp gốm sứ.
- Kali (K): Được dùng nhiều trong phân bón (KCl), trong sản xuất thuốc nổ và trong một số loại kính chịu nhiệt.

8. Bài Tập Thực Hành và Câu Hỏi Ôn Tập
Dưới đây là một số bài tập và câu hỏi ôn tập nhằm củng cố kiến thức về số hiệu nguyên tử, số khối và cấu tạo của nguyên tử. Các bài tập được thiết kế để giúp bạn hiểu sâu hơn về các khái niệm cơ bản trong hóa học.
Bài Tập Thực Hành
-
Nguyên tố X có số hiệu nguyên tử Z = 11. Hãy xác định:
Số proton, neutron và electron của nguyên tử X.
Số khối của nguyên tử X nếu số neutron là 12.
-
Cho biết tổng số hạt proton, neutron và electron trong nguyên tử của nguyên tố Y là 34. Nếu số hạt mang điện gấp 1,8333 lần số hạt không mang điện, hãy xác định:
Số hiệu nguyên tử Z của Y.
Số khối của Y.
-
Nguyên tố M có tổng số hạt proton, neutron và electron là 40. Nếu tổng số hạt mang điện nhiều hơn số hạt không mang điện là 12, hãy xác định:
Số hiệu nguyên tử Z của M.
Số khối của M.
Câu Hỏi Ôn Tập
-
Kí hiệu nguyên tử biểu thị những thông tin nào sau đây?
A. Số khối.
B. Số hiệu nguyên tử Z.
C. Nguyên tử khối của nguyên tử.
D. Số khối A và số hiệu nguyên tử Z.
-
Nguyên tố hóa học là những nguyên tử có cùng đặc điểm nào dưới đây?
A. Số khối.
B. Số neutron.
C. Số proton.
D. Số neutron và số proton.
-
Nguyên tố Cacbon có hai đồng vị là 12C và 13C. Tính nguyên tử khối trung bình của Cacbon nếu 12C chiếm 98,89% và 13C chiếm 1,11%.
A. 12,500
B. 12,011
C. 12,022
D. 12,055
9. Kết Luận
Số hiệu nguyên tử là một khái niệm cơ bản và quan trọng trong hóa học, giúp xác định các đặc tính cơ bản của nguyên tử, chẳng hạn như số lượng proton và electron trong nguyên tử đó. Đối với nguyên tố Natri (Na), số hiệu nguyên tử là 11, nghĩa là trong hạt nhân của nguyên tử Natri có 11 proton và 11 electron bao quanh hạt nhân.
Hiểu biết về số hiệu nguyên tử không chỉ giúp chúng ta xác định vị trí của nguyên tố trong bảng tuần hoàn mà còn cung cấp thông tin quan trọng về tính chất hóa học của nguyên tố đó. Việc nắm vững khái niệm này là bước đầu quan trọng trong việc nghiên cứu và ứng dụng hóa học vào các lĩnh vực khác nhau như y học, công nghiệp và nghiên cứu khoa học.
Với số hiệu nguyên tử là 11, Natri là một nguyên tố rất quan trọng trong nhiều quá trình sinh học và công nghiệp. Nó đóng vai trò không thể thiếu trong việc duy trì cân bằng điện giải trong cơ thể con người và được sử dụng rộng rãi trong công nghiệp hóa chất. Như vậy, số hiệu nguyên tử không chỉ là một con số vô tri mà là một yếu tố mang tính quyết định trong nhiều lĩnh vực quan trọng.
Trong tổng thể, số hiệu nguyên tử không chỉ giúp chúng ta hiểu rõ hơn về bản chất của các nguyên tố hóa học mà còn mở ra nhiều ứng dụng thực tiễn trong đời sống. Việc nắm vững kiến thức về số hiệu nguyên tử sẽ giúp chúng ta có nền tảng vững chắc để tiếp tục khám phá và áp dụng các kiến thức khoa học trong thực tiễn.