Chủ đề số hiệu nguyên tử 26: Số hiệu nguyên tử 26 thuộc về nguyên tố sắt, một kim loại quan trọng với vô vàn ứng dụng trong công nghiệp và đời sống. Bài viết này sẽ giúp bạn khám phá sâu hơn về tính chất, ứng dụng, và vai trò của sắt, đồng thời tìm hiểu lịch sử và các phát hiện mới liên quan đến nguyên tố này.
Mục lục
- Số Hiệu Nguyên Tử 26
- 1. Giới Thiệu Chung Về Nguyên Tố Sắt (Fe)
- 2. Tính Chất Hóa Học Của Sắt
- 3. Ứng Dụng Của Sắt Trong Đời Sống
- 4. Sắt Trong Tự Nhiên
- 5. Tầm Quan Trọng Của Sắt
- 6. Các Phản Ứng Nổi Bật Của Sắt Trong Hóa Học
- 7. Lịch Sử Khám Phá Và Ứng Dụng Sắt
- 8. Các Dạng Hợp Chất Của Sắt
- 9. Tác Động Môi Trường Của Sắt
- 10. Các Công Nghệ Mới Liên Quan Đến Sắt
Số Hiệu Nguyên Tử 26
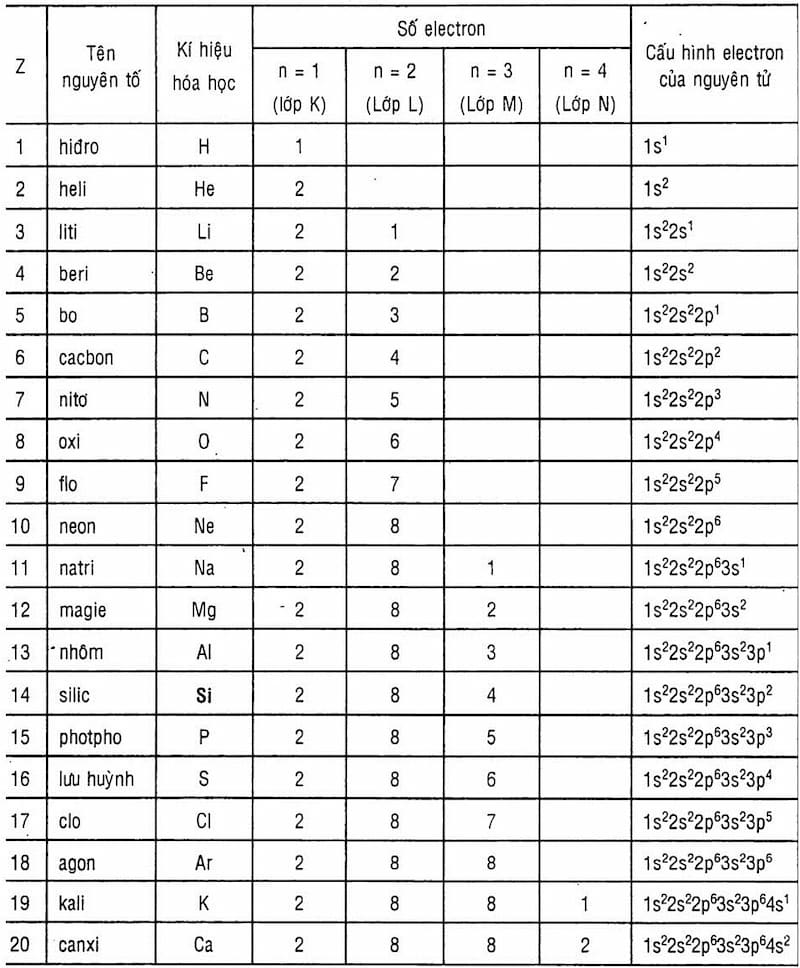
Số hiệu nguyên tử 26 tương ứng với nguyên tố sắt (Fe) trong bảng tuần hoàn các nguyên tố hóa học. Sắt là một kim loại chuyển tiếp có nhiều ứng dụng quan trọng trong đời sống và công nghiệp.
Thông Tin Cơ Bản Về Sắt (Fe)
- Ký hiệu hóa học: Fe
- Số hiệu nguyên tử: 26
- Nguyên tử khối: \[55,845 \, \text{u}\]
- Vị trí trong bảng tuần hoàn: Chu kỳ 4, Nhóm VIIIB
- Cấu hình electron: \[1s^2 2s^2 2p^6 3s^2 3p^6 3d^6 4s^2\]
Tính Chất Hóa Học Của Sắt
Sắt là kim loại có độ hoạt động trung bình, thường gặp ở hai trạng thái oxy hóa +2 và +3:
- Phản ứng với oxi tạo ra sắt(III) oxit: \[4Fe + 3O_2 \rightarrow 2Fe_2O_3\]
- Phản ứng với axit clohydric tạo ra sắt(II) clorua: \[Fe + 2HCl \rightarrow FeCl_2 + H_2\]
Ứng Dụng Của Sắt Trong Đời Sống
Sắt được sử dụng rộng rãi trong các lĩnh vực sau:
- Công nghiệp luyện kim: Sắt là nguyên liệu chính để sản xuất thép, được sử dụng trong xây dựng và sản xuất máy móc.
- Y tế: Sắt là thành phần quan trọng trong hemoglobin, giúp vận chuyển oxi trong máu.
- Công nghiệp hóa chất: Sắt được sử dụng để sản xuất nhiều loại hợp chất và chất xúc tác.
Sắt Trong Tự Nhiên
Sắt là nguyên tố phổ biến nhất trên Trái Đất theo khối lượng, chiếm khoảng 5% vỏ Trái Đất. Nó tồn tại dưới dạng các khoáng vật như hematit (\[Fe_2O_3\]) và magnetit (\[Fe_3O_4\]).
Tầm Quan Trọng Của Sắt
Sắt đóng vai trò quan trọng trong nhiều lĩnh vực khác nhau, từ xây dựng, sản xuất đến chăm sóc sức khỏe. Với những tính chất vượt trội, sắt là nguyên tố không thể thiếu trong cuộc sống con người.

.png)
1. Giới Thiệu Chung Về Nguyên Tố Sắt (Fe)
Sắt (\(Fe\)) là nguyên tố hóa học thuộc nhóm kim loại chuyển tiếp, nằm ở vị trí số 26 trong bảng tuần hoàn với số hiệu nguyên tử 26. Đây là nguyên tố có nhiều vai trò quan trọng trong cả khoa học và đời sống thường nhật. Sắt chiếm khoảng 5% khối lượng của lớp vỏ Trái Đất và là nguyên tố phổ biến thứ tư sau oxy, silicon và nhôm.
- Ký hiệu hóa học: \(Fe\)
- Số hiệu nguyên tử: 26
- Cấu hình electron: \([Ar]3d^6 4s^2\)
- Khối lượng nguyên tử: 55.845 u
Sắt có màu trắng bạc và rất dẻo, dễ uốn. Nó được sử dụng rộng rãi trong các ngành công nghiệp, đặc biệt là trong ngành sản xuất thép, một hợp kim quan trọng được sử dụng trong xây dựng và sản xuất các công cụ, máy móc.
Với vai trò là một nguyên tố thiết yếu, sắt cũng có mặt trong cơ thể con người dưới dạng hemoglobin - một protein trong máu có nhiệm vụ vận chuyển oxy từ phổi đến các mô.
| Tính chất hóa học | Đặc điểm |
| Trạng thái oxy hóa phổ biến | \(+2, +3\) |
| Nhiệt độ nóng chảy | 1538°C |
| Nhiệt độ sôi | 2862°C |
Nhờ những đặc tính hóa học và vật lý đặc biệt, sắt không chỉ đóng vai trò quan trọng trong khoa học và công nghiệp mà còn có tác động mạnh mẽ đến đời sống con người, đặc biệt trong y học và sinh học.
2. Tính Chất Hóa Học Của Sắt
Sắt (\(Fe\)) là một kim loại hoạt động, với khả năng tham gia vào nhiều phản ứng hóa học quan trọng. Sắt thường tồn tại ở hai trạng thái oxy hóa phổ biến là \(+2\) (sắt(II), ferrous) và \(+3\) (sắt(III), ferric), với các tính chất hóa học đa dạng:
- Phản ứng với phi kim: Sắt dễ dàng phản ứng với nhiều phi kim như oxy, lưu huỳnh để tạo thành oxit và sunfua sắt.
- Với oxy: Sắt phản ứng với oxy trong không khí để tạo thành oxit sắt, hay còn gọi là gỉ sắt. Phản ứng tổng quát: \[ 4Fe + 3O_2 \rightarrow 2Fe_2O_3 \]
- Với lưu huỳnh: Sắt kết hợp với lưu huỳnh khi đun nóng để tạo thành sunfua sắt: \[ Fe + S \rightarrow FeS \]
- Phản ứng với axit: Sắt phản ứng với nhiều loại axit, giải phóng khí hydro và tạo thành muối sắt tương ứng. Ví dụ, với axit clohydric (\(HCl\)): \[ Fe + 2HCl \rightarrow FeCl_2 + H_2 \]
- Phản ứng với dung dịch muối: Sắt có thể thay thế kim loại kém hoạt động hơn trong các dung dịch muối của chúng, tạo thành muối sắt và giải phóng kim loại ít hoạt động hơn.
- Phản ứng với nước: Sắt không phản ứng với nước ở nhiệt độ thường, nhưng khi nung nóng, nó có thể phản ứng với nước tạo ra oxit sắt và khí hydro: \[ 3Fe + 4H_2O \rightarrow Fe_3O_4 + 4H_2 \]
Những tính chất hóa học này làm cho sắt trở thành một nguyên tố có vai trò quan trọng trong nhiều lĩnh vực, từ sản xuất thép đến các ứng dụng trong công nghiệp và đời sống hằng ngày.

3. Ứng Dụng Của Sắt Trong Đời Sống
Sắt (\(Fe\)) là một trong những kim loại có tầm quan trọng đặc biệt trong đời sống con người, nhờ vào các tính chất cơ lý và hóa học nổi bật. Dưới đây là một số ứng dụng chính của sắt:
- Sản xuất thép: Sắt là nguyên liệu chính trong sản xuất thép, một hợp kim có độ bền cao, được sử dụng rộng rãi trong xây dựng cầu đường, nhà cửa, và các công trình hạ tầng khác.
- Chế tạo máy móc: Sắt và hợp kim của nó được sử dụng để chế tạo nhiều loại máy móc và thiết bị công nghiệp, từ động cơ đến các linh kiện máy móc.
- Ứng dụng trong y tế: Sắt là thành phần quan trọng của hemoglobin trong máu, đóng vai trò thiết yếu trong việc vận chuyển oxy trong cơ thể. Sắt cũng được sử dụng trong các thiết bị y tế và thuốc bổ sung sắt.
- Sản xuất đồ gia dụng: Nhiều sản phẩm gia dụng như dao kéo, nồi, chảo được làm từ sắt hoặc thép không gỉ, mang lại độ bền cao và khả năng chống ăn mòn.
- Ứng dụng trong năng lượng: Sắt cũng được sử dụng trong các thiết bị sản xuất và lưu trữ năng lượng như pin và nam châm, giúp nâng cao hiệu suất và độ bền của các thiết bị này.
- Ứng dụng trong giao thông: Đường ray xe lửa và nhiều bộ phận của các phương tiện giao thông, như ô tô và tàu hỏa, cũng được chế tạo từ sắt và thép.
Nhờ vào các ứng dụng rộng rãi trong nhiều lĩnh vực, sắt đóng một vai trò không thể thiếu trong đời sống hiện đại, từ xây dựng cơ sở hạ tầng đến cải thiện sức khỏe cộng đồng.

4. Sắt Trong Tự Nhiên
Sắt (\(Fe\)) là nguyên tố phổ biến nhất trên Trái Đất, chiếm khoảng 5% khối lượng của lớp vỏ Trái Đất. Trong tự nhiên, sắt không tồn tại ở dạng nguyên chất mà thường xuất hiện dưới dạng các hợp chất và khoáng vật khác nhau. Các nguồn sắt tự nhiên chính bao gồm:
- Quặng sắt: Sắt thường tồn tại dưới dạng các khoáng vật như hematit (\(Fe_2O_3\)), magnetit (\(Fe_3O_4\)), limonit (\(FeO(OH)\)), và siderit (\(FeCO_3\)). Trong đó, hematit và magnetit là hai loại quặng sắt phổ biến nhất và là nguồn cung cấp sắt chính trong công nghiệp.
- Sắt trong thiên thạch: Một lượng lớn sắt cũng được tìm thấy trong các thiên thạch, đặc biệt là loại thiên thạch sắt-nickel. Thiên thạch sắt có thể chứa tới 90% sắt kim loại và được coi là nguồn sắt từ vũ trụ.
- Sắt trong sinh vật: Sắt cũng là một thành phần thiết yếu trong nhiều sinh vật sống. Trong cơ thể con người, sắt là thành phần quan trọng của hemoglobin, myoglobin, và nhiều enzyme khác, đóng vai trò quan trọng trong quá trình hô hấp và trao đổi chất.
- Sắt trong nước: Sắt có thể tồn tại trong nước dưới dạng ion (\(Fe^{2+}\) và \(Fe^{3+}\)) hoặc các phức chất hòa tan. Mặc dù hàm lượng sắt trong nước thường rất thấp, nhưng nó có vai trò quan trọng trong chu trình sinh hóa của hệ sinh thái nước.
Sự phân bố rộng rãi của sắt trong tự nhiên và vai trò của nó trong các quá trình địa chất và sinh học đã khiến nguyên tố này trở thành một trong những thành phần quan trọng nhất của Trái Đất và vũ trụ.

5. Tầm Quan Trọng Của Sắt
Sắt (\(Fe\)) là một nguyên tố có tầm quan trọng vô cùng lớn trong nhiều lĩnh vực của cuộc sống. Từ các ứng dụng trong công nghiệp, y tế đến vai trò sinh học trong cơ thể con người, sắt đóng một vai trò không thể thiếu. Dưới đây là một số khía cạnh quan trọng của sắt:
- Trong công nghiệp: Sắt là nguyên liệu chính để sản xuất thép, hợp kim quan trọng nhất trong xây dựng và chế tạo. Sắt thép là nền tảng của các công trình cơ sở hạ tầng như cầu, đường, tòa nhà, và các phương tiện giao thông.
- Trong y tế: Sắt là thành phần thiết yếu của hemoglobin, protein trong hồng cầu chịu trách nhiệm vận chuyển oxy từ phổi đến các cơ quan. Thiếu sắt có thể dẫn đến bệnh thiếu máu, ảnh hưởng nghiêm trọng đến sức khỏe.
- Trong sinh học: Sắt đóng vai trò quan trọng trong nhiều enzyme và protein, tham gia vào các quá trình trao đổi chất, hô hấp và tổng hợp DNA. Nó cũng ảnh hưởng đến hệ miễn dịch, giúp cơ thể chống lại các bệnh nhiễm trùng.
- Trong năng lượng: Sắt được sử dụng trong sản xuất nam châm, pin, và nhiều thiết bị điện tử khác. Các hợp chất của sắt cũng có vai trò quan trọng trong công nghệ lưu trữ và truyền tải năng lượng.
- Trong đời sống hàng ngày: Các dụng cụ, thiết bị gia đình, đồ dùng nhà bếp, và nhiều sản phẩm tiêu dùng khác đều chứa sắt hoặc được sản xuất từ các hợp chất của sắt, giúp cải thiện chất lượng cuộc sống.
Với những ứng dụng đa dạng và vai trò thiết yếu, sắt không chỉ là một nguyên tố hóa học mà còn là nguồn lực quan trọng, góp phần phát triển và duy trì các hoạt động sống cũng như công nghiệp trên toàn cầu.
XEM THÊM:
6. Các Phản Ứng Nổi Bật Của Sắt Trong Hóa Học
Sắt (\(Fe\)) là một kim loại chuyển tiếp có khả năng tham gia vào nhiều phản ứng hóa học quan trọng. Dưới đây là một số phản ứng nổi bật mà sắt có thể tham gia:
- Phản ứng với oxi: Sắt phản ứng với oxi tạo ra oxit sắt. Phản ứng này thường được quan sát khi sắt bị rỉ sét, tạo ra lớp \(Fe_2O_3\) màu nâu đỏ trên bề mặt sắt: \[ 4Fe + 3O_2 \rightarrow 2Fe_2O_3 \]
- Phản ứng với axit: Sắt phản ứng với axit clohidric (\(HCl\)) để tạo ra sắt(II) clorua (\(FeCl_2\)) và khí hydro (\(H_2\)). Đây là một phản ứng phổ biến trong hóa học vô cơ: \[ Fe + 2HCl \rightarrow FeCl_2 + H_2 \]
- Phản ứng khử oxi hóa: Sắt có khả năng đóng vai trò như một chất khử hoặc chất oxi hóa trong các phản ứng khử oxi hóa. Ví dụ, sắt có thể bị oxi hóa từ \(Fe^{2+}\) lên \(Fe^{3+}\), hoặc bị khử từ \(Fe^{3+}\) xuống \(Fe^{2+}\): \[ Fe^{2+} \rightarrow Fe^{3+} + e^- \]
- Phản ứng với nước: Sắt phản ứng với nước ở nhiệt độ cao để tạo ra oxit sắt và khí hydro. Phản ứng này diễn ra khi sắt được nung nóng trong hơi nước: \[ 3Fe + 4H_2O \rightarrow Fe_3O_4 + 4H_2 \]
- Phản ứng với halogen: Sắt phản ứng với các halogen như clo (\(Cl_2\)) tạo ra muối sắt halide. Ví dụ, sắt phản ứng với clo tạo thành sắt(III) clorua (\(FeCl_3\)): \[ 2Fe + 3Cl_2 \rightarrow 2FeCl_3 \]
Những phản ứng trên minh chứng cho tính hoạt động mạnh mẽ của sắt trong các quá trình hóa học, từ đó cho thấy vai trò quan trọng của sắt trong nhiều ngành công nghiệp và ứng dụng thực tiễn.

7. Lịch Sử Khám Phá Và Ứng Dụng Sắt
Sắt là một trong những nguyên tố được con người biết đến từ rất sớm trong lịch sử. Từ thời kỳ cổ đại, sắt đã đóng vai trò quan trọng trong việc chế tạo các công cụ và vũ khí, giúp con người tiến bộ trong cuộc sống hàng ngày và chiến tranh.
7.1 Lịch Sử Khám Phá Sắt
Sắt đã được con người phát hiện và sử dụng từ khoảng 5000 năm trước Công nguyên. Tuy nhiên, ban đầu, sắt chỉ được tìm thấy ở dạng thiên thạch. Những mảnh sắt thiên thạch này đã được sử dụng để chế tạo các đồ trang sức và vũ khí đầu tiên.
Khoảng năm 1200 trước Công nguyên, con người đã học được cách chiết xuất sắt từ quặng bằng cách nung nóng trong lò luyện. Quá trình này đã mở ra một kỷ nguyên mới trong lịch sử nhân loại, được gọi là Thời đại Đồ Sắt.
7.2 Sắt Qua Các Thời Kỳ Lịch Sử
- Thời kỳ Đồ Sắt: Sắt trở thành nguyên liệu chính để chế tạo vũ khí và công cụ, thay thế cho đồng và đá. Điều này đã giúp các nền văn minh cổ đại phát triển mạnh mẽ, đặc biệt là ở khu vực Trung Đông và châu Âu.
- Thời kỳ Trung cổ: Sắt tiếp tục đóng vai trò quan trọng trong việc chế tạo áo giáp và vũ khí cho các hiệp sĩ. Sự phát triển của các phương pháp luyện kim đã cải thiện chất lượng sắt, giúp nó trở nên cứng hơn và bền hơn.
- Cách mạng công nghiệp: Với sự phát minh ra lò cao vào thế kỷ 18, sắt đã trở thành nguyên liệu chính cho công nghiệp, đặc biệt là trong sản xuất thép. Điều này đã làm thay đổi hoàn toàn nền kinh tế và xã hội, đưa con người vào kỷ nguyên công nghiệp hóa.
7.3 Sắt Trong Văn Hóa Và Nghệ Thuật
Sắt không chỉ là nguyên liệu kỹ thuật, mà còn là một phần của văn hóa và nghệ thuật. Trong nhiều nền văn hóa, sắt được coi là biểu tượng của sức mạnh và sự bền bỉ.
- Trong nghệ thuật: Sắt đã được sử dụng để tạo ra các tác phẩm điêu khắc, kiến trúc và các đồ trang trí. Ví dụ, các cổng sắt trang trí tinh xảo đã trở thành biểu tượng của sự sang trọng và quyền lực.
- Trong văn hóa dân gian: Sắt được liên kết với các truyền thuyết và câu chuyện dân gian, nơi nó thường được miêu tả như một vật liệu có sức mạnh huyền bí, có thể chống lại ma quỷ và các thế lực siêu nhiên.
Qua các thời kỳ lịch sử, sắt đã chứng minh được tầm quan trọng và ảnh hưởng to lớn của nó đến sự phát triển của nhân loại, không chỉ trong lĩnh vực công nghiệp mà còn trong văn hóa và nghệ thuật.

8. Các Dạng Hợp Chất Của Sắt
Sắt là một kim loại có tính phản ứng cao và có khả năng tạo ra nhiều loại hợp chất khác nhau, được phân loại chủ yếu dựa trên trạng thái oxy hóa của sắt trong các hợp chất đó. Dưới đây là một số hợp chất phổ biến của sắt:
- Hợp chất Sắt(II) (Fe2+)
- Sắt(II) oxit (FeO): Là chất rắn, màu đen, không tan trong nước. FeO được sử dụng trong sản xuất gốm sứ và làm chất màu.
- Sắt(II) hidroxit (Fe(OH)2): Chất rắn, màu trắng xanh, dễ bị oxy hóa thành sắt(III) hidroxit (Fe(OH)3) khi tiếp xúc với không khí.
- Muối Sắt(II): Các muối sắt(II) như FeSO4, FeCl2 tan trong nước và thường được sử dụng trong công nghiệp nhuộm và xử lý nước.
- Hợp chất Sắt(III) (Fe3+)
- Sắt(III) oxit (Fe2O3): Là chất rắn màu đỏ nâu, không tan trong nước. Đây là thành phần chính của rỉ sét và được sử dụng trong sản xuất sơn, chất mài mòn.
- Sắt(III) hidroxit (Fe(OH)3): Là một bazo yếu, màu nâu đỏ, không tan trong nước. Fe(OH)3 có thể bị khử để tạo ra sắt kim loại.
- Muối Sắt(III): FeCl3, Fe(NO3)3, và các muối sắt(III) khác thường được sử dụng trong công nghiệp xử lý nước và làm chất oxy hóa trong các phản ứng hóa học.
- Hợp chất Sắt(IV) và Sắt(VI)
- Kali ferrat (K2FeO4): Là một hợp chất mạnh có tính oxy hóa cao, thường được sử dụng như một chất oxy hóa trong các phản ứng hóa học và trong xử lý nước.
Những hợp chất trên không chỉ thể hiện sự đa dạng về cấu trúc hóa học mà còn về tính chất và ứng dụng trong thực tế. Sự kết hợp của sắt với các nguyên tố khác tạo ra những hợp chất có vai trò quan trọng trong nhiều ngành công nghiệp và trong đời sống hàng ngày.
9. Tác Động Môi Trường Của Sắt
Sắt (Fe), một trong những kim loại phổ biến và được sử dụng rộng rãi nhất trong các ngành công nghiệp, có thể gây ra những tác động không nhỏ đến môi trường khi không được quản lý đúng cách. Tuy nhiên, sắt cũng có vai trò quan trọng trong các quy trình bảo vệ và cải thiện môi trường.
9.1 Sắt Trong Quá Trình Ô Nhiễm Môi Trường
Sắt, khi được sử dụng trong công nghiệp và không được xử lý đúng cách, có thể gây ra ô nhiễm không khí, đất và nước. Một số quá trình công nghiệp như luyện kim, sản xuất thép, và khai thác quặng sắt có thể thải ra khí thải chứa hạt sắt và các hợp chất của sắt, gây hại cho môi trường và sức khỏe con người.
- Ô nhiễm không khí: Quá trình sản xuất thép thường thải ra các hạt bụi sắt, oxit sắt và các chất gây ô nhiễm khác vào không khí.
- Ô nhiễm nước: Chất thải công nghiệp từ các nhà máy luyện kim và khai thác mỏ sắt có thể xâm nhập vào các nguồn nước, gây ra hiện tượng nhiễm bẩn nước ngầm và nước mặt.
- Ô nhiễm đất: Các bãi thải chứa sắt và các kim loại nặng khác có thể dẫn đến sự tích tụ của chúng trong đất, ảnh hưởng đến hệ sinh thái và các loại cây trồng.
9.2 Sắt Trong Quá Trình Xử Lý Nước Thải
Mặt khác, sắt cũng đóng vai trò quan trọng trong các công nghệ xử lý nước thải. Nhờ tính chất hóa học của nó, sắt có khả năng kết tủa và loại bỏ các chất gây ô nhiễm như phốt phát và các kim loại nặng khác từ nước thải.
- Khử phốt phát: Sắt(III) clorua (FeCl3) thường được sử dụng để loại bỏ phốt phát trong nước thải thông qua quá trình kết tủa.
- Xử lý kim loại nặng: Sắt có khả năng kết tủa các kim loại nặng khác, giúp giảm độc tính và cải thiện chất lượng nước.
- Ứng dụng công nghệ tiên tiến: Các công nghệ như sử dụng sắt nano (nZVI) đã được phát triển để xử lý các chất ô nhiễm hữu cơ và kim loại trong nước thải.
9.3 Tác Động Của Sắt Đến Hệ Sinh Thái
Sắt đóng vai trò quan trọng trong hệ sinh thái, đặc biệt là trong các quá trình tự nhiên như quang hợp và tuần hoàn chất dinh dưỡng. Tuy nhiên, sự dư thừa hoặc thiếu hụt sắt có thể dẫn đến những biến động sinh thái đáng kể.
- Vai trò trong quang hợp: Sắt là một nguyên tố vi lượng thiết yếu cho cây cối, tham gia vào quá trình hình thành diệp lục và tổng hợp protein.
- Tác động đến vi sinh vật: Sự hiện diện của sắt trong môi trường nước có thể ảnh hưởng đến quần thể vi sinh vật, thúc đẩy sự phát triển của một số loài vi khuẩn khử sắt.
- Biến động trong môi trường biển: Ở một số vùng biển, sự thiếu hụt sắt có thể hạn chế sự phát triển của sinh vật phù du, ảnh hưởng đến toàn bộ chuỗi thức ăn biển.
Tóm lại, sắt không chỉ là một nguyên tố có tiềm năng gây ô nhiễm môi trường nếu không được quản lý tốt, mà còn là một thành phần quan trọng trong các giải pháp bảo vệ và cải thiện chất lượng môi trường thông qua các công nghệ xử lý tiên tiến.

10. Các Công Nghệ Mới Liên Quan Đến Sắt
Sắt (Fe), với số hiệu nguyên tử 26, là một trong những kim loại quan trọng nhất được sử dụng trong nhiều ngành công nghiệp và công nghệ hiện đại. Các công nghệ mới liên quan đến sắt đã đóng góp đáng kể vào sự phát triển của khoa học vật liệu, sản xuất, và năng lượng. Dưới đây là một số công nghệ tiên tiến liên quan đến sắt:
-
Công nghệ in 3D bằng bột sắt:
Công nghệ in 3D bằng bột sắt cho phép tạo ra các bộ phận phức tạp với độ chính xác cao mà không cần gia công cơ khí truyền thống. Các bộ phận này có thể được sử dụng trong ngành hàng không vũ trụ, ô tô, và y tế. Quy trình bao gồm việc sử dụng laser hoặc chùm electron để làm tan chảy và kết dính các lớp bột sắt, từ đó tạo nên cấu trúc mong muốn.
-
Thép tự phục hồi:
Thép tự phục hồi là một loại vật liệu thông minh mới được phát triển từ sắt và các hợp kim của nó. Vật liệu này có khả năng "tự phục hồi" các vết nứt nhỏ nhờ vào sự di chuyển của nguyên tử trong mạng tinh thể. Điều này giúp kéo dài tuổi thọ của các kết cấu xây dựng, cầu, và các bộ phận của máy móc.
-
Thép không gỉ có độ bền cao:
Thép không gỉ là một hợp kim chứa sắt, crom, và các nguyên tố khác. Với các nghiên cứu gần đây, các nhà khoa học đã phát triển loại thép không gỉ có độ bền cao nhưng vẫn giữ được tính chất chống ăn mòn vượt trội. Điều này rất quan trọng trong các ứng dụng như môi trường biển, sản xuất năng lượng hạt nhân, và công nghiệp hóa dầu.
-
Pin sắt-khí (Iron-Air Batteries):
Pin sắt-khí là một loại pin lưu trữ năng lượng mới, sử dụng phản ứng giữa sắt và oxy để tạo ra điện. Đây là một lựa chọn tiềm năng cho việc lưu trữ năng lượng tái tạo với chi phí thấp và tuổi thọ dài. Công nghệ này có thể giúp cải thiện hiệu quả của các hệ thống năng lượng tái tạo, như năng lượng mặt trời và gió.
-
Thép điện từ (Electrical Steel):
Thép điện từ, chứa chủ yếu là sắt, được sử dụng để tạo ra các lõi của máy biến áp và động cơ điện. Nhờ các tính chất từ tính và điện trở thấp, thép điện từ giúp cải thiện hiệu suất của các thiết bị điện. Các nghiên cứu đang được tiến hành để nâng cao hiệu quả và giảm tổn hao năng lượng của thép điện từ trong ngành năng lượng.
Các công nghệ trên chỉ là một phần nhỏ trong những tiến bộ liên quan đến sắt. Nhờ vào sự kết hợp của nghiên cứu khoa học và ứng dụng thực tiễn, các công nghệ mới liên quan đến sắt đang và sẽ tiếp tục đóng vai trò quan trọng trong sự phát triển của nền kinh tế và xã hội toàn cầu.