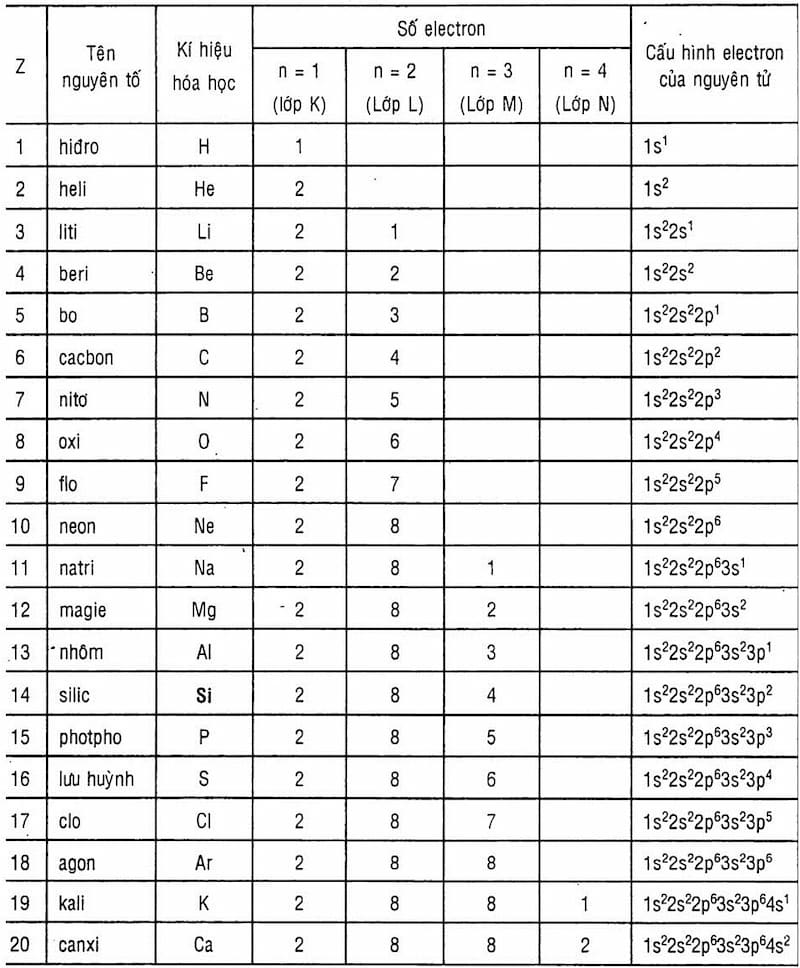
Chủ đề số hiệu nguyên tử: Số hiệu nguyên tử là một khái niệm quan trọng trong hóa học, đóng vai trò quyết định đến tính chất và ứng dụng của các nguyên tố. Bài viết này sẽ cung cấp cho bạn kiến thức tổng quan về số hiệu nguyên tử, từ khái niệm cơ bản đến các ứng dụng thực tiễn trong nghiên cứu và đời sống.
Mục lục
Số Hiệu Nguyên Tử và Cách Xác Định
Số hiệu nguyên tử là một khái niệm cơ bản trong hóa học và vật lý hạt nhân, thể hiện số lượng proton có trong hạt nhân của một nguyên tử. Số hiệu này thường được ký hiệu là \( Z \), và nó cũng đồng thời là số đơn vị điện tích hạt nhân của nguyên tử đó.
Khái Niệm Số Hiệu Nguyên Tử
- Số hiệu nguyên tử là số đơn vị điện tích hạt nhân của một nguyên tố, ký hiệu là \( Z \).
- Mỗi nguyên tố hóa học có một số hiệu nguyên tử riêng biệt, đại diện cho số proton trong hạt nhân của nguyên tử đó.
- Số hiệu nguyên tử cũng đồng thời là số lượng electron trong một nguyên tử trung hòa về điện.
Công Thức Xác Định Số Hiệu Nguyên Tử
Để xác định số hiệu nguyên tử \( Z \), chúng ta sử dụng công thức:
\[
Z = P = E
\]
Trong đó:
- \( Z \) là số hiệu nguyên tử.
- \( P \) là số proton trong hạt nhân.
- \( E \) là số electron trong nguyên tử.
Ứng Dụng Của Số Hiệu Nguyên Tử
Số hiệu nguyên tử có vai trò quan trọng trong việc xác định các tính chất hóa học của nguyên tố:
- Xác định vị trí của nguyên tố trong bảng tuần hoàn.
- Quyết định tính chất hóa học và phản ứng của nguyên tố với các chất khác.
- Định danh các đồng vị của cùng một nguyên tố dựa trên số lượng neutron khác nhau.
Ký Hiệu Nguyên Tử
Trong ký hiệu nguyên tử, số hiệu nguyên tử \( Z \) và số khối \( A \) được đặt ở vị trí đặc trưng như sau:
\[
\begin{array}{c}
^{A}_{Z}\text{X}
\end{array}
\]
Trong đó:
- \( A \) là số khối của nguyên tử, được tính bằng tổng số proton và neutron.
- \( X \) là ký hiệu của nguyên tố.
Ví Dụ Về Số Hiệu Nguyên Tử
Ví dụ, với nguyên tố Natri (Na):
- Số khối \( A \) của Na là 23.
- Số hiệu nguyên tử \( Z \) của Na là 11.
- Như vậy, nguyên tử Na có 11 proton, 12 neutron (vì \( N = A - Z \)), và 11 electron.
Số Hiệu Nguyên Tử và Đồng Vị
Các nguyên tử của cùng một nguyên tố hóa học có thể tồn tại dưới nhiều đồng vị khác nhau. Đồng vị là những nguyên tử có cùng số hiệu nguyên tử nhưng khác nhau về số lượng neutron, do đó số khối \( A \) khác nhau.
Ví dụ, nguyên tố Hidro có ba đồng vị chính:
- \(^1_1H\) - Protium: Không có neutron.
- \(^2_1H\) - Deuterium: Có 1 neutron.
- \(^3_1H\) - Tritium: Có 2 neutron.
Các đồng vị này đều có tính chất hóa học giống nhau vì chúng có cùng số hiệu nguyên tử \( Z \), nhưng khác nhau về tính chất vật lý do khác số khối.

.png)
Tổng Quan Về Số Hiệu Nguyên Tử
Số hiệu nguyên tử là một khái niệm cơ bản và quan trọng trong hóa học, được sử dụng để xác định các nguyên tố trong bảng tuần hoàn. Số hiệu nguyên tử tương ứng với số lượng proton có trong hạt nhân của một nguyên tử. Điều này cũng đồng nghĩa với số lượng electron khi nguyên tử ở trạng thái trung hòa điện.
Số hiệu nguyên tử được ký hiệu bằng chữ \( Z \) và là đặc điểm riêng biệt của mỗi nguyên tố, không có hai nguyên tố nào có cùng số hiệu nguyên tử. Chẳng hạn, hydro có số hiệu nguyên tử là 1, nghĩa là mỗi nguyên tử hydro có 1 proton trong hạt nhân. Tương tự, carbon có số hiệu nguyên tử là 6, với 6 proton trong hạt nhân.
- Ý nghĩa của số hiệu nguyên tử: Số hiệu nguyên tử xác định vị trí của nguyên tố trong bảng tuần hoàn và từ đó quyết định các tính chất hóa học của nó.
- Liên quan đến số khối: Số hiệu nguyên tử khác với số khối (\( A \)), là tổng số proton và neutron trong hạt nhân của một nguyên tử. Trong khi đó, số hiệu nguyên tử chỉ đơn thuần là số proton.
Số hiệu nguyên tử cũng đóng vai trò quan trọng trong việc xác định các đồng vị của một nguyên tố. Các đồng vị có cùng số hiệu nguyên tử nhưng khác nhau về số neutron, do đó có số khối khác nhau. Ví dụ, đồng vị phổ biến của carbon là \( ^{12}C \) và \( ^{14}C \), cả hai đều có số hiệu nguyên tử là 6 nhưng khác nhau về số neutron.
| Nguyên tố | Số hiệu nguyên tử (\( Z \)) | Số khối (\( A \)) |
| Hydro (H) | 1 | 1 |
| Carbon (C) | 6 | 12 |
| Oxy (O) | 8 | 16 |
Như vậy, số hiệu nguyên tử không chỉ là một con số mà nó còn mang ý nghĩa sâu sắc, quyết định nhiều đặc điểm và tính chất của nguyên tố trong khoa học hóa học.
Vị Trí Của Số Hiệu Nguyên Tử Trong Bảng Tuần Hoàn
Số hiệu nguyên tử là yếu tố then chốt quyết định vị trí của một nguyên tố trong bảng tuần hoàn. Bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo thứ tự tăng dần của số hiệu nguyên tử, bắt đầu từ 1 với nguyên tố hydrogen cho đến các nguyên tố có số hiệu lớn hơn.
Cụ thể, mỗi nguyên tố trong bảng tuần hoàn được sắp xếp vào các ô riêng biệt, và số hiệu nguyên tử của chúng tăng dần từ trái sang phải trong mỗi chu kỳ (\(period\)) và từ trên xuống dưới trong mỗi nhóm (\(group\)). Số hiệu nguyên tử không chỉ quyết định vị trí mà còn liên quan mật thiết đến tính chất hóa học của nguyên tố.
- Chu kỳ: Các nguyên tố nằm trên cùng một chu kỳ có cùng số lớp electron nhưng số hiệu nguyên tử tăng dần từ trái sang phải, điều này dẫn đến sự thay đổi dần các tính chất hóa học của chúng.
- Nhóm: Các nguyên tố thuộc cùng một nhóm có số electron ở lớp ngoài cùng tương tự nhau, dẫn đến tính chất hóa học tương đồng. Số hiệu nguyên tử của các nguyên tố trong cùng một nhóm tăng dần từ trên xuống dưới.
Ví dụ, nhóm 1A của bảng tuần hoàn bao gồm các nguyên tố như lithium (\(Z = 3\)), natri (\(Z = 11\)), và kali (\(Z = 19\)). Tất cả các nguyên tố này đều có 1 electron ở lớp ngoài cùng, nhưng số hiệu nguyên tử tăng dần, dẫn đến sự thay đổi về tính chất vật lý và hóa học.
| Nguyên tố | Chu kỳ | Nhóm | Số hiệu nguyên tử (\(Z\)) |
| Hydro (H) | 1 | 1 | 1 |
| Carbon (C) | 2 | 14 | 6 |
| Oxy (O) | 2 | 16 | 8 |
Như vậy, số hiệu nguyên tử không chỉ xác định vị trí của nguyên tố trong bảng tuần hoàn mà còn là cơ sở để dự đoán và giải thích các tính chất hóa học của chúng.

Số Hiệu Nguyên Tử và Các Tính Chất Của Nguyên Tố
Số hiệu nguyên tử là chỉ số quan trọng trong việc xác định tính chất hóa học của một nguyên tố. Mỗi nguyên tố có một số hiệu nguyên tử duy nhất, tượng trưng cho số proton có trong hạt nhân của nguyên tử đó. Điều này không chỉ giúp phân loại nguyên tố mà còn quyết định nhiều tính chất vật lý và hóa học của chúng.
Một số tính chất của nguyên tố bị ảnh hưởng trực tiếp bởi số hiệu nguyên tử bao gồm:
- Tính kim loại và phi kim: Các nguyên tố với số hiệu nguyên tử nhỏ thường là phi kim, trong khi những nguyên tố có số hiệu nguyên tử lớn hơn thường có xu hướng là kim loại.
- Độ âm điện: Độ âm điện của nguyên tố thường tăng theo chiều từ trái sang phải trong cùng một chu kỳ và giảm dần từ trên xuống dưới trong cùng một nhóm. Điều này liên quan mật thiết đến số hiệu nguyên tử.
- Năng lượng ion hóa: Năng lượng cần thiết để loại bỏ một electron khỏi nguyên tử cũng bị ảnh hưởng bởi số hiệu nguyên tử. Nguyên tố có số hiệu nguyên tử càng lớn thì năng lượng ion hóa càng cao.
- Bán kính nguyên tử: Bán kính nguyên tử có xu hướng giảm dần khi số hiệu nguyên tử tăng lên trong cùng một chu kỳ và tăng dần trong cùng một nhóm.
Bảng dưới đây mô tả một số nguyên tố và tính chất tương ứng của chúng dựa trên số hiệu nguyên tử:
| Nguyên tố | Số hiệu nguyên tử | Độ âm điện | Năng lượng ion hóa (kJ/mol) | Bán kính nguyên tử (pm) |
| Hydro (H) | 1 | 2.20 | 1312 | 53 |
| Heli (He) | 2 | N/A | 2372 | 31 |
| Lithium (Li) | 3 | 0.98 | 520 | 167 |
Như vậy, số hiệu nguyên tử không chỉ là một con số đặc trưng của nguyên tố mà còn là yếu tố then chốt giúp chúng ta hiểu rõ hơn về tính chất hóa học và vật lý của chúng.

Số Hiệu Nguyên Tử và Các Đồng Vị
Số hiệu nguyên tử, ký hiệu là \( Z \), đại diện cho số lượng proton có trong hạt nhân của một nguyên tử và là chỉ số xác định danh tính của một nguyên tố. Tuy nhiên, số neutron trong hạt nhân có thể khác nhau, tạo ra các dạng khác nhau của cùng một nguyên tố, được gọi là các đồng vị.
Các đồng vị của một nguyên tố có cùng số hiệu nguyên tử nhưng khác nhau về số khối \( A \) (là tổng số proton và neutron). Điều này dẫn đến sự khác biệt trong khối lượng nguyên tử, nhưng các đồng vị vẫn giữ nguyên các tính chất hóa học vì chúng có cùng cấu hình electron.
Dưới đây là các bước để hiểu rõ hơn về mối quan hệ giữa số hiệu nguyên tử và các đồng vị:
- Xác định số hiệu nguyên tử: Bắt đầu bằng việc xác định số proton trong hạt nhân, điều này cho phép bạn biết được nguyên tố nào đang được xem xét.
- Xác định số neutron: Tính số neutron bằng cách lấy số khối \( A \) trừ đi số hiệu nguyên tử \( Z \).
- Xác định đồng vị: Các nguyên tử có cùng số proton nhưng số neutron khác nhau là các đồng vị của cùng một nguyên tố.
Bảng dưới đây liệt kê một số đồng vị của các nguyên tố phổ biến:
| Nguyên tố | Số hiệu nguyên tử \( Z \) | Số khối \( A \) | Tên đồng vị |
| Carbon (C) | 6 | 12 | Carbon-12 |
| Carbon (C) | 6 | 14 | Carbon-14 |
| Uranium (U) | 92 | 235 | Uranium-235 |
| Uranium (U) | 92 | 238 | Uranium-238 |
Các đồng vị có thể là bền hoặc không bền. Đồng vị không bền có thể phân rã phóng xạ, phát ra bức xạ và chuyển thành các nguyên tố khác. Điều này rất quan trọng trong các ứng dụng như xác định tuổi bằng phương pháp carbon, y học hạt nhân, và năng lượng hạt nhân.

Công Thức Tính Số Hiệu Nguyên Tử
Số hiệu nguyên tử, ký hiệu là \( Z \), là một đại lượng quan trọng trong hóa học và vật lý hạt nhân, xác định số lượng proton có trong hạt nhân của nguyên tử. Đây là một đặc trưng cơ bản để phân biệt các nguyên tố hóa học với nhau.
Để tính số hiệu nguyên tử, chúng ta sử dụng công thức cơ bản:
\[
Z = \text{Số lượng proton trong hạt nhân}
\]
Trong trường hợp các bài toán liên quan đến đồng vị, công thức tính số hiệu nguyên tử vẫn giữ nguyên. Tuy nhiên, số khối \( A \) được xác định theo công thức:
\[
A = Z + N
\]
Trong đó:
- \( A \): Số khối của nguyên tử (tổng số proton và neutron).
- \( Z \): Số hiệu nguyên tử (số proton).
- \( N \): Số neutron.
Do đó, từ công thức trên, chúng ta có thể suy ra số neutron bằng công thức:
\[
N = A - Z
\]
Ví dụ: Xét nguyên tố Carbon có số khối là 14 và số hiệu nguyên tử là 6, ta tính được số neutron như sau:
\[
N = 14 - 6 = 8
\]
Việc hiểu và áp dụng đúng các công thức này giúp chúng ta nắm vững mối quan hệ giữa số hiệu nguyên tử, số proton, số neutron và số khối, từ đó có thể phân biệt và hiểu sâu hơn về các nguyên tố và đồng vị trong hóa học.
XEM THÊM:
Tầm Quan Trọng Của Số Hiệu Nguyên Tử Trong Giáo Dục
Số hiệu nguyên tử, ký hiệu là \( Z \), là một trong những khái niệm cơ bản và quan trọng nhất trong hóa học và vật lý. Nó đại diện cho số lượng proton có trong hạt nhân của một nguyên tử và xác định vị trí của nguyên tố trong bảng tuần hoàn. Việc hiểu rõ số hiệu nguyên tử không chỉ giúp học sinh nắm vững cấu trúc nguyên tử mà còn làm nền tảng cho việc nghiên cứu và giảng dạy nhiều môn học khoa học khác.
1. Nền Tảng Cho Kiến Thức Hóa Học
Số hiệu nguyên tử \( Z \) giúp học sinh nhận biết cấu hình electron của các nguyên tố, từ đó dự đoán tính chất hóa học và vị trí của chúng trong bảng tuần hoàn. Đây là bước đầu tiên để hiểu về phản ứng hóa học, liên kết hóa học và sự biến đổi của các nguyên tố trong tự nhiên.
- Cấu hình electron: Cấu hình electron của một nguyên tố được xác định trực tiếp bởi số hiệu nguyên tử. Ví dụ, cấu hình electron của carbon với \( Z = 6 \) là \( 1s^2 2s^2 2p^2 \), giúp xác định đặc điểm hóa học của nguyên tố này.
- Phản ứng hóa học: Kiến thức về số hiệu nguyên tử và cấu hình electron giúp học sinh hiểu rõ hơn về cách thức các nguyên tố tương tác với nhau trong các phản ứng hóa học, từ đó nâng cao khả năng dự đoán kết quả của các phản ứng.
2. Ứng Dụng Trong Vật Lý và Sinh Học
Trong vật lý, số hiệu nguyên tử là cơ sở để hiểu về phản ứng hạt nhân, sự phân rã phóng xạ và năng lượng hạt nhân. Trong sinh học, số hiệu nguyên tử giúp giải thích cấu trúc và chức năng của các nguyên tố trong tế bào và các quá trình sinh học.
- Phản ứng hạt nhân: Các nguyên tố với số hiệu nguyên tử cao như uranium (\( Z = 92 \)) được sử dụng trong lò phản ứng hạt nhân để sản xuất năng lượng.
- Quang phổ học: Số hiệu nguyên tử cũng đóng vai trò quan trọng trong việc xác định các nguyên tố thông qua các kỹ thuật quang phổ, giúp phát hiện và phân tích các chất hóa học trong nghiên cứu sinh học.
3. Vai Trò Quan Trọng Trong Giáo Dục
Hiểu biết về số hiệu nguyên tử là điều kiện cần thiết để học sinh phát triển tư duy logic và khả năng giải quyết vấn đề trong nhiều lĩnh vực khoa học. Điều này giúp học sinh không chỉ nắm vững kiến thức cơ bản mà còn phát triển kỹ năng nghiên cứu, khám phá và ứng dụng kiến thức vào thực tiễn.
- Giáo dục phổ thông: Việc giảng dạy số hiệu nguyên tử trong các chương trình học giúp học sinh xây dựng nền tảng vững chắc trong các môn học tự nhiên.
- Nghiên cứu khoa học: Số hiệu nguyên tử là cơ sở để nghiên cứu và phát triển các công nghệ mới, từ y học, vật liệu cho đến năng lượng sạch.
Tóm lại, số hiệu nguyên tử không chỉ là một khái niệm khoa học cơ bản mà còn là nền tảng cho nhiều ứng dụng thực tiễn trong giáo dục và nghiên cứu. Việc nắm vững số hiệu nguyên tử sẽ giúp học sinh hiểu rõ hơn về thế giới tự nhiên và phát triển các kỹ năng khoa học cần thiết cho tương lai.