Chủ đề công thức tính khối lượng nguyên tử: Khối lượng nguyên tử là một trong những kiến thức cơ bản trong hóa học và vật lý, đóng vai trò quan trọng trong việc hiểu rõ các phản ứng hóa học và cấu tạo của các nguyên tố. Bài viết này sẽ giúp bạn nắm vững công thức tính khối lượng nguyên tử, từ cách tính cơ bản đến các ví dụ minh họa chi tiết, giúp bạn ứng dụng một cách hiệu quả trong học tập và nghiên cứu.
Mục lục
- Công Thức Tính Khối Lượng Nguyên Tử
- 1. Khối lượng nguyên tử là gì?
- 2. Công thức tính khối lượng nguyên tử
- 3. Cách tính khối lượng nguyên tử của các nguyên tố phổ biến
- 4. Nguyên tử khối và ứng dụng thực tiễn
- 5. Các yếu tố ảnh hưởng đến khối lượng nguyên tử
- 6. So sánh khối lượng nguyên tử giữa các nguyên tố
- 7. Các sai lầm thường gặp khi tính khối lượng nguyên tử
- 8. Cách xác định khối lượng nguyên tử bằng máy tính
- 9. Khối lượng nguyên tử trong nghiên cứu và công nghiệp
Công Thức Tính Khối Lượng Nguyên Tử
Khối lượng nguyên tử trung bình là một chỉ số quan trọng trong hóa học, giúp xác định khối lượng trung bình của các nguyên tử trong một mẫu chất. Công thức tính khối lượng nguyên tử giúp chúng ta hiểu rõ hơn về các chất hóa học và ứng dụng của chúng trong đời sống.
1. Khái Niệm Khối Lượng Nguyên Tử Trung Bình
Khối lượng nguyên tử trung bình là khối lượng trung bình của tất cả các đồng vị của một nguyên tố, có tính đến tỷ lệ xuất hiện tự nhiên của từng đồng vị. Công thức tính khối lượng nguyên tử trung bình như sau:
2. Cách Tính Khối Lượng Nguyên Tử Trung Bình
- Bước 1: Xác định khối lượng của mỗi đồng vị của nguyên tố.
- Bước 2: Tìm tỷ lệ phần trăm tự nhiên của từng đồng vị.
- Bước 3: Nhân khối lượng đồng vị với tỷ lệ phần trăm của nó.
- Bước 4: Cộng tổng các giá trị đã tính để ra khối lượng trung bình.
3. Ví Dụ Tính Khối Lượng Nguyên Tử Trung Bình
Giả sử ta có hai đồng vị của nguyên tố X: Đồng vị A có khối lượng 10 u, tỷ lệ 60%, và đồng vị B có khối lượng 12 u, tỷ lệ 40%. Áp dụng công thức:
4. Ứng Dụng Của Khối Lượng Nguyên Tử Trung Bình
- Giúp tính toán trong phản ứng hóa học, xác định tỷ lệ và khối lượng chất phản ứng.
- Sử dụng trong các ngành khoa học vật liệu để thiết kế và chế tạo các vật liệu mới.
- Áp dụng trong nghiên cứu sinh học để xác định cấu trúc và tính chất của các hợp chất hữu cơ.
5. Lợi Ích Khi Hiểu Biết Về Khối Lượng Nguyên Tử
Việc nắm vững kiến thức về khối lượng nguyên tử giúp học sinh và các nhà khoa học phân tích, tính toán chính xác hơn trong các thí nghiệm và nghiên cứu, từ đó cải thiện hiệu quả học tập và công việc.

.png)
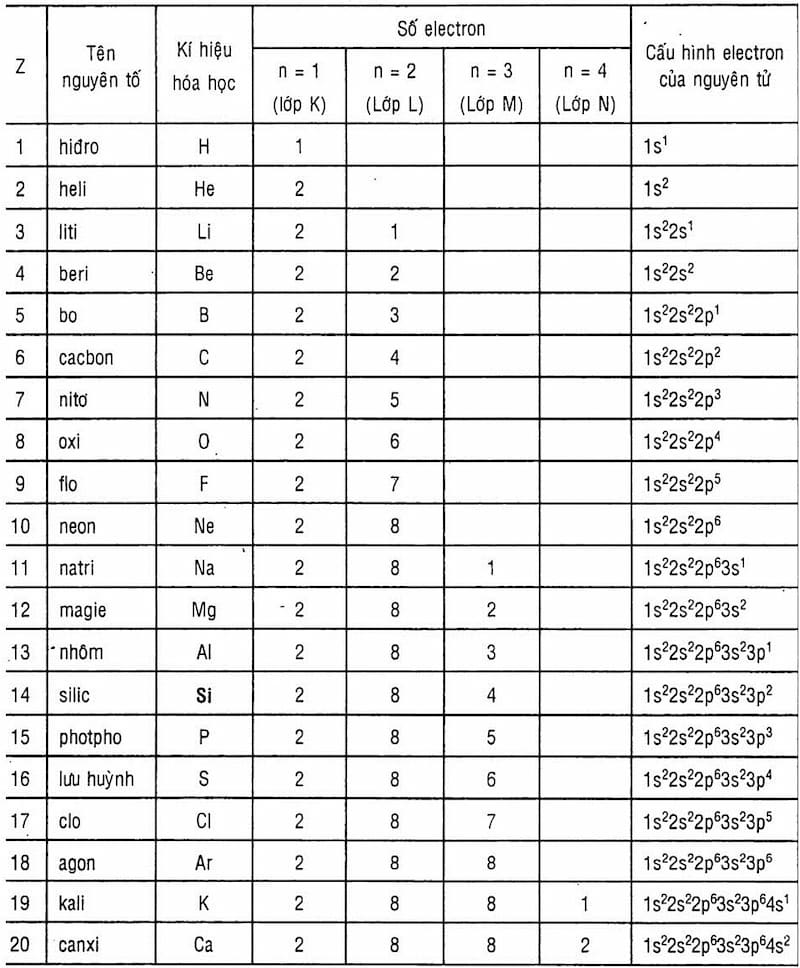
1. Khối lượng nguyên tử là gì?
Khối lượng nguyên tử là một đại lượng đo lường khối lượng của một nguyên tử, bao gồm tổng khối lượng của các proton, neutron và electron bên trong nó. Tuy nhiên, vì khối lượng của electron rất nhỏ so với proton và neutron, nên khối lượng nguyên tử chủ yếu được quyết định bởi số lượng proton và neutron.
Đơn vị đo khối lượng nguyên tử thường được sử dụng là đơn vị khối lượng nguyên tử (atomic mass unit - amu) hoặc đơn vị cacbon (đvC), tương đương với một phần mười hai của khối lượng của nguyên tử cacbon-12 (\(^{12}\text{C}\)).
Ví dụ cụ thể:
Nguyên tử Carbon (\(^{12}\text{C}\)) có 6 proton và 6 neutron:
- Khối lượng của mỗi proton và neutron là khoảng \(1.6726 \times 10^{-27}\) kg.
- Tổng khối lượng của 6 proton: \(6 \times 1.6726 \times 10^{-27} = 10.0356 \times 10^{-27}\) kg.
- Tổng khối lượng của 6 neutron: \(6 \times 1.6749 \times 10^{-27} = 10.0494 \times 10^{-27}\) kg.
- Khối lượng của electron là không đáng kể so với proton và neutron, do đó có thể bỏ qua.
Tổng khối lượng của nguyên tử Carbon: \[ m_C = 10.0356 \times 10^{-27} \text{ kg} + 10.0494 \times 10^{-27} \text{ kg} \approx 20.085 \times 10^{-27} \text{ kg} \]
Khối lượng nguyên tử trung bình
Đối với các nguyên tố có nhiều đồng vị, khối lượng nguyên tử trung bình được tính theo công thức:
Trong đó:
- \(M_{\text{trung bình}}\): Khối lượng nguyên tử trung bình.
- \(m_i\): Khối lượng của đồng vị thứ \(i\).
- \(p_i\): Phần trăm số nguyên tử của đồng vị thứ \(i\).
Ứng dụng của khối lượng nguyên tử
Khối lượng nguyên tử đóng vai trò quan trọng trong việc tính toán khối lượng mol, giúp xác định khối lượng của các chất trong các phản ứng hóa học, và nghiên cứu cấu trúc của nguyên tử trong các lĩnh vực khoa học khác.
2. Công thức tính khối lượng nguyên tử
Khối lượng nguyên tử là một trong những đại lượng quan trọng giúp xác định tính chất vật lý và hóa học của các nguyên tố. Để tính khối lượng nguyên tử của một nguyên tố, chúng ta cần xem xét đến số lượng proton, neutron, và electron trong nguyên tử đó. Dưới đây là công thức tính khối lượng nguyên tử và các bước chi tiết:
- Bước 1: Xác định số lượng proton (\( p \)) và neutron (\( n \)) từ bảng tuần hoàn hoặc thông tin về đồng vị của nguyên tố.
- Bước 2: Tính khối lượng của proton (\( m_p \)) và neutron (\( m_n \)). Khối lượng của mỗi proton và neutron xấp xỉ bằng 1 đơn vị khối lượng nguyên tử (u).
- Bước 3: Sử dụng công thức để tính khối lượng nguyên tử:
Trong đó:
- \( m_a \): Khối lượng nguyên tử
- \( m_p \): Khối lượng proton (\( \approx 1.6726 \times 10^{-27} \) kg)
- \( m_n \): Khối lượng neutron (\( \approx 1.6749 \times 10^{-27} \) kg)
- \( m_e \): Khối lượng electron (\( \approx 9.1094 \times 10^{-31} \) kg)
Ví dụ: Tính khối lượng nguyên tử của Carbon (C)
- Carbon có 6 proton và 6 neutron.
- Khối lượng proton: \( 6 \cdot 1.6726 \times 10^{-27} \text{ kg} = 10.0356 \times 10^{-27} \text{ kg} \)
- Khối lượng neutron: \( 6 \cdot 1.6749 \times 10^{-27} \text{ kg} = 10.0494 \times 10^{-27} \text{ kg} \)
- Khối lượng của electron rất nhỏ, có thể bỏ qua.
- Tổng khối lượng của Carbon: \( m_C \approx 20.085 \times 10^{-27} \text{ kg} \).
Công thức này giúp xác định khối lượng nguyên tử của từng nguyên tố cụ thể dựa trên thành phần hạt nhân, là công cụ quan trọng trong nghiên cứu và ứng dụng hóa học.

3. Cách tính khối lượng nguyên tử của các nguyên tố phổ biến
3.1 Ví dụ tính khối lượng nguyên tử của Hydro
Hydro là nguyên tố đơn giản nhất, có một proton và không có neutron trong đồng vị phổ biến nhất, Protium. Tuy nhiên, khối lượng nguyên tử của Hydro không chỉ là tổng khối lượng của proton mà còn cần tính đến khối lượng của electron và hiệu ứng liên kết hạt nhân.
Công thức tính khối lượng nguyên tử của Hydro:
\[
\text{Khối lượng nguyên tử của Hydro} = Z \times m_p + N \times m_n - \Delta E/c^2 + Z \times m_e
\]
Với:
- \(Z = 1\): Số proton
- \(N = 0\): Số neutron
- \(m_p ≈ 1.007276 \, \text{amu}\): Khối lượng của 1 proton
- \(m_n ≈ 1.008665 \, \text{amu}\): Khối lượng của 1 neutron
- \(\Delta E\): Năng lượng liên kết hạt nhân
- \(c = 3 \times 10^8 \, \text{m/s}\): Tốc độ ánh sáng
- \(m_e ≈ 5.4858 \times 10^{-4} \, \text{amu}\): Khối lượng của 1 electron
Vậy:
\[
\text{Khối lượng nguyên tử của Hydro} ≈ 1 \times 1.007276 + 0 \times 1.008665 - \Delta E/c^2 + 1 \times 5.4858 \times 10^{-4}
\]
\[
\text{Khối lượng nguyên tử của Hydro} ≈ 1.007825 \, \text{amu}
\]
3.2 Ví dụ tính khối lượng nguyên tử của Carbon
Carbon có hai đồng vị chính là Carbon-12 và Carbon-13. Đối với Carbon-12, khối lượng nguyên tử được tính bằng cách cộng khối lượng của 6 proton, 6 neutron và 6 electron, đồng thời trừ đi năng lượng liên kết hạt nhân.
Công thức tính khối lượng nguyên tử Carbon:
\[
\text{Khối lượng nguyên tử của Carbon-12} = Z \times m_p + N \times m_n - \Delta E/c^2 + Z \times m_e
\]
Với:
- \(Z = 6\): Số proton
- \(N = 6\): Số neutron
- \(m_p ≈ 1.007276 \, \text{amu}\)
- \(m_n ≈ 1.008665 \, \text{amu}\)
- \(\Delta E\): Năng lượng liên kết hạt nhân
- \(m_e ≈ 5.4858 \times 10^{-4} \, \text{amu}\)
Vậy:
\[
\text{Khối lượng nguyên tử của Carbon-12} ≈ 6 \times 1.007276 + 6 \times 1.008665 - \Delta E/c^2 + 6 \times 5.4858 \times 10^{-4}
\]
\[
\text{Khối lượng nguyên tử của Carbon-12} ≈ 12.000 \, \text{amu}
\]
3.3 Ví dụ tính khối lượng nguyên tử của Oxygen
Oxygen-16 là đồng vị phổ biến nhất với 8 proton và 8 neutron. Để tính khối lượng nguyên tử, chúng ta sử dụng công thức bao gồm khối lượng proton, neutron, electron và năng lượng liên kết.
Công thức tính khối lượng nguyên tử Oxygen:
\[
\text{Khối lượng nguyên tử của Oxygen-16} = Z \times m_p + N \times m_n - \Delta E/c^2 + Z \times m_e
\]
Với:
- \(Z = 8\): Số proton
- \(N = 8\): Số neutron
- \(m_p ≈ 1.007276 \, \text{amu}\)
- \(m_n ≈ 1.008665 \, \text{amu}\)
- \(\Delta E\): Năng lượng liên kết hạt nhân
- \(m_e ≈ 5.4858 \times 10^{-4} \, \text{amu}\)
Vậy:
\[
\text{Khối lượng nguyên tử của Oxygen-16} ≈ 8 \times 1.007276 + 8 \times 1.008665 - \Delta E/c^2 + 8 \times 5.4858 \times 10^{-4}
\]
\[
\text{Khối lượng nguyên tử của Oxygen-16} ≈ 15.99491 \, \text{amu}
\]

4. Nguyên tử khối và ứng dụng thực tiễn
Nguyên tử khối là một khái niệm quan trọng trong hóa học, đóng vai trò nền tảng trong việc hiểu rõ các tính chất của nguyên tố và phân tử. Nó là đại lượng biểu thị khối lượng trung bình của các nguyên tử của một nguyên tố, tính đến sự tồn tại của các đồng vị khác nhau với tỉ lệ phần trăm tương ứng. Nguyên tử khối được đo bằng đơn vị khối lượng nguyên tử (amu), với 1 amu được định nghĩa bằng 1/12 khối lượng của nguyên tử carbon-12.
4.1 Ý nghĩa của nguyên tử khối
Nguyên tử khối giúp các nhà khoa học so sánh khối lượng của các nguyên tố khác nhau một cách dễ dàng, từ đó hiểu rõ hơn về cấu trúc và tính chất của chúng. Khối lượng nguyên tử là thông số quan trọng trong việc xác định công thức phân tử, tính toán lượng chất tham gia phản ứng hóa học và xác định tỉ lệ các nguyên tố trong hợp chất.
4.2 Ứng dụng của nguyên tử khối trong hóa học
- Tính toán hóa học: Nguyên tử khối là cơ sở để tính toán khối lượng mol, một đại lượng thiết yếu trong hóa học, giúp xác định lượng chất tham gia hoặc tạo ra trong phản ứng hóa học.
- Xác định công thức phân tử: Dựa vào nguyên tử khối, ta có thể xác định được công thức phân tử của các chất bằng cách so sánh khối lượng phân tử thực nghiệm với khối lượng phân tử lý thuyết.
- Dự đoán tính chất hóa học: Nguyên tử khối còn được sử dụng để dự đoán tính chất hóa học của các nguyên tố, như độ âm điện, khả năng tạo liên kết, và trạng thái vật lý ở các điều kiện khác nhau.
Việc hiểu rõ và vận dụng đúng đắn nguyên tử khối không chỉ giúp trong nghiên cứu hóa học mà còn hỗ trợ trong các lĩnh vực như vật lý, sinh học, và công nghiệp sản xuất, nơi việc tính toán chính xác khối lượng là vô cùng cần thiết.

5. Các yếu tố ảnh hưởng đến khối lượng nguyên tử
Khối lượng nguyên tử của một nguyên tố không phải là một giá trị cố định mà có thể bị ảnh hưởng bởi nhiều yếu tố khác nhau. Dưới đây là các yếu tố chính:
5.1 Ảnh hưởng của số lượng neutron
Khối lượng nguyên tử chủ yếu được xác định bởi tổng số proton và neutron trong hạt nhân. Vì proton có khối lượng tương đương với neutron, sự thay đổi số lượng neutron trong hạt nhân sẽ dẫn đến sự thay đổi trong khối lượng nguyên tử. Ví dụ, các đồng vị của cùng một nguyên tố có số proton như nhau nhưng số neutron khác nhau, dẫn đến sự khác biệt về khối lượng nguyên tử.
5.2 Ảnh hưởng của đồng vị
Các nguyên tố thường tồn tại dưới dạng nhiều đồng vị khác nhau, tức là các dạng khác nhau của nguyên tố có cùng số proton nhưng khác số neutron. Khối lượng nguyên tử trung bình của nguyên tố được tính dựa trên tỉ lệ phần trăm tự nhiên của các đồng vị này. Vì vậy, sự khác nhau về tỉ lệ phần trăm của các đồng vị có thể ảnh hưởng đến khối lượng nguyên tử trung bình.
5.3 Ảnh hưởng của cấu trúc hạt nhân
Cấu trúc hạt nhân, bao gồm cách sắp xếp và tương tác giữa các proton và neutron, cũng có thể ảnh hưởng đến khối lượng nguyên tử. Mặc dù tác động này thường rất nhỏ và không đáng kể trong các tính toán hàng ngày, nhưng trong các nghiên cứu chính xác, sự khác biệt năng lượng giữa các mức năng lượng hạt nhân có thể dẫn đến sự thay đổi nhỏ trong khối lượng nguyên tử.
5.4 Các yếu tố môi trường và điều kiện bên ngoài
Trong một số trường hợp, các yếu tố môi trường như nhiệt độ, áp suất, và các điều kiện vật lý khác cũng có thể tác động lên khối lượng nguyên tử, đặc biệt là khi nguyên tử tham gia vào các phản ứng hóa học hoặc hạt nhân. Tuy nhiên, những ảnh hưởng này thường rất nhỏ và chỉ quan trọng trong các điều kiện cực kỳ khắc nghiệt hoặc trong các phản ứng đặc biệt.
XEM THÊM:
6. So sánh khối lượng nguyên tử giữa các nguyên tố
Khối lượng nguyên tử của các nguyên tố khác nhau không giống nhau và có sự biến đổi rõ rệt trong bảng tuần hoàn các nguyên tố hóa học. Việc so sánh khối lượng nguyên tử giữa các nguyên tố là một bước quan trọng giúp chúng ta hiểu rõ hơn về tính chất hóa học và vật lý của từng nguyên tố.
6.1 So sánh khối lượng nguyên tử giữa các kim loại và phi kim
Kim loại và phi kim có sự khác biệt đáng kể về khối lượng nguyên tử. Thông thường, khối lượng nguyên tử của các kim loại nặng hơn so với phi kim. Điều này là do trong cấu trúc nguyên tử, kim loại thường có số lượng proton và neutron nhiều hơn, dẫn đến khối lượng nguyên tử lớn hơn.
- Ví dụ, khối lượng nguyên tử của vàng (Au) là 196,97 u, trong khi đó khối lượng nguyên tử của carbon (C) chỉ là 12,01 u.
- Khối lượng nguyên tử của các kim loại kiềm (như lithium (Li), natri (Na)) thấp hơn so với kim loại chuyển tiếp (như sắt (Fe), đồng (Cu)).
- Ngược lại, phi kim như khí hiếm hoặc halogen thường có khối lượng nguyên tử nhỏ hơn, chẳng hạn như heli (He) chỉ có khối lượng nguyên tử là 4,00 u.
6.2 Biến đổi khối lượng nguyên tử trong bảng tuần hoàn
Trong bảng tuần hoàn, khối lượng nguyên tử của các nguyên tố biến đổi theo một quy luật nhất định khi đi từ trái sang phải và từ trên xuống dưới:
- Khi di chuyển từ trái sang phải trong cùng một chu kỳ, khối lượng nguyên tử của các nguyên tố thường tăng dần. Ví dụ, trong chu kỳ thứ hai, khối lượng nguyên tử của lithium (Li) là 6,94 u, trong khi khối lượng nguyên tử của neon (Ne) là 20,18 u.
- Khi di chuyển từ trên xuống dưới trong cùng một nhóm, khối lượng nguyên tử của các nguyên tố cũng tăng dần do số lượng proton và neutron trong hạt nhân tăng lên. Ví dụ, trong nhóm các halogen, khối lượng nguyên tử của fluorine (F) là 18,998 u, trong khi đó khối lượng nguyên tử của iodine (I) là 126,904 u.
Việc so sánh khối lượng nguyên tử giữa các nguyên tố giúp chúng ta hiểu rõ hơn về quy luật biến đổi của các nguyên tố trong bảng tuần hoàn, cũng như ảnh hưởng của khối lượng nguyên tử đối với tính chất hóa học và vật lý của từng nguyên tố.

7. Các sai lầm thường gặp khi tính khối lượng nguyên tử
Khi tính toán khối lượng nguyên tử, có một số sai lầm phổ biến mà người học thường mắc phải. Những sai lầm này không chỉ dẫn đến kết quả sai lệch mà còn gây khó khăn trong việc hiểu đúng bản chất của các nguyên tố. Dưới đây là những sai lầm thường gặp cùng với cách khắc phục chúng:
- Sai lầm 1: Bỏ qua khối lượng electron trong tính toán
Một sai lầm phổ biến là người học thường bỏ qua khối lượng của electron khi tính khối lượng nguyên tử, cho rằng khối lượng của nó quá nhỏ để ảnh hưởng. Tuy nhiên, mặc dù khối lượng của electron rất nhỏ, việc bỏ qua hoàn toàn có thể dẫn đến sai số nhỏ nhưng không đáng kể trong các trường hợp yêu cầu độ chính xác cao.
- Sai lầm 2: Nhầm lẫn giữa khối lượng nguyên tử và nguyên tử khối
Nhiều học sinh nhầm lẫn giữa khối lượng nguyên tử (tính bằng gam) và nguyên tử khối (đơn vị u hoặc amu). Nguyên tử khối là số không có đơn vị, trong khi khối lượng nguyên tử phải được tính bằng gam. Việc nhầm lẫn này có thể dẫn đến sai lầm nghiêm trọng trong các phép tính.
- Sai lầm 3: Không tính đến sự khác biệt giữa các đồng vị
Khi tính khối lượng nguyên tử trung bình của một nguyên tố, cần tính đến sự tồn tại của các đồng vị khác nhau với khối lượng khác nhau. Việc chỉ sử dụng một giá trị khối lượng duy nhất mà không xem xét đến các đồng vị có thể dẫn đến kết quả không chính xác.
- Sai lầm 4: Nhầm lẫn trong việc quy đổi đơn vị
Khi thực hiện các phép tính liên quan đến khối lượng nguyên tử, việc quy đổi đơn vị từ u (amu) sang gam và ngược lại là cần thiết. Nếu không cẩn thận trong quá trình quy đổi, kết quả có thể sai lệch đáng kể.
- Sai lầm 5: Bỏ qua tầm quan trọng của số Avogadro
Để tính khối lượng nguyên tử một cách chính xác, cần sử dụng số Avogadro (\(6,022 \times 10^{23}\)) để chuyển đổi giữa đơn vị hạt và gam. Nếu bỏ qua hoặc sử dụng sai số Avogadro, kết quả cuối cùng sẽ không chính xác.
- Sai lầm 6: Sử dụng không chính xác các công thức
Có rất nhiều công thức liên quan đến việc tính toán khối lượng nguyên tử, ví dụ như:
- Công thức tính khối lượng nguyên tử trung bình: \[ m = \frac{\sum (m_i \times x_i)}{100} \] Trong đó \(m_i\) là khối lượng của đồng vị thứ \(i\), và \(x_i\) là phần trăm của đồng vị đó.
- Công thức chuyển đổi đơn vị: \[ 1 \text{ u} = 1,6605 \times 10^{-27} \text{ kg} \]
Nếu sử dụng không đúng hoặc áp dụng sai các công thức này, sẽ dẫn đến kết quả không chính xác.
- Sai lầm 7: Quên cộng thêm khối lượng của các neutron
Khi tính khối lượng nguyên tử, nếu chỉ cộng khối lượng của proton mà quên tính khối lượng của neutron sẽ gây ra sai lệch nghiêm trọng. Khối lượng của neutron và proton gần như tương đương nhau, do đó không thể bỏ qua trong bất kỳ trường hợp nào.
Để tránh các sai lầm trên, người học cần chú ý đến từng chi tiết trong quá trình tính toán và hiểu rõ bản chất của các công thức cũng như các yếu tố ảnh hưởng đến khối lượng nguyên tử.

8. Cách xác định khối lượng nguyên tử bằng máy tính
Khi tính toán khối lượng nguyên tử, sử dụng máy tính sẽ giúp bạn nhanh chóng và chính xác thực hiện các phép tính phức tạp. Dưới đây là hướng dẫn từng bước để xác định khối lượng nguyên tử bằng máy tính.
- Xác định số liệu cần thiết:
Bạn cần biết số proton và số neutron trong hạt nhân của nguyên tử. Các số liệu này thường được cung cấp trong bảng tuần hoàn hoặc thông qua các tài liệu khoa học.
- Sử dụng công thức tính toán:
Công thức chung để tính khối lượng nguyên tử là:
\[
m = \frac{Z \cdot m_{\text{proton}} + N \cdot m_{\text{neutron}}}{N_{\text{A}}}
\]- Z: Số proton trong nguyên tử
- N: Số neutron trong nguyên tử
- m_{\text{proton}}: Khối lượng của một proton (~1.0073 amu)
- m_{\text{neutron}}: Khối lượng của một neutron (~1.0087 amu)
- N_{\text{A}}: Hằng số Avogadro (6.022 × 10^{23} mol^{-1})
- Sử dụng máy tính để thực hiện phép tính:
Nhập các giá trị vào máy tính và thực hiện phép chia đơn giản. Ví dụ, nếu bạn đang tính khối lượng nguyên tử của cacbon (với 6 proton và 6 neutron):
\[
m_{\text{C}} = \frac{6 \cdot 1.0073 + 6 \cdot 1.0087}{6.022 \times 10^{23}} \approx 1.992 \times 10^{-23} \text{ g}
\]Điều này cho biết khối lượng nguyên tử của cacbon tính theo gam.
- Kiểm tra và đối chiếu:
So sánh kết quả của bạn với giá trị trong các tài liệu chuẩn hoặc bảng tuần hoàn để đảm bảo tính chính xác.
- Ứng dụng kết quả:
Khối lượng nguyên tử được tính toán có thể được sử dụng để dự đoán hành vi của các hợp chất và các phản ứng hóa học, giúp nâng cao hiệu quả nghiên cứu và học tập.
9. Khối lượng nguyên tử trong nghiên cứu và công nghiệp
Khối lượng nguyên tử là một yếu tố quan trọng không chỉ trong nghiên cứu khoa học mà còn trong nhiều ngành công nghiệp hiện đại. Việc hiểu và xác định khối lượng nguyên tử một cách chính xác giúp các nhà khoa học và kỹ sư đưa ra những quyết định chính xác trong các quy trình nghiên cứu và sản xuất.
Dưới đây là một số cách mà khối lượng nguyên tử được áp dụng trong các lĩnh vực khác nhau:
- Nghiên cứu khoa học: Trong nghiên cứu hóa học và vật lý, việc xác định khối lượng nguyên tử là cơ sở để tính toán các phản ứng hóa học, định luật bảo toàn khối lượng, và nhiều lý thuyết khác. Các nhà khoa học sử dụng công thức khối lượng nguyên tử để xác định các thành phần và tỷ lệ trong các hợp chất, từ đó phát triển các vật liệu mới hoặc cải tiến các công nghệ hiện có.
- Công nghiệp hóa chất: Trong sản xuất hóa chất, việc tính toán chính xác khối lượng nguyên tử giúp tối ưu hóa các quy trình sản xuất, giảm thiểu lãng phí và đảm bảo chất lượng sản phẩm cuối cùng. Điều này đặc biệt quan trọng trong các ngành công nghiệp dược phẩm, hóa chất cơ bản, và vật liệu mới.
- Công nghiệp năng lượng: Trong lĩnh vực năng lượng hạt nhân, khối lượng nguyên tử của các nguyên tố phóng xạ là yếu tố quyết định để tính toán năng lượng giải phóng từ các phản ứng phân hạch. Điều này có ảnh hưởng trực tiếp đến thiết kế và vận hành các nhà máy điện hạt nhân.
Như vậy, khối lượng nguyên tử đóng vai trò then chốt trong việc thúc đẩy sự phát triển của khoa học và công nghiệp, mang lại những lợi ích thiết thực và lâu dài cho xã hội.