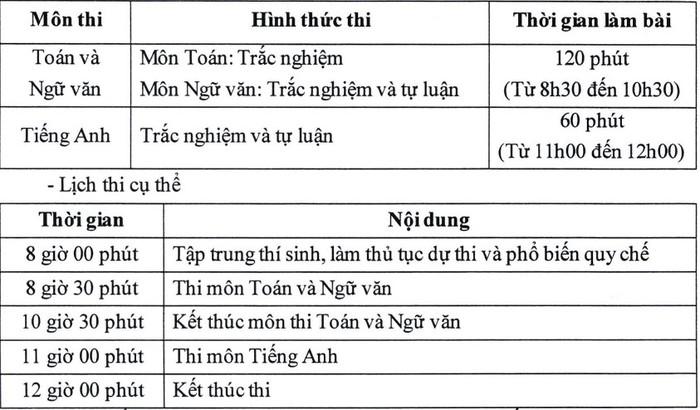
Rượu là một chất lỏng không màu, sôi ở 78,3oC, nhẹ hơn nước và tan vô hạn trong nước. Rượu etylic, còn được gọi là ancol etylic hoặc etanol, là thành phần chính trong rượu. Nó cũng có khả năng hòa tan nhiều chất như iot và benzen. Độ rượu có thể được tính bằng công thức: Độ rượu = (V(C2H5OH + H2O)⁄VC2H5OH) × 100. Trong công thức này, V được đo bằng ml hoặc lít.
Cấu tạo phân tử
Rượu etylic có công thức hóa học C2H5OH. Dưới đây là một hình ảnh minh họa về cấu trúc phân tử của rượu etylic:
Bạn đang xem: Công thức hóa học của rượu

Hình ảnh minh họa cấu trúc phân tử của rượu etylic
.png)
Tính chất hóa học
Xem thêm : This year là thì gì? Cấu trúc và ví dụ về this year trong tiếng Anh
Rượu etylic có những tính chất hóa học đặc biệt. Khi đốt cháy, nó tạo ra ngọn lửa màu xanh và tỏa nhiệt. Công thức phản ứng cháy của rượu etylic là: C2H5OH + 3O2 -> 2CO2 + 3H2O. Rượu etylic cũng có thể phản ứng với các kim loại mạnh như K, Na,… để tạo ra các hợp chất khác. Ví dụ, phản ứng giữa rượu etylic và Na sẽ tạo thành C2H5ONa và H2. Ngoài ra, rượu etylic còn có khả năng phản ứng với axit. Ví dụ, khi tác dụng với axit axetic có H2SO4 đặc, rượu etylic sẽ tạo ra este và nước: CH3COOH + HO – C2H5 -> CH3COOC2H5 + H2O.
Ứng dụng
Rượu etylic có nhiều ứng dụng khác nhau. Nó được sử dụng làm nhiên liệu cho động cơ ô tô, cho đèn cồn trong phòng thí nghiệm. Ngoài ra, rượu etylic còn được sử dụng làm nguyên liệu trong sản xuất axit axetic, dược phẩm, cao su tổng hợp và trong việc pha chế các loại rượu uống.

Điều chế
Xem thêm : Công thức và cách đọc ngày tháng năm sinh trong tiếng Anh
Rượu etylic có thể được điều chế bằng hai phương pháp chính. Phương pháp sinh học sử dụng men rượu để chuyển đổi tinh bột hoặc đường thành rượu etylic thông qua quá trình len men. Công thức phản ứng là: C6H10O6 -> 2 CH3CH2OH + 2 CO2. Phương pháp công nghiệp sử dụng công nghệ hidrat hóa etylen để cho etylen tác dụng với nước và axit làm xúc tác, tạo ra rượu etylic: CH2 = CH2 + H2O -> C2H5OH.
Những hợp chất hữu cơ có nhóm OH cũng có tính chất tương tự rượu etylic. Chúng có công thức phân tử chung là CnH2n+1OH và được gọi là ancol no đơn chức hoặc ankanol.
Nguồn: https://ispacedanang.edu.vn
Danh mục: Khám phá