Chủ đề cấu tạo nguyên tử cu: Cấu tạo nguyên tử Cu (đồng) là một chủ đề quan trọng trong hóa học và vật lý nguyên tử, giúp hiểu rõ về cấu trúc, phân bố electron, và tính chất hóa học của nguyên tố này. Bài viết này sẽ cung cấp một cái nhìn chi tiết về cấu tạo nguyên tử Cu, bao gồm sự phân bố của các proton, neutron, và electron, cùng với các quy tắc và nguyên lý cần biết để viết cấu hình electron một cách chính xác.
Mục lục
- Cấu Tạo Nguyên Tử Cu
- 1. Giới Thiệu Về Nguyên Tử
- 2. Thành Phần Của Nguyên Tử
- 3. Sơ Đồ Tư Duy Về Cấu Tạo Nguyên Tử
- 4. Cấu Hình Electron Nguyên Tử
- 5. Các Bài Tập Thực Hành
- 6. Ứng Dụng Của Kiến Thức Về Nguyên Tử Trong Hóa Học
- 7. Khám Phá Quan Trọng Trong Nghiên Cứu Nguyên Tử
- 8. Tổng Kết Và Định Hướng Nghiên Cứu Tương Lai
Cấu Tạo Nguyên Tử Cu
Nguyên tử đồng (Cu) là một trong những nguyên tố quan trọng trong bảng tuần hoàn, được sử dụng rộng rãi trong nhiều ngành công nghiệp và khoa học. Để hiểu rõ hơn về cấu tạo của nguyên tử đồng, chúng ta cần xem xét chi tiết các thành phần và đặc điểm của nó.
1. Cấu Trúc Nguyên Tử Đồng
Nguyên tử đồng (Cu) có số nguyên tử là 29, có nghĩa là nó chứa 29 proton trong hạt nhân. Ngoài ra, nó còn có 29 electron phân bố trên các lớp vỏ electron theo thứ tự:
- Lớp K: 2 electron
- Lớp L: 8 electron
- Lớp M: 18 electron
- Lớp N: 1 electron
Hạt nhân của nguyên tử đồng chứa các proton và neutron, trong đó số neutron có thể thay đổi tùy thuộc vào đồng vị của đồng.
2. Các Đồng Vị của Đồng (Cu)
Đồng có hai đồng vị tự nhiên ổn định:
- \(^{63}Cu\) với tỉ lệ tự nhiên khoảng 69.17%
- \(^{65}Cu\) với tỉ lệ tự nhiên khoảng 30.83%
Các đồng vị này khác nhau về số neutron trong hạt nhân, nhưng chúng có cùng số proton (29).
3. Đặc Tính Hóa Học và Vật Lý của Đồng
- Tính chất vật lý: Đồng là kim loại có màu đỏ cam, tính dẫn điện và dẫn nhiệt cao. Nó có khối lượng riêng là 8.96 g/cm3 và nhiệt độ nóng chảy là 1084.62°C.
- Tính chất hóa học: Đồng thường tồn tại trong các hợp chất với số oxi hóa +1 và +2. Nó không phản ứng với nước nhưng có thể phản ứng với các axit mạnh như HNO\(_3\) và H\(_2\)SO\(_4\) đặc.
4. Ứng Dụng của Đồng trong Đời Sống và Công Nghiệp
Đồng có nhiều ứng dụng quan trọng trong đời sống và công nghiệp nhờ các tính chất dẫn điện, dẫn nhiệt tốt và khả năng chống ăn mòn:
- Trong công nghiệp điện: Đồng được sử dụng để sản xuất dây điện, cáp điện nhờ khả năng dẫn điện tốt.
- Trong công nghiệp hóa chất: Đồng là chất xúc tác trong nhiều phản ứng hóa học, đặc biệt là trong quá trình sản xuất axit sulfuric.
- Trong y học: Đồng có vai trò quan trọng trong cơ thể con người, tham gia vào quá trình hình thành hồng cầu và bảo vệ tế bào khỏi sự oxi hóa.
5. Các Hợp Chất Quan Trọng của Đồng
Đồng có thể tạo ra nhiều hợp chất hóa học khác nhau, bao gồm:
- CuO (Đồng(II) oxit): Một chất rắn màu đen, được sử dụng trong sản xuất gốm sứ và làm chất xúc tác trong công nghiệp.
- CuSO\(_4\)·5H\(_2\)O (Đồng(II) sunfat ngậm nước): Một chất rắn màu xanh dương, được sử dụng trong nông nghiệp làm thuốc trừ sâu và trong phòng thí nghiệm như một chất chỉ thị.
6. Sơ Đồ Cấu Tạo Nguyên Tử Đồng
Sơ đồ cấu tạo nguyên tử đồng giúp chúng ta hiểu rõ hơn về cách các electron được sắp xếp xung quanh hạt nhân. Dưới đây là sơ đồ đơn giản của nguyên tử đồng:
Trung tâm là hạt nhân chứa 29 proton và số neutron thay đổi tùy theo đồng vị. Các electron được phân bố trên các lớp vỏ xung quanh hạt nhân theo thứ tự năng lượng tăng dần.
7. Tầm Quan Trọng của Đồng Trong Khoa Học và Kỹ Thuật
Đồng không chỉ quan trọng trong hóa học mà còn có vai trò quan trọng trong vật lý, sinh học, và các ngành khoa học kỹ thuật khác. Hiểu rõ cấu tạo nguyên tử và tính chất của đồng giúp cải thiện các công nghệ hiện đại như vật liệu siêu dẫn, vi điện tử, và công nghệ nano.
.png)
1. Giới Thiệu Về Nguyên Tử
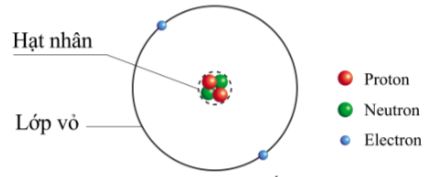
Nguyên tử là đơn vị cơ bản của vật chất, là thành phần nhỏ nhất của một nguyên tố hóa học mà vẫn giữ nguyên được tính chất hóa học của nguyên tố đó. Mỗi nguyên tử bao gồm một hạt nhân ở trung tâm, xung quanh là các electron chuyển động trong các quỹ đạo. Hạt nhân chứa proton và neutron, trong khi các electron mang điện tích âm bao quanh hạt nhân, tạo ra một cấu trúc phức tạp nhưng cân bằng.
- Hạt nhân nguyên tử: Hạt nhân là phần trung tâm của nguyên tử, chứa các hạt proton và neutron. Proton mang điện tích dương, neutron không mang điện tích, và cả hai cùng quyết định khối lượng nguyên tử. Trong hạt nhân, số lượng proton xác định số hiệu nguyên tử của nguyên tố, đồng thời quyết định tính chất hóa học của nguyên tố đó.
- Electron và các lớp vỏ: Electron là các hạt mang điện tích âm quay quanh hạt nhân trong các lớp vỏ. Sự sắp xếp của electron trong các lớp vỏ quyết định tính chất hóa học của nguyên tử và khả năng tham gia vào các phản ứng hóa học. Electron càng gần hạt nhân thì lực hút giữa chúng với hạt nhân càng mạnh, và ngược lại.
Mỗi nguyên tố có một số lượng proton khác nhau trong hạt nhân, ví dụ như nguyên tử đồng (Cu) có 29 proton. Điều này làm cho mỗi nguyên tử của một nguyên tố cụ thể là duy nhất và không thể thay thế bằng bất kỳ nguyên tử nào khác. Các nguyên tố có thể có nhiều đồng vị, tức là các dạng của nguyên tố có cùng số proton nhưng khác số neutron.
| Thành phần | Mô tả | Vai trò |
|---|---|---|
| Proton | Hạt mang điện tích dương trong hạt nhân | Xác định số hiệu nguyên tử và tính chất hóa học |
| Neutron | Hạt không mang điện tích trong hạt nhân | Góp phần vào khối lượng nguyên tử, không ảnh hưởng đến tính chất hóa học |
| Electron | Hạt mang điện tích âm quay quanh hạt nhân | Tham gia vào các phản ứng hóa học, tạo nên các liên kết hóa học |
Nguyên tử là nền tảng của hóa học và vật lý, và việc hiểu rõ cấu trúc của nguyên tử giúp chúng ta có cái nhìn sâu sắc hơn về các hiện tượng vật lý và hóa học trong tự nhiên, từ đó phát triển các ứng dụng khoa học và công nghệ phục vụ đời sống con người.
2. Thành Phần Của Nguyên Tử
Nguyên tử được cấu thành từ ba loại hạt cơ bản: proton, neutron, và electron. Mỗi hạt có đặc tính và chức năng riêng biệt, đóng góp vào tính chất và hành vi của nguyên tử trong các phản ứng hóa học và vật lý.
- Proton: Proton là hạt mang điện tích dương, ký hiệu là \(p^+\). Chúng nằm trong hạt nhân của nguyên tử và xác định số hiệu nguyên tử cũng như tính chất hóa học của nguyên tố. Số lượng proton trong hạt nhân xác định nguyên tố hóa học và là một đặc điểm quan trọng để phân biệt các nguyên tố khác nhau.
- Neutron: Neutron là hạt không mang điện tích, ký hiệu là \(n^0\). Neutron cùng với proton tạo nên hạt nhân nguyên tử. Chúng có vai trò giữ cho hạt nhân ổn định bằng cách giảm lực đẩy giữa các proton tích điện dương. Số neutron có thể thay đổi, dẫn đến sự hình thành các đồng vị khác nhau của cùng một nguyên tố.
- Electron: Electron là hạt mang điện tích âm, ký hiệu là \(e^-\). Chúng chuyển động xung quanh hạt nhân trong các lớp vỏ điện tử. Sự sắp xếp và chuyển động của electron quyết định tính chất hóa học và vật lý của nguyên tử, bao gồm khả năng tạo liên kết và tham gia vào các phản ứng hóa học.
Mỗi nguyên tử có một số proton nhất định trong hạt nhân và số neutron có thể thay đổi. Ví dụ, nguyên tử đồng (Cu) có 29 proton trong hạt nhân, và số neutron có thể là 34 hoặc 36, tạo nên các đồng vị của đồng.
| Hạt | Ký hiệu | Điện tích | Vị trí |
|---|---|---|---|
| Proton | \(p^+\) | +1 | Hạt nhân |
| Neutron | \(n^0\) | 0 | Hạt nhân |
| Electron | \(e^-\) | -1 | Lớp vỏ |
Khối lượng nguyên tử chủ yếu tập trung ở hạt nhân, nơi proton và neutron tồn tại. Electron có khối lượng rất nhỏ và không đáng kể so với khối lượng của hạt nhân. Tuy nhiên, chúng đóng vai trò quan trọng trong việc quyết định các phản ứng hóa học và sự liên kết giữa các nguyên tử. Hiểu rõ về thành phần của nguyên tử giúp chúng ta nắm bắt được cơ sở của hóa học và vật lý, từ đó ứng dụng vào nhiều lĩnh vực khác nhau trong khoa học và công nghệ.

3. Sơ Đồ Tư Duy Về Cấu Tạo Nguyên Tử
Sơ đồ tư duy về cấu tạo nguyên tử giúp chúng ta hiểu rõ hơn về cách sắp xếp các hạt trong nguyên tử và mối quan hệ giữa chúng. Dưới đây là một số thông tin quan trọng để tạo ra một sơ đồ tư duy chi tiết về cấu tạo nguyên tử của đồng (Cu):
- Số hiệu nguyên tử: Đồng (Cu) có số hiệu nguyên tử là 29.
- Số proton (Z): \( Z = 29 \)
- Số neutron (N): \( N = A - Z = 64 - 29 = 35 \)
- Số electron (e): \( e = 29 \)
Trong sơ đồ cấu tạo nguyên tử của đồng, chúng ta có thể sắp xếp các electron vào các lớp vỏ theo nguyên tắc sau:
- Lớp K: 2 electron
- Lớp L: 8 electron
- Lớp M: 18 electron
- Lớp N: 1 electron
Cấu hình electron của Cu: \[ [Ar] 3d^{10}4s^{1} \]
Khi tạo sơ đồ tư duy, hãy đảm bảo rằng các electron được phân bố đúng trong các lớp vỏ và thể hiện rõ cấu hình electron.
Một số tính chất hóa học liên quan đến cấu tạo nguyên tử của đồng
- Đồng có tính khử yếu hơn so với nhiều kim loại khác và có thể tác dụng với phi kim, axit, và dung dịch muối.
- Phản ứng với oxi: \[ 2Cu + O_{2} \rightarrow 2CuO \]
- Phản ứng với axit: \[ Cu + 2H_{2}SO_{4}(\text{đặc}) \rightarrow CuSO_{4} + SO_{2} + 2H_{2}O \]
Các bước để tạo sơ đồ tư duy về cấu tạo nguyên tử của đồng (Cu)
- Xác định số lượng proton, neutron, và electron trong nguyên tử đồng.
- Sắp xếp các electron vào các lớp vỏ theo cấu hình electron.
- Vẽ sơ đồ với các vòng tròn đại diện cho các lớp vỏ electron và ghi số electron tương ứng vào mỗi lớp.
- Thêm các thông tin chi tiết như số hiệu nguyên tử, khối lượng nguyên tử, và các tính chất hóa học liên quan.
Việc hiểu rõ cấu trúc nguyên tử đồng và cách vẽ sơ đồ tư duy giúp chúng ta có cái nhìn sâu sắc hơn về tính chất hóa học và vật lý của nguyên tố này, đồng thời ứng dụng vào nhiều lĩnh vực khoa học và công nghệ.

4. Cấu Hình Electron Nguyên Tử
Cấu hình electron của một nguyên tử mô tả cách các electron được sắp xếp xung quanh hạt nhân nguyên tử, giúp chúng ta hiểu rõ hơn về tính chất hóa học và vật lý của nguyên tố đó. Đối với nguyên tử đồng (Cu), việc xác định cấu hình electron là bước quan trọng để hiểu về tính chất và khả năng phản ứng của nó.
Nguyên tử đồng có số hiệu nguyên tử là 29, nghĩa là có 29 proton trong hạt nhân và 29 electron xung quanh hạt nhân. Cấu hình electron của đồng không tuân theo quy luật đơn giản như các nguyên tố khác, mà có sự chuyển đổi để đạt được cấu hình bền vững hơn.
Cấu Hình Electron Cơ Bản
- Đầu tiên, chúng ta xác định các lớp vỏ và phân lớp mà các electron sẽ chiếm giữ. Các lớp và phân lớp được điền electron theo thứ tự mức năng lượng tăng dần, theo nguyên tắc Aufbau.
- Cấu hình electron cơ bản của đồng có thể được biểu diễn như sau:
- \[1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^9\]
Cấu Hình Electron Ổn Định
Tuy nhiên, đồng là một trong những nguyên tố có cấu hình electron thực tế khác với dự đoán ban đầu. Để đạt được trạng thái năng lượng thấp hơn và ổn định hơn, một electron từ phân lớp 4s sẽ chuyển sang phân lớp 3d, do đó cấu hình electron của đồng trở thành:
\[1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^1\]
Việc chuyển electron này giúp phân lớp 3d được lấp đầy hoàn toàn (10 electron), tạo ra cấu hình bền hơn. Sự sắp xếp này giải thích tại sao đồng lại có các tính chất hóa học đặc biệt và khả năng tạo phức hợp mạnh với nhiều hợp chất khác.
Tầm Quan Trọng Của Cấu Hình Electron
- Tính chất hóa học: Cấu hình electron của đồng giúp giải thích tại sao nó có thể dễ dàng tham gia vào các phản ứng oxy hóa khử, ví dụ như phản ứng với các axit hoặc halogen.
- Liên kết và cấu trúc: Việc hiểu rõ cấu hình electron của đồng giúp giải thích cách nó liên kết với các nguyên tố khác để tạo ra các hợp chất có cấu trúc và tính chất đặc biệt, chẳng hạn như đồng sunfat (\(CuSO_4\)) hay đồng(I) oxit (\(Cu_2O\)).
Nhờ hiểu rõ cấu hình electron của nguyên tử đồng, chúng ta có thể dự đoán được nhiều tính chất hóa học và vật lý của đồng cũng như ứng dụng của nó trong nhiều lĩnh vực khác nhau như điện tử, vật liệu, và hóa học.

5. Các Bài Tập Thực Hành
Để nắm vững kiến thức về cấu tạo nguyên tử, đặc biệt là nguyên tử đồng (Cu), các bài tập thực hành là một phần quan trọng giúp học sinh củng cố và áp dụng các lý thuyết đã học. Dưới đây là một số bài tập thực hành dành cho các bạn:
Bài Tập 1: Xác Định Cấu Hình Electron
- Xác định cấu hình electron đầy đủ của nguyên tử đồng (Cu) với số hiệu nguyên tử là 29.
- Giải thích sự sắp xếp electron trong các phân lớp của đồng.
Bài Tập 2: Tính Số Hạt Trong Nguyên Tử
Cho biết số hiệu nguyên tử của đồng là 29, hãy tính:
- Tổng số proton, neutron, và electron trong một nguyên tử đồng.
- Nếu đồng có số khối là 63, hãy xác định số neutron trong hạt nhân.
Bài Tập 3: Ứng Dụng Kiến Thức Về Đồng Trong Hóa Học
- Giải thích tại sao đồng có thể tạo ra các hợp chất có số oxy hóa +1 và +2.
- Viết phương trình hóa học cho phản ứng của đồng với axit sulfuric loãng.
Bài Tập 4: Vẽ Sơ Đồ Nguyên Tử Đồng
- Vẽ sơ đồ cấu tạo nguyên tử đồng, bao gồm hạt nhân với số proton và neutron tương ứng, và các lớp vỏ electron.
- Xác định các phân lớp và electron trên mỗi phân lớp.
Bài Tập 5: Giải Thích Tính Chất Vật Lý và Hóa Học Của Đồng
Dựa vào cấu hình electron và cấu tạo nguyên tử của đồng, hãy trả lời các câu hỏi sau:
- Tại sao đồng có tính dẫn điện và dẫn nhiệt tốt?
- Tại sao đồng thường được sử dụng trong ngành điện và điện tử?
Bài Tập 6: Tính Toán Năng Lượng Ion Hóa
Cho biết năng lượng ion hóa thứ nhất của đồng là 7.726 eV:
- Tính năng lượng cần thiết để loại bỏ electron thứ nhất từ nguyên tử đồng trung hòa.
- Giải thích sự khác biệt năng lượng ion hóa giữa electron thứ nhất và electron thứ hai của đồng.
Bài Tập 7: Phân Tích Cấu Trúc Tinh Thể Của Đồng
- Đồng có cấu trúc tinh thể lập phương tâm diện (FCC). Hãy giải thích đặc điểm của cấu trúc này và so sánh với các cấu trúc khác.
- Tính mật độ nguyên tử trong mạng tinh thể của đồng.
Các bài tập trên giúp học sinh nắm vững kiến thức cơ bản và nâng cao về cấu tạo nguyên tử, đặc biệt là nguyên tử đồng, đồng thời phát triển khả năng tư duy phân tích và giải quyết vấn đề trong hóa học.
XEM THÊM:
6. Ứng Dụng Của Kiến Thức Về Nguyên Tử Trong Hóa Học
Việc hiểu rõ cấu tạo nguyên tử là nền tảng quan trọng giúp giải thích các tính chất hóa học và phản ứng của các nguyên tố. Dưới đây là một số ứng dụng cụ thể của kiến thức về nguyên tử trong hóa học:
6.1. Tính Chất Hóa Học Của Nguyên Tố
Cấu tạo nguyên tử, đặc biệt là cấu hình electron, ảnh hưởng trực tiếp đến tính chất hóa học của một nguyên tố. Ví dụ, nguyên tố đồng (Cu) có cấu hình electron \( \text{[Ar]}3d^{10}4s^{1} \), điều này giúp giải thích tính chất dẫn điện và phản ứng hóa học đặc trưng của nó.
6.2. Phản Ứng Hóa Học Và Cấu Tạo Nguyên Tử
Trong các phản ứng hóa học, sự tái sắp xếp của các electron giữa các nguyên tử là yếu tố quyết định kết quả của phản ứng. Ví dụ, trong phản ứng oxi hóa khử, electron sẽ được chuyển từ nguyên tử này sang nguyên tử khác, gây ra sự thay đổi về số oxy hóa và tạo ra sản phẩm mới.
6.3. Sự Liên Quan Giữa Cấu Hình Electron Và Hoạt Tính Hóa Học
Cấu hình electron không chỉ ảnh hưởng đến tính chất hóa học của nguyên tố mà còn quyết định mức độ hoạt động hóa học của nó. Các nguyên tử có lớp vỏ electron ngoài cùng chưa đầy đủ thường có xu hướng phản ứng mạnh mẽ hơn. Ví dụ, đồng (Cu) có thể phản ứng với các axit mạnh để tạo ra các hợp chất như \( \text{CuSO}_4 \).
Dưới đây là bảng minh họa mối quan hệ giữa cấu hình electron và hoạt tính hóa học của một số nguyên tố:
| Nguyên Tố | Cấu Hình Electron | Hoạt Tính Hóa Học |
|---|---|---|
| Hydro (H) | 1s1 | Hoạt động mạnh với nhiều nguyên tố khác |
| Oxy (O) | 1s22s22p4 | Rất hoạt động, đặc biệt trong phản ứng oxi hóa khử |
| Đồng (Cu) | \( \text{[Ar]}3d^{10}4s^{1} \) | Dễ dàng tham gia các phản ứng oxi hóa khử |
7. Khám Phá Quan Trọng Trong Nghiên Cứu Nguyên Tử
Trong nghiên cứu nguyên tử, có nhiều khám phá quan trọng đã giúp chúng ta hiểu rõ hơn về cấu tạo và tính chất của nguyên tử. Những khám phá này không chỉ mở rộng kiến thức khoa học mà còn đóng góp vào các ứng dụng thực tiễn trong nhiều lĩnh vực khác nhau.
7.1. Khám Phá Proton và Neutron
Proton và neutron là hai hạt cơ bản tạo thành hạt nhân của nguyên tử. Khám phá về proton và neutron đã giúp xác định cấu trúc của hạt nhân và cách chúng tương tác với nhau. Proton mang điện tích dương, trong khi neutron không mang điện tích. Sự cân bằng giữa proton và neutron ảnh hưởng trực tiếp đến tính ổn định của nguyên tử.
- Proton: Mang điện tích dương, số lượng proton trong hạt nhân xác định nguyên tố hóa học.
- Neutron: Không mang điện tích, giúp giữ cho các proton trong hạt nhân không bị đẩy ra xa do lực đẩy điện tích dương.
7.2. Các Dạng Phóng Xạ: Alpha, Beta, và Gamma
Phóng xạ là quá trình phát ra năng lượng và các hạt từ hạt nhân không ổn định. Có ba dạng phóng xạ chính:
- Phóng xạ Alpha: Phóng ra các hạt alpha (2 proton và 2 neutron), thường gặp trong các nguyên tố nặng.
- Phóng xạ Beta: Phóng ra các hạt beta (electron hoặc positron), xảy ra khi một neutron chuyển thành proton hoặc ngược lại.
- Phóng xạ Gamma: Phóng ra bức xạ gamma, là sóng điện từ có năng lượng cao, không làm thay đổi cấu trúc của nguyên tử.
7.3. Những Thí Nghiệm Quan Trọng: Thí Nghiệm Bắn Phá Alpha
Thí nghiệm bắn phá alpha, do Ernest Rutherford thực hiện vào đầu thế kỷ 20, đã giúp phát hiện cấu trúc của hạt nhân nguyên tử. Thí nghiệm này đã chỉ ra rằng hạt nhân có kích thước nhỏ hơn nhiều so với kích thước toàn bộ nguyên tử và hầu hết không gian trong nguyên tử là rỗng.
| Thí Nghiệm | Phát Hiện |
|---|---|
| Thí Nghiệm Bắn Phá Alpha | Hạt nhân nguyên tử có kích thước nhỏ và dày đặc, nguyên tử chủ yếu là không gian rỗng. |

8. Tổng Kết Và Định Hướng Nghiên Cứu Tương Lai
Nghiên cứu về cấu tạo nguyên tử đã mang lại những hiểu biết sâu sắc về cách các hạt cơ bản tạo nên vật chất xung quanh chúng ta. Các khám phá trong lĩnh vực này không chỉ mở rộng kiến thức khoa học mà còn tạo nền tảng cho các ứng dụng công nghệ và y học hiện đại. Dưới đây là một số điểm tổng kết và định hướng nghiên cứu trong tương lai:
8.1. Tổng Kết Kiến Thức Về Nguyên Tử
Cho đến nay, chúng ta đã có được hiểu biết vững chắc về cấu trúc của nguyên tử, bao gồm các thành phần chính như proton, neutron và electron, cũng như các mô hình mô tả sự tương tác giữa chúng. Những thí nghiệm quan trọng như thí nghiệm Rutherford đã làm sáng tỏ cấu trúc hạt nhân và vai trò của từng thành phần trong nguyên tử.
8.2. Xu Hướng Nghiên Cứu Hiện Đại Về Nguyên Tử
Hiện nay, nghiên cứu về nguyên tử đang chuyển hướng tới việc khám phá các yếu tố vi mô hơn, như các tương tác giữa các hạt cơ bản trong các điều kiện cực đoan. Các công trình nghiên cứu đang tập trung vào:
- Khoa học vật liệu: Nghiên cứu cấu trúc nguyên tử để phát triển vật liệu mới với tính chất đặc biệt.
- Vật lý lượng tử: Khám phá các hiện tượng lượng tử và ứng dụng của chúng trong công nghệ lượng tử.
- Y học: Áp dụng các kỹ thuật nghiên cứu nguyên tử trong việc phát triển các phương pháp chẩn đoán và điều trị mới.
8.3. Ứng Dụng Thực Tiễn Của Nghiên Cứu Về Nguyên Tử
Các ứng dụng thực tiễn của nghiên cứu về nguyên tử đã trở nên phong phú và đa dạng, từ công nghệ hạt nhân đến các phương pháp chẩn đoán y học. Những ứng dụng này bao gồm:
| Ứng Dụng | Mô Tả |
|---|---|
| Công nghệ hạt nhân | Ứng dụng năng lượng hạt nhân trong sản xuất điện và các ứng dụng công nghiệp. |
| Y học hạt nhân | Sử dụng các kỹ thuật hình ảnh và điều trị dựa trên phóng xạ để chẩn đoán và điều trị bệnh. |
| Vật liệu mới | Phát triển vật liệu với các đặc tính vượt trội nhờ hiểu biết về cấu trúc nguyên tử. |