Chủ đề 8 electrons in outer shell: Khám phá ý nghĩa của việc có 8 electron trong lớp vỏ ngoài của nguyên tử, một yếu tố quan trọng trong hóa học. Quy tắc octet không chỉ giúp chúng ta hiểu cách các nguyên tử tương tác mà còn giải thích sự ổn định của các phân tử và hợp chất. Bài viết này sẽ cung cấp cái nhìn sâu sắc về cấu hình electron và ứng dụng của quy tắc octet trong hóa học.
Mục lục
Các thông tin liên quan đến "8 electrons in outer shell"
Khi tìm kiếm từ khóa "8 electrons in outer shell" trên Bing tại Việt Nam, các thông tin chủ yếu liên quan đến cấu hình electron trong hóa học, đặc biệt là nguyên lý liên quan đến lớp vỏ ngoài của nguyên tử. Đây là một khía cạnh quan trọng trong nghiên cứu hóa học và vật lý nguyên tử. Dưới đây là tổng hợp thông tin chi tiết từ kết quả tìm kiếm:
1. Ý nghĩa của 8 electron trong lớp vỏ ngoài
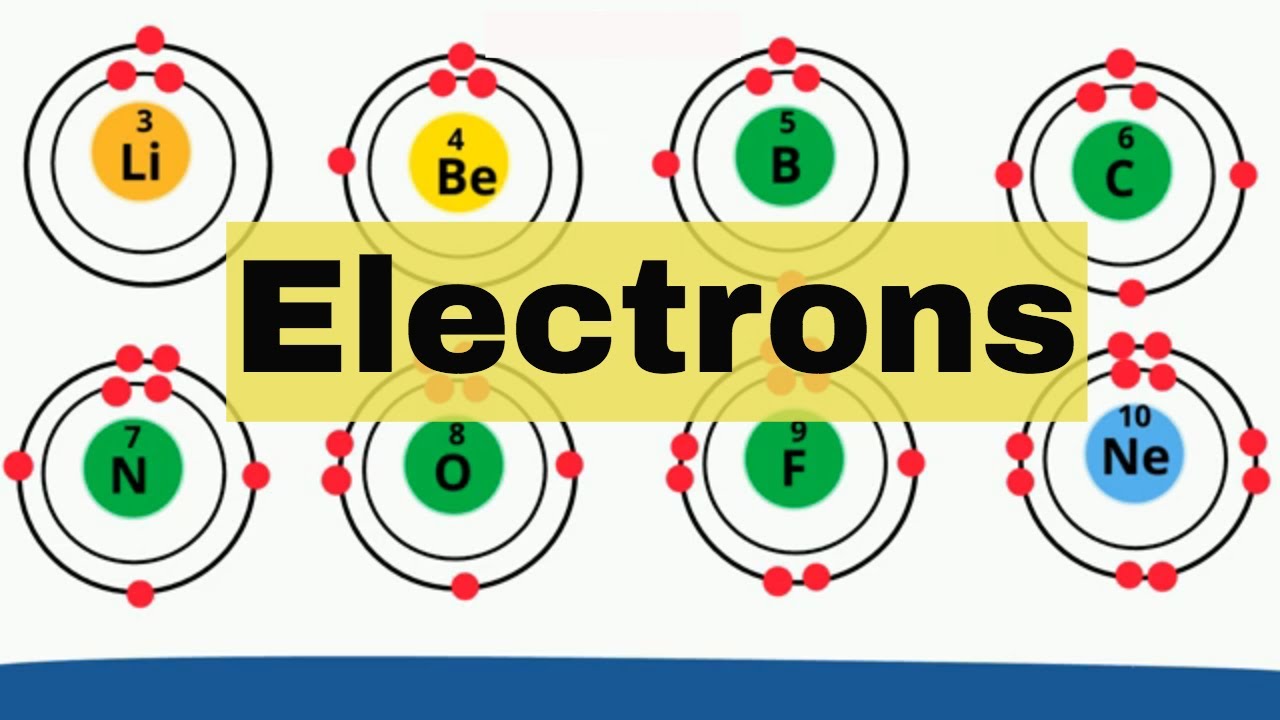
Cấu hình electron với 8 electron trong lớp vỏ ngoài thường được gọi là quy tắc octet. Điều này rất quan trọng trong hóa học vì nó giúp nguyên tử đạt được sự ổn định giống như khí hiếm, tạo ra các liên kết hóa học bền vững. Ví dụ:
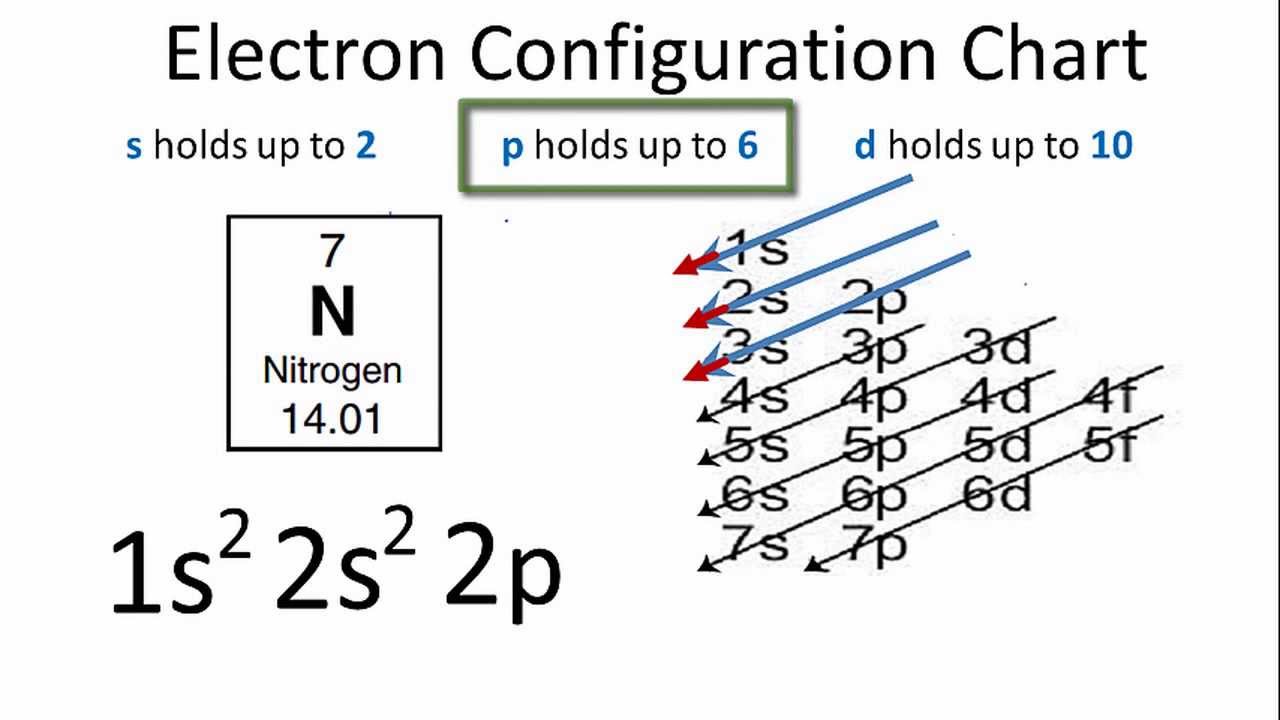
- Nguyên tử oxy: Có 6 electron trong lớp vỏ ngoài và cần thêm 2 electron để hoàn thành lớp vỏ với 8 electron.
- Nguyên tử neon: Có 8 electron trong lớp vỏ ngoài, thuộc loại khí hiếm, và do đó rất ổn định.
2. Ứng dụng của quy tắc octet trong hóa học
Quy tắc octet giúp giải thích nhiều hiện tượng hóa học, bao gồm:
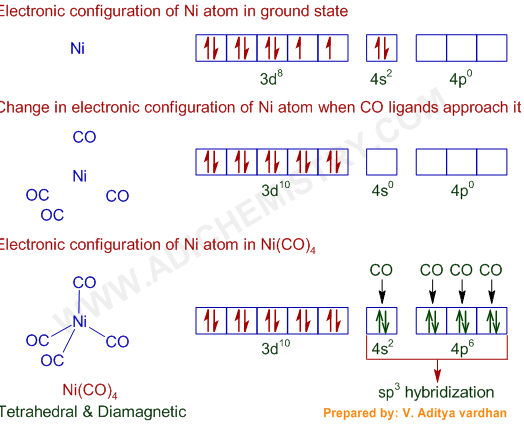
- Liên kết ion: Ví dụ, natri và clo tạo ra muối ăn (NaCl) bằng cách chuyển electron để cả hai nguyên tử đạt được cấu hình ổn định với 8 electron.
- Liên kết cộng hóa trị: Nguyên tử chia sẻ electron để đạt được cấu hình ổn định, như trong phân tử nước (H2O).
3. Mối liên hệ với các yếu tố hóa học khác
Quy tắc octet không phải lúc nào cũng áp dụng cho tất cả các nguyên tử, nhưng nó là một khái niệm cơ bản giúp hiểu về tính chất hóa học của các nguyên tử. Các nguyên tử có thể có số electron khác nhau trong lớp vỏ ngoài tùy thuộc vào loại nguyên tử và trạng thái của nó.
4. Ví dụ về các nguyên tố có cấu hình electron đặc biệt
| Nguyên tố | Cấu hình electron | Loại |
|---|---|---|
| Neon (Ne) | 1s2 2s2 2p6 | Khí hiếm |
| Oxy (O) | 1s2 2s2 2p4 | Phi kim |
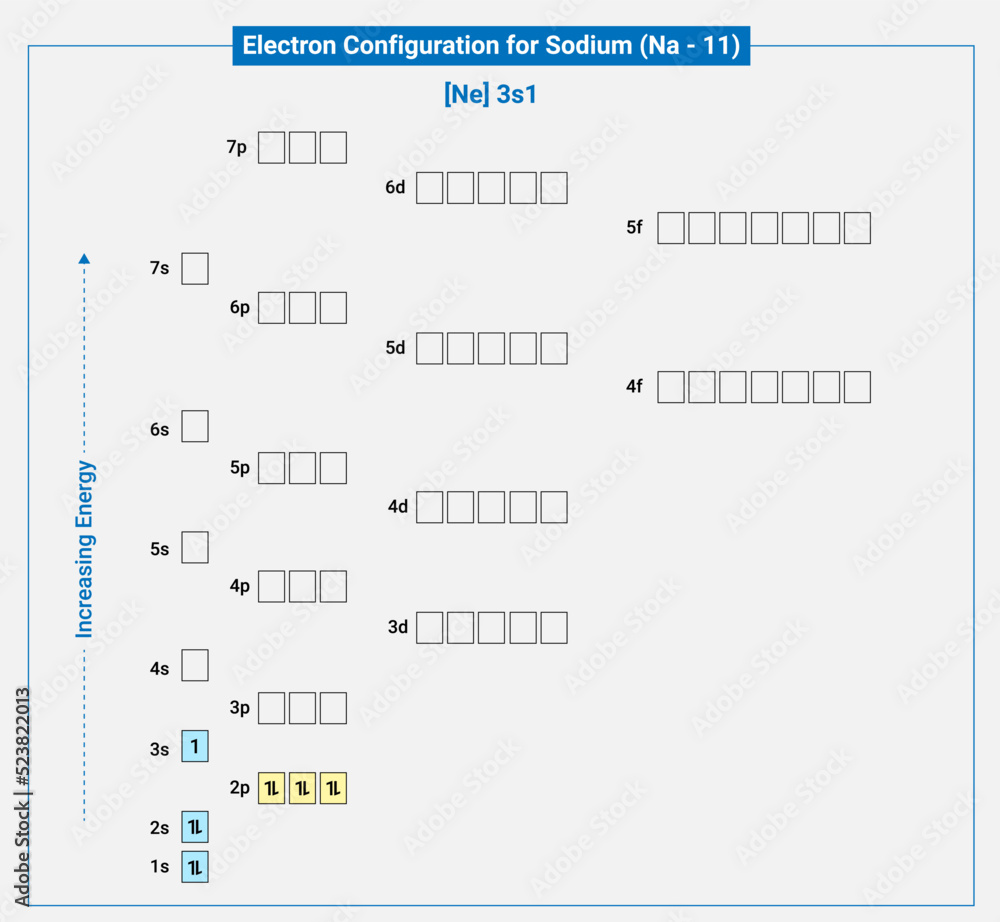
| Natri (Na) | 1s2 2s2 2p6 3s1 | Kim loại |

.png)
1. Tổng quan về cấu hình electron với 8 electron trong lớp vỏ ngoài
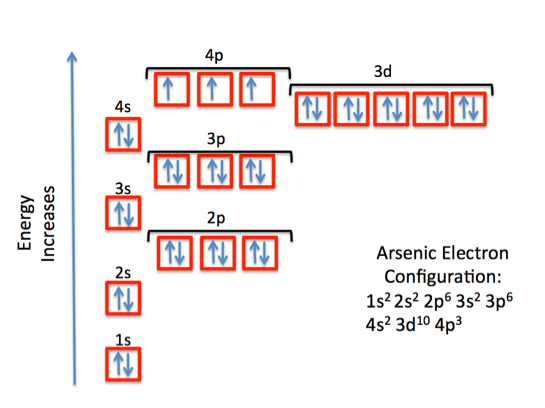
Cấu hình electron của nguyên tử đóng vai trò quan trọng trong việc xác định tính chất hóa học của các nguyên tố. Khi lớp vỏ ngoài của nguyên tử chứa đầy 8 electron, nguyên tử đó thường đạt trạng thái ổn định nhất, điều này được biết đến với tên gọi quy tắc octet.
1.1. Khái niệm quy tắc octet
Quy tắc octet là một nguyên tắc cơ bản trong hóa học, cho biết rằng nguyên tử thường có xu hướng duy trì 8 electron trong lớp vỏ ngoài để đạt được cấu hình electron ổn định, giống như các nguyên tố khí hiếm. Quy tắc này giúp giải thích vì sao các nguyên tử tham gia vào các phản ứng hóa học để đạt được cấu hình electron tương tự như các khí hiếm.
1.2. Ý nghĩa của 8 electron trong lớp vỏ ngoài
Khi một nguyên tử có 8 electron trong lớp vỏ ngoài, nó có xu hướng ít phản ứng hơn với các nguyên tử khác. Điều này giúp nguyên tử duy trì trạng thái năng lượng thấp và ổn định. Ví dụ, các nguyên tố khí hiếm như Neon (Ne) và Argon (Ar) có cấu hình electron hoàn chỉnh và không dễ bị thay đổi.
- Neon (Ne): 1s² 2s² 2p⁶
- Argon (Ar): 1s² 2s² 2p⁶ 3s² 3p⁶
Các nguyên tố này thể hiện rõ quy tắc octet bằng cách duy trì cấu hình electron đầy đủ trong lớp vỏ ngoài, làm cho chúng có tính ổn định cao và không dễ phản ứng với các nguyên tố khác.
3. Cấu hình electron đặc biệt của một số nguyên tố
Cấu hình electron của các nguyên tố ảnh hưởng lớn đến tính chất hóa học và sự phản ứng của chúng. Một số nguyên tố có cấu hình electron đặc biệt với 8 electron trong lớp vỏ ngoài, cho phép chúng đạt trạng thái ổn định tối ưu. Dưới đây là một số ví dụ nổi bật:
3.1. Nguyên tố khí hiếm và quy tắc octet
Nguyên tố khí hiếm có cấu hình electron đặc biệt với lớp vỏ ngoài hoàn chỉnh với 8 electron. Các nguyên tố này rất ổn định và ít phản ứng với các nguyên tố khác do đã đạt được cấu hình octet.
- Helium (He): 1s²
- Neon (Ne): 1s² 2s² 2p⁶
- Argon (Ar): 1s² 2s² 2p⁶ 3s² 3p⁶
3.2. Nguyên tố phi kim và kim loại có lớp vỏ electron không hoàn chỉnh
Nguyên tố phi kim và kim loại không phải lúc nào cũng có cấu hình electron hoàn chỉnh với 8 electron ở lớp vỏ ngoài. Những nguyên tố này có xu hướng tham gia phản ứng hóa học để đạt được cấu hình ổn định như các khí hiếm.
- Carbon (C): 1s² 2s² 2p² (cần 4 electron thêm để đạt octet)
- Sodium (Na): 1s² 2s² 2p⁶ 3s¹ (cần mất 1 electron để đạt cấu hình của Neon)
Những nguyên tố này tham gia vào các phản ứng hóa học để đạt được cấu hình electron giống như các khí hiếm, làm cho chúng có tính chất hóa học đặc biệt và có ảnh hưởng lớn đến sự hình thành các hợp chất hóa học.

4. Mối liên hệ với các khái niệm hóa học khác
Quy tắc octet, với việc đạt được 8 electron trong lớp vỏ ngoài, liên quan mật thiết đến nhiều khái niệm hóa học cơ bản và phức tạp. Dưới đây là một số mối liên hệ quan trọng:
4.1. Ảnh hưởng của quy tắc octet đến tính chất hóa học của nguyên tử
Quy tắc octet ảnh hưởng lớn đến cách các nguyên tử tương tác và phản ứng với nhau. Nguyên tử có lớp vỏ ngoài đầy đủ 8 electron thường ổn định hơn và ít phản ứng hơn, điều này giải thích sự hình thành của các phân tử và hợp chất ổn định hơn. Nguyên tử này sẽ tìm cách đạt được cấu hình đầy đủ qua các liên kết hóa học.
4.2. Các nguyên tố và phân tử với cấu hình electron đặc biệt
Các nguyên tố và phân tử không tuân theo quy tắc octet cũng có cấu hình electron đặc biệt. Ví dụ, một số phân tử như oxy (O₂) và nitơ (N₂) có cấu hình electron không hoàn chỉnh nhưng vẫn ổn định nhờ vào việc chia sẻ electron trong các liên kết cộng hóa trị.
- Oxy (O₂): Có liên kết đôi giữa hai nguyên tử oxy, mỗi nguyên tử đều chia sẻ 4 electron.
- Nitơ (N₂): Có liên kết ba giữa hai nguyên tử nitơ, mỗi nguyên tử chia sẻ 6 electron.
Những cấu hình đặc biệt này cho phép các phân tử duy trì tính chất hóa học của mình trong các điều kiện khác nhau, đồng thời vẫn có thể thực hiện các phản ứng hóa học một cách hiệu quả.

5. Ví dụ thực tiễn về quy tắc octet
Quy tắc octet là một nguyên tắc quan trọng trong hóa học, giúp chúng ta hiểu cách các nguyên tử tương tác với nhau để đạt được cấu hình electron ổn định. Dưới đây là một số ví dụ thực tiễn về quy tắc octet:
-
5.1. Ví dụ về phân tử và hợp chất tuân theo quy tắc octet
Phân tử nước (H2O) là một ví dụ điển hình của quy tắc octet. Trong phân tử nước, nguyên tử oxy có 6 electron trong lớp vỏ ngoài, và chia sẻ 2 cặp electron với hai nguyên tử hydro để hoàn thành lớp vỏ electron của oxy.
Các phân tử khí hiếm như Neon (Ne) cũng tuân theo quy tắc octet, với lớp vỏ ngoài đã hoàn chỉnh 8 electron, điều này giải thích tại sao chúng ít phản ứng với các nguyên tố khác.
-
5.2. Trường hợp ngoại lệ của quy tắc octet trong các nguyên tử và phân tử
Mặc dù quy tắc octet rất phổ biến, một số nguyên tử không tuân theo quy tắc này. Ví dụ, phân tử Boron Hydride (BH3) không đạt được cấu hình octet vì nguyên tử boron chỉ có 6 electron trong lớp vỏ ngoài, điều này là do boron có khả năng ổn định ở trạng thái này.
Thêm vào đó, các phân tử với số lượng electron chẵn như Sulfur Hexafluoride (SF6) thường có nhiều hơn 8 electron trong lớp vỏ ngoài của nguyên tử sulfur, điều này gọi là quá tải electron.