Chào mừng các bạn đến với bài viết hôm nay về lý thuyết khái niệm về cân bằng hóa học. Hóa học là một ngành khoa học thú vị và đầy thách thức, nhưng không phải ai cũng hiểu được những khía cạnh phức tạp của nó. Trong bài viết này, chúng ta sẽ tìm hiểu về cân bằng hóa học và các yếu tố ảnh hưởng đến sự dịch chuyển cân bằng hóa học.
- Nên dạy học Toán cho bé 5 tuổi như thế nào để tăng cường & phát triển tư duy?
- Sử dụng sơ đồ tư duy dạy các bài trong chương IV – Tin học lớp 11 (kiểu dữ liệu có cấu trúc)
- Cách Rèn Luyện Phát Triển Tư Duy Toán Học Logic
- Áo khoác đồng phục học sinh tiểu học
- Cách dạy trẻ 4 tuổi như thế nào để phát triển toàn diện cho con?
Contents
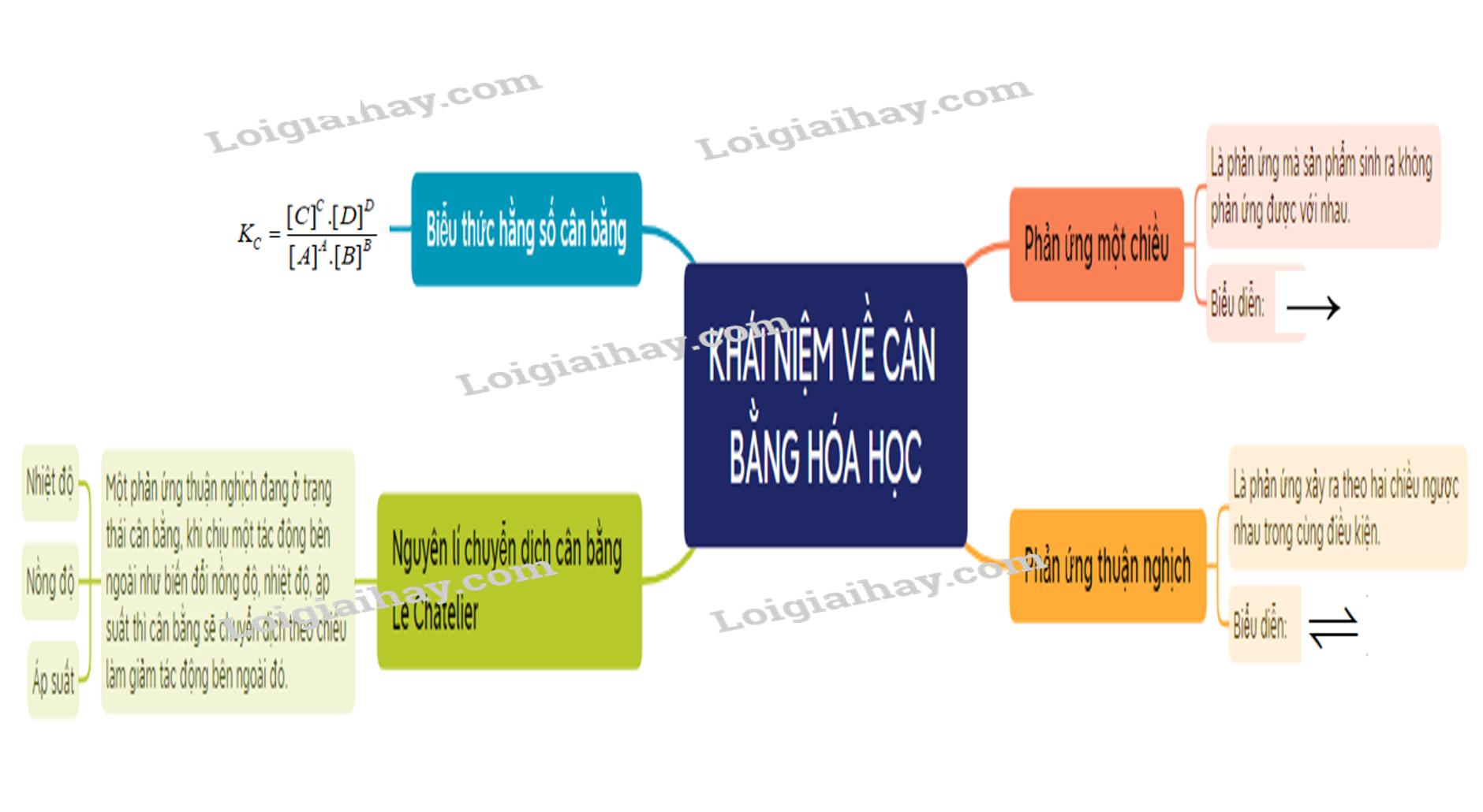
Phản ứng một chiều và phản ứng thuận nghịch
Phản ứng một chiều
Phản ứng một chiều là phản ứng mà sản phẩm sinh ra không phản ứng được với nhau để tạo thành chất đầu. Đây là một khái niệm quan trọng trong hóa học. Ví dụ của phản ứng một chiều là khi CH4 và 2O2 phản ứng với nhau để tạo thành CO2 và 2H2O.
Bạn đang xem: Lý thuyết Khái niệm về cân bằng hóa học – Hóa học 11 – Kết nối tri thức
Phản ứng thuận nghịch
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện. Để biểu diễn phản ứng thuận nghịch, ta sử dụng hai nửa mũi tên ngược chiều nhau (⇌). Ví dụ cụ thể là H2(g) + I2(g) ⇌ 2HI(g).
.png)
Cân bằng hóa học
Trạng thái cân bằng
Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Đây là một khái niệm cốt lõi trong hóa học.
Hệ số cân bằng
Xem thêm : TRƯỜNG MẦM NON KIDSGARDEN
Hệ số cân bằng là biểu thức của hằng số cân bằng. Khi xét phản ứng thuận nghịch tổng quát: aA + bB ⇌ cC + dD, ta có hằng số cân bằng (KC) được xác định bằng công thức ({K_C} = frac{{{{(C]}^C}.{{(D]}^D}}}{{{{(A]}^A}.{{(B]}^B}}}). Trong đó, (A], (B], (C], (D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng, và a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hóa học của phản ứng.
Ý nghĩa của hằng số cân bằng
Hằng số cân bằng KC phụ thuộc vào bản chất của phản ứng và nhiệt độ. KC càng lớn thì phản ứng thuận càng chiếm ưu thế và ngược lại.
Các yếu tố ảnh hưởng đến sự dịch chuyển cân bằng hóa học
Ảnh hưởng của nhiệt độ
Khi nhiệt độ tăng, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của tăng nhiệt độ và ngược lại.
Ảnh hưởng của nồng độ
Khi tăng nồng độ một chất trong phản ứng, cân bằng hóa học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
Ảnh hưởng của áp suất
Xem thêm : Khám phá những điều chưa biết về lập trình ngôn ngữ tư duy
Khi tăng áp suất chung của hệ, cân bằng chuyển dịch theo chiều làm giảm áp suất, tức là chiều làm giảm số mol khí và ngược lại.
Nguyên lí chuyển dịch cân bằng Le Chatelier
Nguyên lí chuyển dịch cân bằng Le Chatelier cho biết rằng một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài như biến đổi nồng độ, nhiệt độ, áp suất, cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Như vậy, bài viết đã giới thiệu cho các bạn khái niệm về cân bằng hóa học và các yếu tố ảnh hưởng đến sự dịch chuyển cân bằng. Hi vọng rằng thông qua bài viết này, các bạn đã hiểu rõ hơn về lý thuyết này và áp dụng được vào thực tế. Hãy tiếp tục khám phá thêm về hóa học và trở thành những chuyên gia trong lĩnh vực này nhé!
Nguồn: https://ispacedanang.edu.vn
Danh mục: Học tư duy











![[Update 2024] Con Trai Nên Học Nghề Gì Để Lập Nghiệp?](https://ispacedanang.edu.vn/wp-content/uploads/2024/05/cac-tai-le-con-trai-nen-hoc-1.jpg)