Chủ đề nguyên tử khối trung bình của brom là 79 91: Nguyên tử khối trung bình của Brom là 79.91, một giá trị quan trọng trong hóa học. Bài viết này sẽ cung cấp cho bạn kiến thức đầy đủ về cách tính toán, ứng dụng, và ý nghĩa của nguyên tử khối này trong cuộc sống hàng ngày và trong giáo dục.
Mục lục
- Nguyên Tử Khối Trung Bình của Brom là 79.91
- 1. Khái niệm về nguyên tử khối trung bình
- 2. Đồng vị của Brom
- 3. Tính toán nguyên tử khối trung bình của Brom
- 4. Ứng dụng của nguyên tử khối trung bình trong hóa học
- 5. Ý nghĩa của nguyên tử khối trung bình trong giáo dục
- 6. Các câu hỏi thường gặp về nguyên tử khối trung bình của Brom
- 7. Kết luận về nguyên tử khối trung bình của Brom
Nguyên Tử Khối Trung Bình của Brom là 79.91
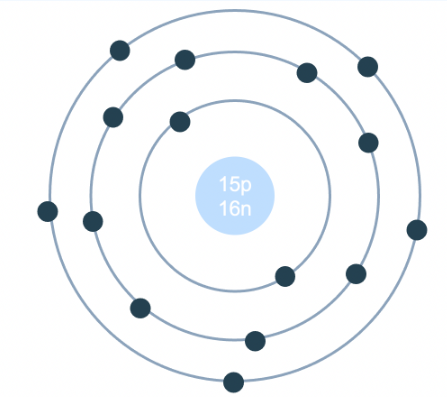
Brom là một nguyên tố hóa học có số hiệu nguyên tử là 35, ký hiệu là Br. Trong tự nhiên, Brom tồn tại dưới hai dạng đồng vị chính: \(^79Br\) và \(^81Br\). Do đó, nguyên tử khối trung bình của Brom được tính dựa trên tỷ lệ phần trăm của hai đồng vị này.
1. Các Đồng Vị của Brom
- \(^79Br\) có khối lượng xấp xỉ 78.9183 u, chiếm 50.69%.
- \(^81Br\) có khối lượng xấp xỉ 80.9163 u, chiếm 49.31%.
2. Tính Nguyên Tử Khối Trung Bình của Brom
Nguyên tử khối trung bình của Brom được tính theo công thức:
Kết quả sau khi tính toán là:
3. Ứng Dụng Của Nguyên Tử Khối Trung Bình
- Giúp xác định tính chất hóa học của Brom.
- Ứng dụng trong các phản ứng hóa học, đặc biệt là trong việc tính toán khối lượng các chất tham gia và sản phẩm.
4. Vai Trò Trong Giáo Dục
Nguyên tử khối trung bình của các nguyên tố, bao gồm cả Brom, là một phần quan trọng trong chương trình học hóa học. Việc hiểu và nắm vững cách tính toán nguyên tử khối trung bình giúp học sinh có cơ sở vững chắc để tiếp cận các kiến thức hóa học phức tạp hơn.
5. Kết Luận
Nguyên tử khối trung bình của Brom là 79.91, được xác định từ hai đồng vị chính \(^79Br\) và \(^81Br\). Đây là một giá trị quan trọng giúp hiểu rõ hơn về tính chất và ứng dụng của Brom trong các lĩnh vực khoa học và công nghiệp.
.png)
1. Khái niệm về nguyên tử khối trung bình
Nguyên tử khối trung bình là giá trị trung bình của khối lượng nguyên tử của một nguyên tố, tính dựa trên tỉ lệ phần trăm của các đồng vị của nguyên tố đó trong tự nhiên. Mỗi đồng vị của một nguyên tố có số proton giống nhau nhưng khác nhau về số neutron, dẫn đến khối lượng nguyên tử khác nhau.
Để tính toán nguyên tử khối trung bình, ta sử dụng công thức:
Ví dụ, đối với Brom, trong tự nhiên có hai đồng vị chính:
- \(^79Br\): khối lượng khoảng 78.9183 u, chiếm 50.69%
- \(^81Br\): khối lượng khoảng 80.9163 u, chiếm 49.31%
Do đó, nguyên tử khối trung bình của Brom được tính bằng:
Nguyên tử khối trung bình là một khái niệm quan trọng trong hóa học, giúp xác định các tính chất hóa học của nguyên tố và ứng dụng trong nhiều lĩnh vực như công nghiệp, nghiên cứu khoa học và giáo dục.
2. Đồng vị của Brom
Brom (Br) là nguyên tố hóa học thuộc nhóm halogen, tồn tại chủ yếu ở dạng hai đồng vị ổn định trong tự nhiên: 79Br và 81Br. Cả hai đồng vị này đều có 35 proton, nhưng khác nhau về số neutron, dẫn đến khối lượng nguyên tử khác nhau.
- Đồng vị 79Br: Đây là đồng vị phổ biến hơn, chiếm khoảng 50.69% tổng số nguyên tử Brom trong tự nhiên. Khối lượng của đồng vị này xấp xỉ 78.9183 u.
- Đồng vị 81Br: Đồng vị này chiếm khoảng 49.31% và có khối lượng xấp xỉ 80.9163 u.
Do sự khác biệt nhỏ về khối lượng và tỷ lệ phần trăm giữa hai đồng vị, nguyên tử khối trung bình của Brom được tính toán bằng công thức:
Sự tồn tại của các đồng vị khác nhau làm cho Brom có nguyên tử khối trung bình không phải là số nguyên. Điều này cũng là lý do tại sao nhiều nguyên tố khác trong bảng tuần hoàn có nguyên tử khối trung bình là số lẻ hoặc số thập phân.
Các đồng vị của Brom đóng vai trò quan trọng trong nhiều ứng dụng, bao gồm phân tích hóa học, nghiên cứu khoa học và sản xuất các hợp chất chứa Brom.

3. Tính toán nguyên tử khối trung bình của Brom
Nguyên tử khối trung bình của một nguyên tố được tính dựa trên khối lượng và tỉ lệ phần trăm của các đồng vị trong tự nhiên. Đối với Brom (Br), nguyên tử khối trung bình được tính toán bằng cách sử dụng khối lượng và tỉ lệ phần trăm của hai đồng vị chính: 79Br và 81Br.
Dưới đây là các bước chi tiết để tính toán nguyên tử khối trung bình của Brom:
-
Bước 1: Xác định khối lượng và tỉ lệ phần trăm của mỗi đồng vị:
- 79Br: Khối lượng xấp xỉ 78.9183 u, chiếm 50.69%.
- 81Br: Khối lượng xấp xỉ 80.9163 u, chiếm 49.31%.
-
Bước 2: Tính toán đóng góp của từng đồng vị vào nguyên tử khối trung bình:
- Đóng góp của 79Br: \( 78.9183 \times 0.5069 = 40.0009 \, \text{u} \)
- Đóng góp của 81Br: \( 80.9163 \times 0.4931 = 39.9091 \, \text{u} \)
-
Bước 3: Cộng các giá trị đóng góp lại để có nguyên tử khối trung bình:
\[ \text{Nguyên tử khối trung bình của Brom} = 40.0009 + 39.9091 = 79.91 \, \text{u} \]
Kết quả cuối cùng cho thấy nguyên tử khối trung bình của Brom là 79.91 u, phản ánh chính xác tỉ lệ và khối lượng của các đồng vị trong tự nhiên.

4. Ứng dụng của nguyên tử khối trung bình trong hóa học
Nguyên tử khối trung bình là một khái niệm quan trọng trong hóa học, giúp các nhà khoa học và học sinh hiểu rõ hơn về đặc tính và ứng dụng của các nguyên tố trong thực tế. Đối với Brom, nguyên tử khối trung bình có nhiều ứng dụng trong các lĩnh vực khác nhau như:
-
Tính toán lượng chất trong các phản ứng hóa học: Nguyên tử khối trung bình của Brom được sử dụng để tính toán lượng chất tham gia và sản phẩm trong các phản ứng hóa học. Điều này giúp xác định chính xác khối lượng các chất cần dùng hoặc sẽ được tạo ra trong các phản ứng.
-
Xác định công thức phân tử: Khi biết nguyên tử khối trung bình của Brom, các nhà hóa học có thể dễ dàng tính toán và xác định công thức phân tử của các hợp chất có chứa Brom, đảm bảo tính chính xác trong nghiên cứu và ứng dụng thực tế.
-
Phân tích định tính và định lượng: Trong phân tích hóa học, nguyên tử khối trung bình giúp phân biệt và xác định các đồng vị của Brom trong mẫu, từ đó đưa ra các kết luận về thành phần và tính chất của mẫu vật.
-
Sản xuất và chế tạo các hợp chất chứa Brom: Nguyên tử khối trung bình của Brom là cơ sở để tính toán và điều chỉnh trong quá trình sản xuất các hợp chất hóa học chứa Brom, đảm bảo tính đồng nhất và chất lượng sản phẩm.
Nhờ vào nguyên tử khối trung bình, các nhà hóa học có thể thực hiện các tính toán chính xác và hiểu sâu hơn về vai trò của Brom trong các phản ứng hóa học, từ đó ứng dụng vào thực tiễn một cách hiệu quả.

5. Ý nghĩa của nguyên tử khối trung bình trong giáo dục
Nguyên tử khối trung bình của Brom (Br) là 79,91, là một kiến thức cơ bản nhưng vô cùng quan trọng trong chương trình học Hóa học. Việc hiểu rõ về nguyên tử khối trung bình giúp học sinh nắm bắt tốt hơn các khái niệm liên quan đến đồng vị, tỷ lệ phần trăm của đồng vị, và các tính toán khối lượng trong hóa học.
5.1. Tầm quan trọng trong chương trình học
Nguyên tử khối trung bình là một phần quan trọng trong việc giảng dạy hóa học tại trường học. Dưới đây là một số lý do tại sao khái niệm này lại cần thiết:
- Hiểu rõ bản chất của nguyên tố: Giúp học sinh nhận biết được rằng nguyên tố không phải lúc nào cũng tồn tại dưới một dạng duy nhất, mà có thể tồn tại dưới nhiều đồng vị khác nhau.
- Cải thiện kỹ năng tính toán: Thực hành tính toán nguyên tử khối trung bình giúp học sinh rèn luyện kỹ năng toán học, đặc biệt là các phép tính liên quan đến tỷ lệ phần trăm và số học.
- Nền tảng cho các khái niệm phức tạp hơn: Nguyên tử khối trung bình là nền tảng cho nhiều khái niệm hóa học nâng cao, như phản ứng hóa học, tính toán khối lượng phân tử và công thức hóa học.
5.2. Liên hệ với các kiến thức hóa học khác
Hiểu rõ nguyên tử khối trung bình cũng giúp học sinh liên hệ các kiến thức khác trong hóa học, tạo nên một hệ thống kiến thức liên tục và logic. Một số điểm liên hệ quan trọng bao gồm:
- Cấu trúc nguyên tử: Việc hiểu nguyên tử khối trung bình giúp làm rõ hơn về cấu trúc nguyên tử, sự tồn tại của neutron và proton, cũng như sự khác biệt về khối lượng giữa các đồng vị.
- Ứng dụng trong cân bằng phương trình hóa học: Tính toán khối lượng chất tham gia và sản phẩm trong phản ứng hóa học đòi hỏi phải có kiến thức vững về nguyên tử khối trung bình.
- Hỗ trợ trong các môn học liên quan: Kiến thức này cũng được sử dụng rộng rãi trong các môn học khác như Sinh học và Vật lý, đặc biệt là khi nghiên cứu về các chất phóng xạ và đồng vị.
Tóm lại, việc học về nguyên tử khối trung bình không chỉ giúp học sinh nắm vững kiến thức hóa học cơ bản mà còn là bước đệm quan trọng để tiến xa hơn trong nghiên cứu khoa học và các lĩnh vực liên quan.
XEM THÊM:
6. Các câu hỏi thường gặp về nguyên tử khối trung bình của Brom
-
Nguyên tử khối trung bình của Brom là gì?
Nguyên tử khối trung bình của Brom là \(79,91\). Brom trong tự nhiên tồn tại dưới dạng hai đồng vị chính: 79Br và 81Br. Giá trị nguyên tử khối trung bình này được tính dựa trên tỉ lệ phần trăm của mỗi đồng vị trong tự nhiên.
-
Làm thế nào để tính nguyên tử khối trung bình của Brom?
Nguyên tử khối trung bình của Brom được tính bằng công thức:
\[ \overline{A_{Br}} = \frac{{79 \times x + 81 \times (100\% - x)}}{100\%} \]Trong đó, \(x\) là phần trăm số nguyên tử của đồng vị 79Br. Kết quả tính toán sẽ ra nguyên tử khối trung bình của Brom là \(79,91\).
-
Phần trăm các đồng vị của Brom trong tự nhiên là bao nhiêu?
Theo các tính toán, đồng vị 79Br chiếm khoảng \(54,5\%\) và đồng vị 81Br chiếm \(45,5\%\) số nguyên tử trong tự nhiên.
-
Đồng vị nào của Brom có số nguyên tử nhiều hơn trong tự nhiên?
Đồng vị 79Br có số nguyên tử nhiều hơn so với đồng vị 81Br trong tự nhiên, với tỷ lệ khoảng \(54,5\%\) so với \(45,5\%\).
-
Tại sao nguyên tử khối trung bình của Brom không phải là số nguyên?
Nguyên tử khối trung bình của Brom không phải là số nguyên do Brom tồn tại dưới dạng hỗn hợp của hai đồng vị có nguyên tử khối khác nhau (79Br và 81Br). Sự kết hợp này tạo ra một giá trị trung bình không nguyên.
-
Ứng dụng của các đồng vị Brom là gì?
Các đồng vị của Brom được sử dụng trong nghiên cứu khoa học và y học. Ví dụ, đồng vị phóng xạ của Brom có thể được dùng trong chụp ảnh y học và các nghiên cứu liên quan đến động học của các phản ứng hóa học.
-
Nguyên tử khối trung bình của Brom có liên quan gì đến các hợp chất hóa học của Brom?
Nguyên tử khối trung bình của Brom giúp xác định khối lượng phân tử của các hợp chất chứa Brom. Ví dụ, trong hợp chất KBrO3, việc tính toán phần trăm khối lượng của mỗi đồng vị Brom giúp xác định đặc tính của hợp chất đó.

7. Kết luận về nguyên tử khối trung bình của Brom
Nguyên tử khối trung bình của Brom (Br) là một con số quan trọng giúp chúng ta hiểu rõ hơn về đặc tính hóa học của nguyên tố này. Dựa trên các nghiên cứu và dữ liệu thực nghiệm, chúng ta có thể kết luận rằng nguyên tử khối trung bình của Brom là 79,91. Điều này xuất phát từ sự tồn tại của hai đồng vị của Brom, là 79Br và 81Br.
Trong đó, đồng vị 79Br chiếm khoảng 54,5% tổng số lượng Brom trong tự nhiên, còn lại là đồng vị 81Br chiếm 45,5%. Tỉ lệ phần trăm này cho thấy sự phân bố không đều của các đồng vị, góp phần vào giá trị nguyên tử khối trung bình là 79,91. Công thức tính toán nguyên tử khối trung bình của Brom có thể được thể hiện như sau:
Giá trị này có ý nghĩa lớn trong hóa học, đặc biệt là trong các tính toán liên quan đến khối lượng phân tử, nồng độ, và trong các phản ứng hóa học. Nó cung cấp cho chúng ta một cái nhìn sâu sắc về tính chất và hành vi của Brom khi tham gia vào các phản ứng hóa học.
Việc hiểu rõ nguyên tử khối trung bình của Brom không chỉ giúp ích trong các ứng dụng lý thuyết mà còn hỗ trợ rất nhiều trong các lĩnh vực thực tiễn như hóa học công nghiệp, y học và nghiên cứu khoa học. Do đó, việc xác định chính xác nguyên tử khối trung bình của Brom là rất quan trọng và cần thiết cho cả các nhà khoa học và sinh viên trong quá trình học tập và nghiên cứu.








.png)










