Chủ đề obitan nguyên tử: Obitan nguyên tử là khái niệm quan trọng trong hóa học hiện đại, giúp chúng ta hiểu rõ hơn về cấu trúc và tính chất của nguyên tử. Bài viết này sẽ cung cấp cái nhìn tổng quan về obitan, các loại obitan khác nhau và cách chúng ảnh hưởng đến liên kết hóa học cũng như các ứng dụng thực tiễn trong đời sống.
Mục lục
- Obitan Nguyên Tử Là Gì?
- 1. Khái Niệm Obitan Nguyên Tử
- 2. Phân Loại Obitan Nguyên Tử
- 3. Các Số Lượng Tử Liên Quan Đến Obitan
- 4. Cấu Hình Electron và Quy Tắc Hund
- 5. Obitan và Liên Kết Hóa Học
- 6. Ứng Dụng Thực Tiễn Của Obitan Nguyên Tử
- 7. Các Phương Pháp Nghiên Cứu Obitan Nguyên Tử
- 8. Những Khám Phá Mới Liên Quan Đến Obitan Nguyên Tử
- 9. Tài Liệu Tham Khảo và Nghiên Cứu Thêm
Obitan Nguyên Tử Là Gì?
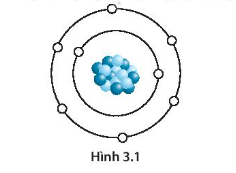
Obitan nguyên tử là khái niệm quan trọng trong hóa học lượng tử và vật lý nguyên tử, liên quan đến vị trí và hành vi của các electron xung quanh hạt nhân của một nguyên tử. Khái niệm này giúp mô tả cách mà các electron được sắp xếp và tương tác trong một nguyên tử, từ đó quyết định tính chất hóa học của nguyên tố.
Cấu Trúc và Phân Loại Obitan
Các obitan được sắp xếp theo các mức năng lượng và phân loại theo dạng hình học:
- Obitan s: Có hình cầu và chứa tối đa 2 electron. Ký hiệu là \(1s, 2s, 3s, \ldots\).
- Obitan p: Có hình dáng hai giọt nước nối nhau, chứa tối đa 6 electron. Ký hiệu là \(2p, 3p, 4p, \ldots\).
- Obitan d: Có hình dáng phức tạp hơn, chứa tối đa 10 electron. Ký hiệu là \(3d, 4d, 5d, \ldots\).
- Obitan f: Cấu trúc phức tạp nhất, chứa tối đa 14 electron. Ký hiệu là \(4f, 5f, 6f, \ldots\).
Cách Xác Định Obitan Nguyên Tử
Để xác định các obitan trong một nguyên tử, người ta thường dựa vào số lượng tử chính (\(n\)) và số lượng tử phụ (\(l\)). Các số này xác định mức năng lượng và hình dạng của obitan:
- Số lượng tử chính (\(n\)): Quyết định mức năng lượng của obitan.
- Số lượng tử phụ (\(l\)): Quyết định hình dạng của obitan, với các giá trị \(l = 0, 1, 2, 3\) tương ứng với các obitan s, p, d, f.
Vai Trò Của Obitan Trong Phản Ứng Hóa Học
Obitan nguyên tử đóng vai trò quan trọng trong việc hình thành liên kết hóa học và xác định tính chất của các phản ứng hóa học. Khi các obitan tương tác với nhau, chúng tạo ra liên kết hóa học giữa các nguyên tử. Dưới đây là các dạng liên kết phổ biến:
- Liên kết cộng hóa trị: Hình thành khi các electron trong obitan ngoài cùng được chia sẻ giữa các nguyên tử.
- Liên kết ion: Hình thành khi electron được chuyển từ một nguyên tử sang nguyên tử khác, tạo ra các ion dương và âm.
Sự Phân Bố Electron và Quy Tắc Hund
Sự phân bố electron trong các obitan tuân theo quy tắc Hund, quy định rằng các electron sẽ điền vào các obitan sao cho số electron độc thân là tối đa trước khi ghép cặp:
\[ \text{1s}^2 \text{ 2s}^2 \text{ 2p}^6 \ldots \]
Ví dụ, trong nguyên tử carbon (\(C\)) có 6 electron, sự phân bố sẽ là: \(\text{1s}^2 \text{ 2s}^2 \text{ 2p}^2\), với hai electron cuối cùng nằm trong hai obitan p khác nhau.
Kết Luận
Hiểu rõ về obitan nguyên tử là cơ sở để nắm vững các khái niệm về liên kết hóa học, cấu trúc phân tử, và tính chất của các chất. Điều này giúp chúng ta không chỉ giải thích được các hiện tượng tự nhiên mà còn ứng dụng trong việc phát triển các vật liệu và công nghệ mới.

.png)
1. Khái Niệm Obitan Nguyên Tử
Obitan nguyên tử là một khái niệm quan trọng trong hóa học và vật lý lượng tử, dùng để mô tả vùng không gian xung quanh hạt nhân nguyên tử nơi khả năng tìm thấy electron là cao nhất. Theo lý thuyết cơ học lượng tử, obitan nguyên tử không chỉ là một quỹ đạo cụ thể mà còn là một hàm sóng miêu tả xác suất tồn tại của electron trong các vùng khác nhau quanh hạt nhân.
Các obitan được xác định bởi một tập hợp các số lượng tử, bao gồm:
- Số lượng tử chính \((n)\): Xác định mức năng lượng của obitan, đồng thời xác định kích thước của nó. Các giá trị của \(n\) là các số nguyên dương \( (n = 1, 2, 3, \ldots) \).
- Số lượng tử phụ \((l)\): Xác định hình dạng của obitan, với các giá trị từ \(0\) đến \(n-1\). Các obitan được ký hiệu theo các giá trị của \(l\), như \(s\), \(p\), \(d\), \(f\).
- Số lượng tử từ \((m)\): Xác định định hướng của obitan trong không gian, với các giá trị từ \(-l\) đến \(+l\).
- Số lượng tử spin \((s)\): Xác định trạng thái spin của electron, với các giá trị là \(-\frac{1}{2}\) hoặc \(+\frac{1}{2}\).
Khái niệm obitan giúp giải thích cấu hình electron của nguyên tử và cách các electron tương tác với nhau, từ đó quyết định tính chất hóa học và vật lý của nguyên tố. Các obitan cơ bản như \(s\), \(p\), \(d\), \(f\) có các hình dạng và khả năng chứa electron khác nhau, đóng vai trò quan trọng trong việc hình thành liên kết hóa học và xác định đặc điểm của các nguyên tử và phân tử.
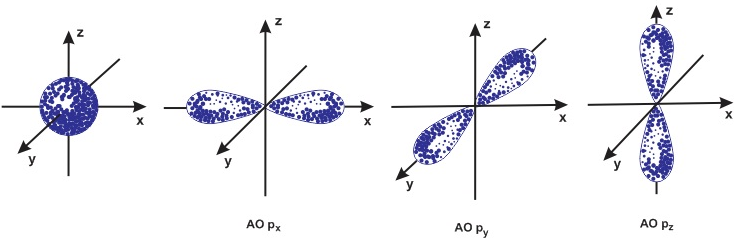
Ví dụ, obitan \(s\) có hình cầu, có thể chứa tối đa 2 electron, trong khi obitan \(p\) có hình dạng giống như quả tạ, có ba hướng khác nhau (\(p_x\), \(p_y\), \(p_z\)) và có thể chứa tổng cộng 6 electron.
2. Phân Loại Obitan Nguyên Tử
Obitan nguyên tử có thể được phân loại dựa trên các số lượng tử chính và số lượng tử phụ. Dưới đây là các loại obitan nguyên tử phổ biến nhất, mỗi loại có một hình dạng và đặc tính riêng, ảnh hưởng đến cách mà chúng tương tác và liên kết với nhau.
- Obitan \(s\): Đây là loại obitan đơn giản nhất, có hình dạng cầu và có khả năng chứa tối đa 2 electron. Mỗi mức năng lượng đều có một obitan \(s\), được đánh số từ \(1s\), \(2s\), \(3s\), v.v. Obitan \(s\) thường có mặt trong các nguyên tử đơn giản và các electron trong obitan này thường có năng lượng thấp nhất.
- Obitan \(p\): Loại obitan này có hình dạng giống như quả tạ và có ba hướng khác nhau trong không gian: \(p_x\), \(p_y\), và \(p_z\). Mỗi hướng có khả năng chứa tối đa 2 electron, do đó tổng cộng có thể chứa 6 electron trong các obitan \(p\) ở cùng một mức năng lượng. Các obitan \(p\) bắt đầu xuất hiện từ mức năng lượng thứ hai (\(n=2\)).
- Obitan \(d\): Obitan \(d\) có hình dạng phức tạp hơn, thường có dạng như cánh hoa hoặc hình số tám. Chúng có năm hướng khác nhau, do đó tổng cộng có thể chứa 10 electron. Obitan \(d\) bắt đầu xuất hiện từ mức năng lượng thứ ba (\(n=3\)) và đóng vai trò quan trọng trong cấu trúc của các kim loại chuyển tiếp.
- Obitan \(f\): Đây là loại obitan phức tạp nhất trong số các obitan nguyên tử phổ biến, có bảy hướng khác nhau và có thể chứa tối đa 14 electron. Các obitan \(f\) xuất hiện từ mức năng lượng thứ tư (\(n=4\)) trở lên, đóng vai trò quan trọng trong các nguyên tố đất hiếm và các nguyên tố lanthanide và actinide.
Việc hiểu rõ phân loại các obitan nguyên tử là cơ sở quan trọng để nắm bắt cách cấu hình electron ảnh hưởng đến tính chất hóa học và vật lý của nguyên tố. Mỗi loại obitan đóng góp một vai trò riêng biệt trong cấu trúc nguyên tử và liên kết hóa học, quyết định tính chất đặc trưng của các nguyên tố và phân tử.
Ví dụ, sự phân bố electron trong các obitan \(s\) và \(p\) quyết định cấu trúc của các hợp chất hữu cơ, trong khi các electron trong obitan \(d\) đóng vai trò quan trọng trong sự màu sắc và tính dẫn điện của các kim loại chuyển tiếp.

3. Các Số Lượng Tử Liên Quan Đến Obitan
Trong hóa học lượng tử, các obitan nguyên tử được xác định bởi một loạt các số lượng tử. Mỗi số lượng tử này đóng vai trò quan trọng trong việc mô tả kích thước, hình dạng, và hướng của obitan trong không gian. Dưới đây là các số lượng tử chính liên quan đến obitan:
- Số lượng tử chính (\(n\)): Số lượng tử này xác định mức năng lượng chính của obitan và khoảng cách trung bình của obitan so với hạt nhân. Giá trị của \(n\) là một số nguyên dương (\(n = 1, 2, 3, \ldots\)). Ví dụ, các obitan \(1s\), \(2s\), \(2p\) tương ứng với các giá trị \(n = 1\) và \(n = 2\). Khi giá trị \(n\) tăng, kích thước của obitan cũng tăng.
- Số lượng tử phụ (\(l\)): Số lượng tử phụ, còn được gọi là số lượng tử quỹ đạo, xác định hình dạng của obitan. Giá trị của \(l\) dao động từ \(0\) đến \((n-1)\). Mỗi giá trị \(l\) tương ứng với một loại obitan khác nhau:
- \(l = 0\): Obitan \(s\) (hình cầu)
- \(l = 1\): Obitan \(p\) (hình quả tạ)
- \(l = 2\): Obitan \(d\) (hình cánh hoa)
- \(l = 3\): Obitan \(f\) (hình phức tạp)
- Số lượng tử từ (\(m_l\)): Số lượng tử từ xác định hướng của obitan trong không gian. Giá trị của \(m_l\) thay đổi từ \(-l\) đến \(+l\). Ví dụ, nếu \(l = 1\) (obitan \(p\)), thì \(m_l\) có thể là \(-1, 0, +1\), tương ứng với ba hướng khác nhau (\(p_x\), \(p_y\), \(p_z\)).
- Số lượng tử spin (\(m_s\)): Số lượng tử này xác định hướng của spin của electron trong obitan. Giá trị của \(m_s\) có thể là \(+\frac{1}{2}\) hoặc \(-\frac{1}{2}\), biểu thị hai trạng thái spin đối ngược. Mỗi obitan có thể chứa tối đa hai electron, với mỗi electron có một giá trị spin khác nhau.
Sự kết hợp của các số lượng tử này giúp xác định chính xác trạng thái năng lượng của các electron trong nguyên tử, từ đó quyết định cấu hình electron và tính chất hóa học của nguyên tố. Việc hiểu rõ về các số lượng tử này là cơ sở quan trọng trong việc nghiên cứu hóa học lượng tử và cơ học lượng tử.
XEM THÊM:
4. Cấu Hình Electron và Quy Tắc Hund
Cấu hình electron của một nguyên tử mô tả sự phân bố của các electron trong các obitan khác nhau, dựa trên mức năng lượng. Để xây dựng cấu hình electron, chúng ta cần tuân thủ các nguyên tắc cơ bản, bao gồm nguyên tắc Pauli, quy tắc Hund, và nguyên lý xây dựng (Aufbau).
Dưới đây là các bước chi tiết để xác định cấu hình electron cho một nguyên tử:
- Nguyên tắc Pauli: Mỗi obitan có thể chứa tối đa hai electron, và hai electron này phải có spin ngược chiều nhau (\(m_s = +\frac{1}{2}\) và \(m_s = -\frac{1}{2}\)).
- Quy tắc Hund: Khi điền electron vào các obitan có cùng mức năng lượng (còn gọi là các obitan suy biến), các electron sẽ được điền vào từng obitan một trước, tất cả đều cùng chiều spin, sau đó mới ghép đôi. Điều này giúp giảm tối đa tương tác đẩy giữa các electron và tạo ra cấu hình bền vững hơn. Ví dụ, đối với obitan \(p\) với ba dạng (\(p_x\), \(p_y\), \(p_z\)), electron sẽ được điền như sau:
- \(1p_x\), \(1p_y\), \(1p_z\): Mỗi obitan chứa một electron, tất cả cùng chiều spin.
- Sau khi mỗi obitan có một electron, electron thứ tư mới bắt đầu ghép đôi.
- Nguyên lý Aufbau: Electron sẽ được điền vào các obitan theo thứ tự tăng dần của mức năng lượng, bắt đầu từ obitan có mức năng lượng thấp nhất. Thứ tự điền electron có thể được xác định bằng cách sử dụng sơ đồ của nguyên tắc n + l (trong đó \(n\) là số lượng tử chính và \(l\) là số lượng tử phụ). Ví dụ:
- Obitan \(1s\) điền trước vì có mức năng lượng thấp nhất.
- Tiếp theo là \(2s\), \(2p\), \(3s\), \(3p\), \(4s\), \(3d\), và v.v.
Ví dụ, cấu hình electron của nguyên tử carbon (C) với số hiệu nguyên tử là 6 có thể được viết như sau:
- \(1s^2\): 2 electron trong obitan \(1s\).
- \(2s^2\): 2 electron trong obitan \(2s\).
- \(2p^2\): 2 electron còn lại được phân bố vào hai obitan \(2p\), tuân theo quy tắc Hund.
Cấu hình electron của carbon sẽ là \(1s^2 2s^2 2p^2\). Việc hiểu rõ cấu hình electron và quy tắc Hund là rất quan trọng trong việc phân tích tính chất hóa học của nguyên tố và dự đoán khả năng phản ứng của chúng.

5. Obitan và Liên Kết Hóa Học
Obitan đóng vai trò quan trọng trong việc hình thành liên kết hóa học, vì chúng là nơi mà các electron cư trú. Liên kết hóa học xảy ra khi obitan của các nguyên tử tương tác và chia sẻ electron, tạo ra một cấu trúc ổn định hơn cho cả hai nguyên tử.
Dưới đây là các bước cơ bản mô tả cách thức obitan tham gia vào quá trình hình thành liên kết hóa học:
- Quá trình chồng chập obitan: Khi hai nguyên tử tiến gần nhau, obitan của chúng có thể chồng chập lên nhau. Mức độ chồng chập càng lớn thì liên kết càng mạnh. Điều này tạo ra các obitan phân tử mới, có thể là obitan liên kết hoặc obitan phản liên kết.
- Liên kết \(\sigma\) và liên kết \(\pi\): Các obitan có thể tạo ra liên kết \(\sigma\) khi sự chồng chập xảy ra dọc theo trục nối hai hạt nhân, ví dụ như trong liên kết đơn. Liên kết \(\pi\) hình thành khi sự chồng chập xảy ra bên ngoài trục nối hai hạt nhân, thường xuất hiện trong liên kết đôi hoặc ba.
- Liên kết cộng hóa trị: Đây là loại liên kết phổ biến nhất, xảy ra khi hai nguyên tử chia sẻ một hoặc nhiều cặp electron. Cặp electron này thường đến từ các obitan s hoặc p. Ví dụ, trong phân tử H2 (hydro), mỗi nguyên tử hydro chia sẻ electron từ obitan \(1s\) của mình để tạo ra một liên kết cộng hóa trị đơn.
- Liên kết ion: Trong trường hợp sự chênh lệch độ âm điện giữa hai nguyên tử lớn, một nguyên tử có thể hoàn toàn nhận electron từ nguyên tử kia, dẫn đến sự hình thành ion. Các ion này sau đó sẽ tương tác qua lực hút tĩnh điện để hình thành liên kết ion. Tuy nhiên, vai trò của obitan trong liên kết ion không rõ ràng như trong liên kết cộng hóa trị.
Dưới đây là một bảng tổng quan về các loại liên kết và obitan tham gia:
| Loại Liên Kết | Obitan Tham Gia | Ví Dụ |
| Liên kết \(\sigma\) | Obitan s và p | H2, CH4 |
| Liên kết \(\pi\) | Obitan p | O2, C2H4 |
| Liên kết ion | Obitan s và p (đóng vai trò trong sự chuyển electron) | NaCl, CaF2 |
Hiểu rõ về cách obitan và liên kết hóa học tương tác với nhau là cơ sở để phân tích và dự đoán cấu trúc phân tử, tính chất hóa học, và phản ứng của các chất trong hóa học hiện đại.
6. Ứng Dụng Thực Tiễn Của Obitan Nguyên Tử
Obitan nguyên tử không chỉ là khái niệm lý thuyết trong hóa học, mà còn có nhiều ứng dụng thực tiễn trong khoa học và công nghệ. Hiểu biết về obitan giúp con người giải thích và dự đoán tính chất hóa học của các nguyên tố, đồng thời thúc đẩy phát triển các công nghệ mới.
Dưới đây là một số ứng dụng quan trọng của obitan nguyên tử trong đời sống:
- Phân tích phổ học: Obitan đóng vai trò quan trọng trong việc hiểu các phổ hấp thụ và phát xạ của nguyên tử. Khi electron chuyển động giữa các obitan, chúng phát ra hoặc hấp thụ năng lượng dưới dạng ánh sáng, tạo ra các phổ vạch đặc trưng cho từng nguyên tố. Điều này được ứng dụng trong các kỹ thuật phân tích hóa học và vật lý, chẳng hạn như quang phổ học.
- Thiết kế dược phẩm: Hiểu rõ cấu trúc obitan của các nguyên tử trong phân tử giúp các nhà khoa học dự đoán cách thức tương tác giữa thuốc và các mục tiêu sinh học. Điều này đặc biệt quan trọng trong việc phát triển các loại thuốc mới, giúp tăng hiệu quả điều trị và giảm thiểu tác dụng phụ.
- Công nghệ bán dẫn: Trong ngành điện tử, kiến thức về obitan và các trạng thái electron đóng vai trò quan trọng trong thiết kế và tối ưu hóa các vật liệu bán dẫn. Các thiết bị như transistor và diode dựa trên các nguyên tắc về obitan và sự di chuyển của electron qua các lớp năng lượng.
- Phát triển vật liệu mới: Obitan cung cấp thông tin quan trọng để dự đoán và thiết kế cấu trúc của các hợp chất và vật liệu mới. Các kỹ thuật mô phỏng dựa trên cơ học lượng tử sử dụng obitan để dự đoán tính chất cơ học, điện và nhiệt của vật liệu.
Để minh họa chi tiết, bảng dưới đây liệt kê một số ứng dụng cụ thể của obitan trong các lĩnh vực khác nhau:
| Lĩnh Vực | Ứng Dụng Cụ Thể | Mô Tả |
| Hóa học phân tích | Quang phổ học | Phân tích thành phần hóa học của mẫu dựa trên phổ vạch đặc trưng. |
| Dược phẩm | Thiết kế thuốc | Dự đoán và tối ưu hóa tương tác giữa thuốc và protein mục tiêu. |
| Điện tử | Chế tạo bán dẫn | Tối ưu hóa tính chất điện của vật liệu bán dẫn trong thiết bị điện tử. |
| Vật liệu học | Phát triển vật liệu mới | Thiết kế cấu trúc và tính chất của vật liệu dựa trên các mô hình obitan. |
Những ứng dụng này cho thấy tầm quan trọng của việc hiểu biết sâu về obitan nguyên tử, không chỉ trong nghiên cứu khoa học cơ bản mà còn trong ứng dụng công nghiệp và y học.

7. Các Phương Pháp Nghiên Cứu Obitan Nguyên Tử
Trong hóa học hiện đại, việc nghiên cứu obitan nguyên tử là một lĩnh vực quan trọng, đóng vai trò cốt yếu trong việc hiểu rõ cấu trúc và tính chất của nguyên tử. Có nhiều phương pháp khác nhau được sử dụng để nghiên cứu obitan nguyên tử, từ các phương pháp thực nghiệm đến các kỹ thuật mô hình hóa và tính toán. Dưới đây là một số phương pháp nghiên cứu chính:
7.1. Phương Pháp Thực Nghiệm
Phương pháp thực nghiệm thường liên quan đến việc sử dụng các công cụ khoa học để quan sát và đo lường trực tiếp các đặc tính của obitan nguyên tử. Một số kỹ thuật phổ biến bao gồm:
- Phổ hồng ngoại (IR): Kỹ thuật này cho phép xác định các dao động của liên kết hóa học trong phân tử, từ đó suy ra cấu trúc của các obitan.
- Phổ tử ngoại - khả kiến (UV-Vis): Kỹ thuật này được sử dụng để đo lường sự hấp thụ ánh sáng của các phân tử, giúp xác định mức năng lượng của các obitan.
- Phổ cộng hưởng từ hạt nhân (NMR): Đây là phương pháp quan trọng để nghiên cứu cấu trúc hóa học và các obitan trong nguyên tử thông qua tương tác giữa hạt nhân nguyên tử và từ trường.
7.2. Mô Hình Hóa và Tính Toán
Phương pháp mô hình hóa và tính toán đóng vai trò quan trọng trong việc nghiên cứu obitan nguyên tử, đặc biệt là khi các phương pháp thực nghiệm gặp giới hạn. Một số kỹ thuật mô hình hóa chính bao gồm:
- Phương pháp lượng tử: Sử dụng các phương trình lượng tử như phương trình Schrödinger để tính toán các obitan và mức năng lượng của nguyên tử.
- Phương pháp mô phỏng động lực học phân tử (Molecular Dynamics): Giúp mô phỏng sự tương tác giữa các nguyên tử và obitan trong một hệ thống lớn, cho phép nghiên cứu các quá trình hóa học ở cấp độ nguyên tử.
- Phương pháp lý thuyết phiếm hàm mật độ (DFT): Được sử dụng rộng rãi để tính toán các đặc tính điện tử của nguyên tử và phân tử, dựa trên mật độ electron hơn là hàm sóng.
7.3. Kỹ Thuật Chụp Hình Ảnh Obitan
Việc chụp hình ảnh trực tiếp các obitan nguyên tử là một thách thức lớn trong khoa học. Tuy nhiên, với sự phát triển của công nghệ, một số kỹ thuật tiên tiến đã ra đời để chụp ảnh các obitan:
- Kính hiển vi điện tử quét xuyên hầm (STM): Kỹ thuật này cho phép quan sát trực tiếp các obitan bề mặt của nguyên tử thông qua dòng điện tử quét qua một đầu dò siêu nhỏ.
- Kỹ thuật hiển vi lực nguyên tử (AFM): Giúp đo lường lực tương tác giữa các nguyên tử, từ đó tái hiện hình ảnh của các obitan với độ phân giải cao.
- Chụp cắt lớp quang học (Optical Tomography): Một kỹ thuật mới, cho phép quan sát các obitan trong không gian ba chiều bằng cách sử dụng ánh sáng laser.

8. Những Khám Phá Mới Liên Quan Đến Obitan Nguyên Tử
Những khám phá mới liên quan đến obitan nguyên tử đã mở ra những góc nhìn sâu sắc hơn về cấu trúc nguyên tử và cách thức các electron tương tác trong nguyên tử. Dưới đây là một số điểm nổi bật từ các nghiên cứu gần đây:
- Lai hóa obitan: Khái niệm lai hóa obitan nguyên tử đã được mở rộng để giải thích sự tổ hợp và định hướng mới của các obitan trong không gian. Điều này giúp hiểu rõ hơn về sự hình thành liên kết đơn, liên kết đôi, và liên kết ba giữa các nguyên tử.
- Sự thay đổi cấu trúc năng lượng: Các nghiên cứu đã chỉ ra rằng năng lượng của các obitan không cố định mà có thể thay đổi phụ thuộc vào môi trường xung quanh nguyên tử. Sự thay đổi này ảnh hưởng đến cách thức liên kết và phản ứng hóa học của nguyên tử.
- Khám phá về obitan d và f: Nghiên cứu mới đã làm rõ hơn vai trò của các obitan d và f trong việc tạo liên kết và hình thành cấu trúc phức tạp của các hợp chất. Điều này đặc biệt quan trọng trong việc phát triển các vật liệu mới và nghiên cứu các hợp chất kim loại chuyển tiếp.
- Ứng dụng của lý thuyết obitan: Lý thuyết về obitan nguyên tử đang được áp dụng rộng rãi trong nhiều lĩnh vực khác nhau, từ hóa học lượng tử đến vật liệu học. Sự phát triển của các phương pháp tính toán hiện đại đã cho phép mô phỏng chính xác hơn cấu trúc và năng lượng của các obitan, giúp dự đoán và thiết kế các vật liệu với tính chất đặc biệt.
Những khám phá này không chỉ giúp chúng ta hiểu rõ hơn về bản chất của nguyên tử mà còn mở ra những hướng đi mới trong nghiên cứu và ứng dụng khoa học.
9. Tài Liệu Tham Khảo và Nghiên Cứu Thêm
Để hiểu rõ hơn về khái niệm và ứng dụng của obitan nguyên tử, cũng như các lý thuyết liên quan đến cấu trúc nguyên tử và phân tử, dưới đây là một số tài liệu và nguồn tham khảo hữu ích:
- Thuyết Obitan Phân Tử (MO): Tài liệu này cung cấp kiến thức cơ bản về lý thuyết obitan phân tử, bao gồm cách hình thành các liên kết cộng hóa trị dựa trên sự tổ hợp các obitan nguyên tử. Bạn có thể tìm hiểu chi tiết về các obitan liên kết, phản liên kết, và cách phân bố electron trong các obitan này. Thông tin chi tiết có thể tìm thấy trong tài liệu học tập của Khoa Khoa học Tự nhiên, Đại học Duy Tân.
- Khái Niệm Obitan Nguyên Tử: Một số khái niệm cơ bản như định nghĩa obitan nguyên tử là vùng không gian quanh hạt nhân nơi xác suất hiện diện của electron là cao nhất. Ngoài ra, tài liệu còn giải thích về sự phân bố electron trong các phân lớp và nguyên lý Hund trong việc sắp xếp electron. Nguồn tài liệu này có thể tham khảo từ các diễn đàn học tập như HOCMAI và các tài liệu hóa học lớp 10.
- Ứng Dụng Lý Thuyết Obitan: Thuyết VB và MO là hai lý thuyết chính trong hóa học phân tử, mỗi thuyết có ưu nhược điểm riêng. Bài viết trên các trang học tập trực tuyến cung cấp một so sánh sâu sắc giữa hai thuyết này, đặc biệt là cách chúng giải thích cấu trúc và tính chất của các phân tử phức tạp.
Những tài liệu trên sẽ cung cấp nền tảng vững chắc cho việc nghiên cứu sâu hơn về cấu trúc nguyên tử và liên kết hóa học, giúp bạn nắm bắt được các khái niệm quan trọng và ứng dụng trong thực tiễn.