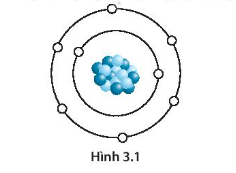
Chủ đề một nguyên tố mà nguyên tử có 4 lớp electron: Bài viết này sẽ giúp bạn hiểu rõ hơn về nguyên tố có 4 lớp electron trong nguyên tử, khám phá cấu trúc phân lớp electron và tính chất hóa học đặc trưng. Hãy cùng tìm hiểu cách mà các lớp electron ảnh hưởng đến hành vi hóa học và ứng dụng của các nguyên tố này trong cuộc sống.
Mục lục
- Thông tin về nguyên tố có 4 lớp electron trong cấu trúc nguyên tử
- Tổng quan về nguyên tố có 4 lớp electron
- Cấu trúc lớp vỏ electron của nguyên tử
- Đặc điểm hóa học của nguyên tố với 4 lớp electron
- Ví dụ về các nguyên tố cụ thể có 4 lớp electron
- Các bài tập và câu hỏi trắc nghiệm liên quan
- Kết luận về vai trò của nguyên tố có 4 lớp electron
Thông tin về nguyên tố có 4 lớp electron trong cấu trúc nguyên tử
Khi tìm kiếm từ khóa "một nguyên tố mà nguyên tử có 4 lớp electron", kết quả trả về chủ yếu là các bài viết liên quan đến kiến thức Hóa học phổ thông, đặc biệt là về cấu hình electron của các nguyên tố trong bảng tuần hoàn. Dưới đây là thông tin chi tiết:
1. Cấu hình electron của nguyên tố có 4 lớp electron
Một nguyên tố có 4 lớp electron đồng nghĩa với việc nguyên tử của nguyên tố này có electron phân bố trên 4 mức năng lượng khác nhau, cụ thể là từ lớp K đến lớp N.
Cấu hình electron tổng quát cho một nguyên tố có 4 lớp electron thường có dạng:
\[
1s^2 2s^2 2p^6 3s^2 3p^6 3d^x 4s^2
\]
Trong đó, số electron ở phân lớp 3d và 4s sẽ quyết định tính chất hóa học của nguyên tố.
2. Các đặc điểm của nguyên tố với cấu trúc 4 lớp electron
- Nguyên tố này thuộc về nhóm kim loại chuyển tiếp nếu có electron ở phân lớp d.
- Lớp electron ngoài cùng đã bão hòa, cho thấy nguyên tố này thường có tính chất hóa học ổn định hơn.
3. Ví dụ cụ thể về nguyên tố có 4 lớp electron
Một ví dụ điển hình là nguyên tố Kẽm (Zn) với cấu hình electron:
\[
[Ar] 3d^{10} 4s^2
\]
Nguyên tố Kẽm có đầy đủ 4 lớp electron, với lớp ngoài cùng đã bão hòa electron, thuộc nhóm d trong bảng tuần hoàn, và thường được sử dụng rộng rãi trong các hợp kim và trong công nghiệp.
4. Ứng dụng thực tế
Nguyên tố có 4 lớp electron, đặc biệt là các nguyên tố kim loại chuyển tiếp, đóng vai trò quan trọng trong công nghiệp và đời sống. Chúng được sử dụng trong sản xuất hợp kim, làm chất xúc tác trong các phản ứng hóa học, và có mặt trong nhiều ứng dụng công nghệ cao.
Hy vọng rằng thông tin trên đã giúp bạn hiểu rõ hơn về các nguyên tố có 4 lớp electron và vai trò của chúng trong hóa học cũng như trong các ứng dụng thực tế.

.png)
Tổng quan về nguyên tố có 4 lớp electron
Một nguyên tố có 4 lớp electron trong nguyên tử thường thuộc về các nguyên tố nằm ở chu kỳ thứ 4 của bảng tuần hoàn. Các lớp electron này, ký hiệu là K, L, M, N, lần lượt tương ứng với các mức năng lượng tăng dần. Lớp ngoài cùng là lớp N, nơi chứa các electron có mức năng lượng cao nhất.
Nguyên tử của các nguyên tố có 4 lớp electron thường có cấu hình electron tổng quát là:
\[
1s^2 2s^2 2p^6 3s^2 3p^6 3d^x 4s^2
\]
Đặc điểm của các nguyên tố này là khả năng hình thành các ion dương bằng cách mất đi các electron ở lớp ngoài cùng. Điều này làm cho chúng thường có tính kim loại mạnh. Các nguyên tố như Kẽm (Zn), Sắt (Fe), và Đồng (Cu) là những ví dụ điển hình, với cấu hình electron như sau:
- Kẽm (Zn): \([Ar] 3d^{10} 4s^2\)
- Sắt (Fe): \([Ar] 3d^6 4s^2\)
- Đồng (Cu): \([Ar] 3d^{10} 4s^1\)
Các nguyên tố này đều có 4 lớp electron và thuộc nhóm d trong bảng tuần hoàn, nơi các electron ở phân lớp d đóng vai trò quan trọng trong việc quyết định tính chất hóa học của chúng.
Nhìn chung, các nguyên tố có 4 lớp electron thường được ứng dụng rộng rãi trong công nghiệp, từ sản xuất hợp kim đến các chất xúc tác hóa học, nhờ vào tính chất đặc biệt của các electron trong phân lớp d.
Cấu trúc lớp vỏ electron của nguyên tử
Lớp vỏ electron của một nguyên tử được tạo thành từ các lớp vỏ năng lượng, nơi các electron quay quanh hạt nhân theo quỹ đạo cụ thể. Mỗi lớp vỏ này có khả năng chứa một số lượng tối đa electron xác định, tuân theo nguyên tắc Hund và nguyên lý loại trừ của Pauli.
Đối với các nguyên tố có 4 lớp electron, các lớp vỏ này lần lượt được ký hiệu là K, L, M, và N, tương ứng với các mức năng lượng tăng dần từ gần hạt nhân ra xa:
- Lớp K: Chứa tối đa 2 electron \((n=1)\).
- Lớp L: Chứa tối đa 8 electron \((n=2)\).
- Lớp M: Chứa tối đa 18 electron \((n=3)\).
- Lớp N: Chứa tối đa 32 electron \((n=4)\).
Cấu trúc của lớp vỏ electron tuân theo thứ tự sắp xếp các electron vào các phân lớp: s, p, d, f. Đối với một nguyên tố có 4 lớp electron, cấu hình electron có thể được biểu diễn như sau:
\[
1s^2 2s^2 2p^6 3s^2 3p^6 3d^x 4s^y
\]
Trong đó, các electron trong phân lớp 3d và 4s đóng vai trò quyết định trong tính chất hóa học của nguyên tố. Các electron ở lớp vỏ ngoài cùng (lớp N) thường tham gia vào các phản ứng hóa học và xác định tính chất liên kết của nguyên tố.
Sự sắp xếp của các electron trong các lớp vỏ tuân theo nguyên lý năng lượng thấp nhất (các electron được điền vào các phân lớp có mức năng lượng thấp trước) và tạo ra những đặc tính độc đáo cho mỗi nguyên tố.

Đặc điểm hóa học của nguyên tố với 4 lớp electron
Nguyên tố có 4 lớp electron thường thuộc chu kỳ thứ 4 của bảng tuần hoàn, bao gồm các kim loại chuyển tiếp và một số phi kim. Đặc điểm hóa học của những nguyên tố này được xác định bởi cấu hình electron, đặc biệt là sự sắp xếp của các electron trong lớp vỏ ngoài cùng.
- Tính chất kim loại: Nhiều nguyên tố có 4 lớp electron, như Sắt (Fe), Đồng (Cu), và Kẽm (Zn), là các kim loại chuyển tiếp. Chúng có khả năng dẫn điện và nhiệt tốt, có độ dẻo và dễ uốn. Các electron ở phân lớp \(3d\) và \(4s\) tham gia vào việc hình thành liên kết kim loại, tạo ra các tính chất cơ học và dẫn điện đặc trưng.
- Khả năng tạo ion: Nguyên tố có 4 lớp electron thường có xu hướng mất đi electron ở lớp ngoài cùng để tạo thành ion dương. Ví dụ, Kẽm thường mất 2 electron để tạo thành ion \(Zn^{2+}\), trong khi Đồng có thể tạo ra cả \(Cu^+\) và \(Cu^{2+}\) tùy theo điều kiện phản ứng.
- Tính chất hóa học đa dạng: Do sự tham gia của electron từ các phân lớp \(3d\) và \(4s\), các nguyên tố này có thể tạo ra nhiều trạng thái oxy hóa khác nhau, từ đó tham gia vào nhiều loại phản ứng hóa học. Sắt, ví dụ, có thể tồn tại ở trạng thái oxy hóa +2 hoặc +3, đóng vai trò quan trọng trong các phản ứng oxy hóa - khử.
- Liên kết hóa học: Nguyên tố với 4 lớp electron có khả năng hình thành liên kết cộng hóa trị, liên kết ion và liên kết kim loại. Tính chất này khiến chúng trở thành thành phần chính trong nhiều hợp chất hóa học quan trọng, bao gồm cả hợp chất vô cơ và hữu cơ.
Nhìn chung, các nguyên tố với 4 lớp electron có những đặc điểm hóa học phong phú và đa dạng, nhờ vào cấu hình electron phức tạp và sự tham gia của các phân lớp d vào phản ứng hóa học. Điều này làm cho chúng trở thành những nguyên tố quan trọng trong nhiều ngành công nghiệp và ứng dụng thực tiễn.

Ví dụ về các nguyên tố cụ thể có 4 lớp electron
Các nguyên tố có 4 lớp electron thường nằm trong chu kỳ 4 của bảng tuần hoàn, và bao gồm nhiều kim loại chuyển tiếp. Dưới đây là một số ví dụ tiêu biểu:
- Kẽm (Zn): Nguyên tố này có cấu hình electron \([Ar] 3d^{10} 4s^2\). Kẽm là một kim loại màu trắng bạc, thường được sử dụng để mạ kẽm bảo vệ sắt thép khỏi bị ăn mòn. Zn có tính chất hóa học tương đối ổn định, không dễ bị oxy hóa trong không khí.
- Sắt (Fe): Sắt có cấu hình electron \([Ar] 3d^6 4s^2\). Đây là một trong những kim loại quan trọng nhất trong công nghiệp, được sử dụng rộng rãi trong sản xuất thép và các hợp kim khác. Sắt có khả năng hình thành nhiều trạng thái oxy hóa, như \(Fe^{2+}\) và \(Fe^{3+}\).
- Đồng (Cu): Đồng có cấu hình electron \([Ar] 3d^{10} 4s^1\). Là một kim loại có màu đỏ đặc trưng, đồng có độ dẫn điện và dẫn nhiệt rất cao, thường được sử dụng trong các thiết bị điện và điện tử. Đồng cũng có khả năng tạo ra các hợp kim quan trọng như đồng thau (hợp kim đồng-kẽm) và đồng đỏ (hợp kim đồng-thiếc).
- Brôm (Br): Brôm có cấu hình electron \([Ar] 3d^{10} 4s^2 4p^5\). Đây là một phi kim, thuộc nhóm halogen, có tính chất oxy hóa mạnh và thường được sử dụng trong các hợp chất chống cháy, thuốc trừ sâu và dược phẩm.
Mỗi nguyên tố này đều có những ứng dụng và tính chất hóa học riêng biệt, được quyết định bởi cấu trúc electron và vị trí của chúng trong bảng tuần hoàn. Sự đa dạng trong cấu hình electron cho phép các nguyên tố này tham gia vào nhiều loại phản ứng hóa học và ứng dụng công nghiệp khác nhau.

Các bài tập và câu hỏi trắc nghiệm liên quan
Dưới đây là một số bài tập và câu hỏi trắc nghiệm liên quan đến nguyên tố có 4 lớp electron. Các bài tập này sẽ giúp củng cố kiến thức về cấu trúc electron và tính chất hóa học của các nguyên tố trong chu kỳ thứ 4 của bảng tuần hoàn.
- Bài tập 1: Hãy xác định cấu hình electron của nguyên tử Sắt (Fe) và giải thích vì sao Sắt có thể tồn tại ở hai trạng thái oxy hóa khác nhau (+2 và +3).
- Bài tập 2: Một nguyên tử có cấu hình electron \([Ar] 3d^{10} 4s^2\). Nguyên tử này thuộc nguyên tố nào? Hãy giải thích tính chất hóa học đặc trưng của nguyên tố này.
- Bài tập 3: Hãy sắp xếp các nguyên tố sau theo thứ tự tăng dần của năng lượng ion hóa đầu tiên: Kẽm (Zn), Đồng (Cu), và Sắt (Fe). Giải thích vì sao lại có sự khác biệt này.
- Bài tập 4: Brôm (Br) có cấu hình electron \([Ar] 3d^{10} 4s^2 4p^5\). Hãy dự đoán khả năng tham gia phản ứng hóa học của Brôm và viết phương trình phản ứng minh họa.
- Bài tập 5: Một nguyên tố X có 4 lớp electron và nằm ở nhóm 2 trong bảng tuần hoàn. Xác định nguyên tố này và mô tả các tính chất hóa học chủ yếu của nó.
Câu hỏi trắc nghiệm
- Nguyên tử nào sau đây có 4 lớp electron?
- A. Helium (He)
- B. Kali (K)
- C. Natri (Na)
- D. Nhôm (Al)
- Nguyên tố nào sau đây thuộc chu kỳ 4 và có cấu hình electron kết thúc ở phân lớp \(3d^6 4s^2\)?
- A. Mangan (Mn)
- B. Sắt (Fe)
- C. Đồng (Cu)
- D. Kẽm (Zn)
- Trong số các nguyên tố sau, nguyên tố nào có khả năng tạo ra ion \(Cu^+\) và \(Cu^{2+}\)?
- A. Đồng (Cu)
- B. Sắt (Fe)
- C. Kẽm (Zn)
- D. Brom (Br)
- Nguyên tố Brôm (Br) nằm ở nhóm nào trong bảng tuần hoàn?
- A. Nhóm 1
- B. Nhóm 2
- C. Nhóm 17
- D. Nhóm 18
- Nguyên tố nào sau đây có tính chất hóa học gần giống với Kẽm (Zn)?
- A. Magiê (Mg)
- B. Sắt (Fe)
- C. Canxi (Ca)
- D. Chì (Pb)
Các bài tập và câu hỏi trắc nghiệm trên sẽ giúp học sinh và người đọc có thể ôn tập và hiểu sâu hơn về đặc điểm hóa học và cấu trúc lớp vỏ electron của các nguyên tố có 4 lớp electron.
XEM THÊM:
Kết luận về vai trò của nguyên tố có 4 lớp electron
Các nguyên tố có 4 lớp electron đóng vai trò vô cùng quan trọng trong tự nhiên và công nghiệp, nhờ vào cấu trúc electron độc đáo của chúng. Với sự hiện diện của các lớp electron này, các nguyên tố như Sắt (Fe), Đồng (Cu), và Kẽm (Zn) không chỉ thể hiện tính chất hóa học đa dạng mà còn có nhiều ứng dụng thực tiễn.
Vai trò của những nguyên tố này được thể hiện rõ rệt qua khả năng tham gia vào các phản ứng hóa học, sự ổn định trong liên kết, và khả năng tạo ra các trạng thái oxy hóa khác nhau. Chúng là nền tảng cho nhiều ngành công nghiệp quan trọng, từ sản xuất thép và hợp kim đến điện tử và hóa học.
Điều này cho thấy rằng việc hiểu biết về cấu trúc electron và tính chất hóa học của các nguyên tố này không chỉ quan trọng trong học tập mà còn có giá trị ứng dụng cao trong đời sống hàng ngày và phát triển công nghệ.
Nhìn chung, các nguyên tố có 4 lớp electron không chỉ là những thành phần cơ bản trong tự nhiên mà còn là những yếu tố quyết định đến sự phát triển của xã hội hiện đại, đặc biệt là trong các lĩnh vực công nghiệp và công nghệ cao.





.png)