Chủ đề cách xác định điện tích ion: Cách xác định điện tích ion là một khía cạnh quan trọng trong hóa học, giúp bạn hiểu rõ hơn về cấu trúc nguyên tử và các phản ứng hóa học. Bài viết này cung cấp hướng dẫn chi tiết về cách xác định điện tích ion, từ các khái niệm cơ bản đến các phương pháp tính toán nâng cao, nhằm giúp bạn nắm vững kiến thức và áp dụng vào thực tiễn.
Mục lục
Cách Xác Định Điện Tích Ion
Điện tích của một ion có thể được xác định dựa trên số lượng electron mà nguyên tử đã nhường hoặc nhận. Điều này thường liên quan đến sự biến đổi số lượng electron của nguyên tử so với trạng thái ban đầu của nó trong bảng tuần hoàn.
1. Điện Tích Của Ion Đơn Nguyên Tử
Để xác định điện tích của một ion đơn nguyên tử, bạn có thể thực hiện các bước sau:
- Xác định số lượng proton (số hiệu nguyên tử) trong nguyên tử.
- Xác định số lượng electron sau khi nguyên tử đã nhường hoặc nhận electron.
- Điện tích của ion được tính bằng hiệu số giữa số proton và số electron:
- Nếu nguyên tử nhường electron, nó sẽ trở thành ion dương (cation) với điện tích dương tương ứng.
- Nếu nguyên tử nhận electron, nó sẽ trở thành ion âm (anion) với điện tích âm tương ứng.
Ví dụ: Ion natri (Na⁺) có 11 proton và 10 electron, do đó điện tích là +1.
2. Điện Tích Của Ion Đa Nguyên Tử
Điện tích của một ion đa nguyên tử có thể được xác định bằng cách tính tổng số oxi hóa của các nguyên tử trong ion đó. Công thức tổng quát để tính điện tích là:
\[\text{Điện tích của ion} = \sum \text{Số oxi hóa của các nguyên tử}\]
Ví dụ: Đối với ion sulfate (\(SO_4^{2-}\)), điện tích của ion là -2 vì lưu huỳnh (S) có số oxi hóa là +6 và mỗi nguyên tử oxy (O) có số oxi hóa là -2.
3. Ứng Dụng Trong Thực Tiễn
Việc xác định điện tích ion rất quan trọng trong nhiều lĩnh vực khoa học và công nghệ, bao gồm:
- Hóa học phân tích: Xác định thành phần và cấu trúc của các hợp chất hóa học.
- Điện hóa học: Nghiên cứu các phản ứng điện hóa và quá trình oxy hóa-khử.
- Sinh học: Hiểu biết về các ion trong cơ thể, ví dụ như vai trò của ion natri và kali trong dẫn truyền thần kinh.
4. Tổng Kết
Việc xác định điện tích ion giúp chúng ta hiểu rõ hơn về bản chất của các phản ứng hóa học và các quá trình sinh học, từ đó ứng dụng trong nhiều lĩnh vực khác nhau. Hiểu biết về cách xác định điện tích ion cũng là nền tảng quan trọng trong nghiên cứu và giảng dạy hóa học.

.png)
1. Tổng Quan Về Điện Tích Ion
Điện tích ion là khái niệm cơ bản trong hóa học, liên quan đến việc nguyên tử hoặc nhóm nguyên tử bị mất hoặc nhận thêm electron, dẫn đến việc hình thành ion mang điện tích dương (cation) hoặc âm (anion).
Khi một nguyên tử nhường electron, nó sẽ trở thành ion dương (cation), ngược lại, khi nguyên tử nhận thêm electron, nó trở thành ion âm (anion). Điện tích của ion phụ thuộc vào số lượng electron bị mất hoặc nhận. Ví dụ, nguyên tử natri (Na) khi nhường một electron sẽ trở thành ion Na+, trong khi nguyên tử clo (Cl) khi nhận một electron sẽ trở thành ion Cl-.
Để xác định điện tích của ion, người ta thường sử dụng các nguyên tắc về số oxi hóa hoặc tính toán dựa trên số đơn vị điện tích hạt nhân trừ đi số electron của ion. Ví dụ:
- Ion Na+: Điện tích = 11 - 10 = +1
- Ion O2-: Điện tích = 8 - 10 = -2
Các ion có thể được phân loại dựa trên số lượng nguyên tử mà chúng chứa. Có ion đơn nguyên tử như Na+, Cl-, và ion đa nguyên tử như SO42-.
Việc hiểu và xác định điện tích ion là một phần quan trọng trong việc giải thích các phản ứng hóa học và tính chất của các hợp chất hóa học.
2. Phương Pháp Xác Định Điện Tích Ion Đơn Nguyên Tử
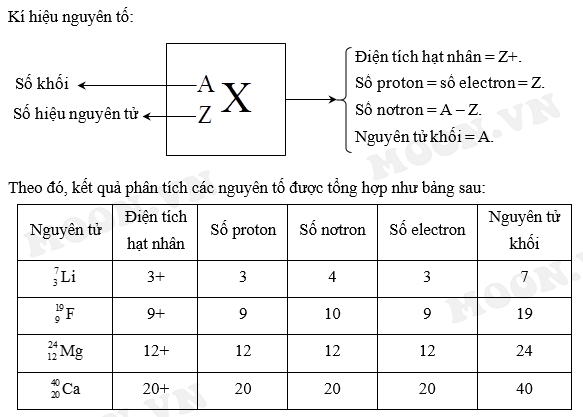
Điện tích của một ion đơn nguyên tử được xác định dựa trên số lượng electron mà nguyên tử đã nhường hoặc nhận. Để xác định điện tích của ion, bạn cần thực hiện các bước sau:
- Xác định số hiệu nguyên tử:
Số hiệu nguyên tử là số lượng proton trong hạt nhân của nguyên tử. Số proton này cũng là số điện tích dương trong nguyên tử. Ví dụ, số hiệu nguyên tử của Natri (Na) là 11, có nghĩa là nó có 11 proton.
- Xác định số lượng electron ban đầu:
Trong trạng thái trung hòa, số lượng electron của nguyên tử bằng với số proton. Do đó, Natri (Na) có 11 electron.
- Xác định sự thay đổi số electron:
Nếu nguyên tử nhường electron, nó sẽ trở thành ion dương (cation); nếu nhận thêm electron, nó sẽ trở thành ion âm (anion). Ví dụ, Natri thường nhường một electron để trở thành Na+ với 10 electron.
- Tính điện tích của ion:
Điện tích của ion được tính bằng cách lấy số lượng proton trừ đi số lượng electron sau khi có sự thay đổi:
\[\text{Điện tích của ion} = \text{Số proton} - \text{Số electron sau khi thay đổi}\]
- Ví dụ: Với ion Na+, số proton là 11 và số electron sau khi nhường 1 electron là 10, do đó điện tích của ion là +1.
Bằng cách áp dụng các bước trên, bạn có thể dễ dàng xác định điện tích của bất kỳ ion đơn nguyên tử nào.

3. Phương Pháp Xác Định Điện Tích Ion Đa Nguyên Tử
Ion đa nguyên tử là các ion được tạo thành từ hai hoặc nhiều nguyên tử liên kết với nhau và mang điện tích tổng thể. Để xác định điện tích của ion đa nguyên tử, bạn có thể làm theo các bước sau:
- Xác định công thức phân tử của ion:
Đầu tiên, xác định công thức phân tử của ion đa nguyên tử. Ví dụ, ion sulfate có công thức phân tử là SO42-.
- Xác định số oxi hóa của các nguyên tố trong ion:
Mỗi nguyên tố trong ion đa nguyên tử có một số oxi hóa nhất định. Tổng các số oxi hóa của các nguyên tố phải bằng điện tích của ion. Ví dụ, trong ion SO42-, số oxi hóa của lưu huỳnh (S) là +6, và mỗi nguyên tử oxy (O) có số oxi hóa -2.
- Tính tổng số oxi hóa:
Tính tổng số oxi hóa của tất cả các nguyên tố trong ion. Đối với SO42-, ta có:
\[ \text{Tổng số oxi hóa} = +6 + 4(-2) = -2 \]
Điều này cho thấy điện tích tổng thể của ion SO4 là -2.
- Xác định điện tích ion:
Tổng các số oxi hóa cho biết điện tích của ion đa nguyên tử. Điện tích này có thể là dương, âm, hoặc trung tính, tùy thuộc vào sự sắp xếp của các nguyên tố trong ion. Ví dụ, với SO42-, điện tích là -2.
Như vậy, việc xác định điện tích ion đa nguyên tử dựa trên việc tính toán và phân tích số oxi hóa của các nguyên tố thành phần, đảm bảo sự chính xác trong các phản ứng hóa học và công thức hóa học.

XEM THÊM:
4. Ứng Dụng Của Việc Xác Định Điện Tích Ion
Việc xác định điện tích ion đóng vai trò quan trọng trong nhiều lĩnh vực khác nhau của khoa học và công nghệ. Dưới đây là một số ứng dụng chính của việc xác định điện tích ion:
- Phân tích và dự đoán phản ứng hóa học:
Điện tích ion giúp xác định cách các ion tương tác với nhau trong các phản ứng hóa học. Ví dụ, ion có điện tích trái dấu sẽ hút nhau và tạo thành hợp chất ion, chẳng hạn như sự hình thành NaCl từ Na+ và Cl-.
- Xác định cấu trúc và tính chất của các hợp chất:
Điện tích ion cung cấp thông tin quan trọng về cấu trúc và tính chất của các hợp chất hóa học. Ví dụ, các hợp chất ion thường có nhiệt độ nóng chảy cao và dẫn điện tốt khi hòa tan trong nước.
- Ứng dụng trong công nghệ pin và năng lượng:
Các ion như Li+ được sử dụng rộng rãi trong công nghệ pin, đặc biệt là pin lithium-ion, nhờ khả năng di chuyển và tạo ra dòng điện khi có sự chênh lệch điện thế.
- Điều chỉnh pH và xử lý nước:
Xác định điện tích của các ion trong dung dịch giúp điều chỉnh pH, một yếu tố quan trọng trong việc xử lý nước và các quy trình công nghiệp khác.
- Y học và sinh học:
Trong y học, việc hiểu và kiểm soát điện tích ion là cơ sở cho nhiều liệu pháp điều trị, bao gồm cả việc điều chỉnh điện giải trong cơ thể và sử dụng ion trong các thiết bị chẩn đoán như máy đo ion đồ (ion-selective electrode).
Nhờ vào việc xác định chính xác điện tích ion, các nhà khoa học và kỹ sư có thể thiết kế các quy trình và sản phẩm hiệu quả hơn, từ đó cải thiện chất lượng cuộc sống và phát triển công nghệ tiên tiến.

5. Tài Liệu Tham Khảo Về Điện Tích Ion
Để hiểu rõ hơn về điện tích ion và các khía cạnh liên quan, bạn có thể tham khảo các tài liệu và nguồn học liệu sau đây. Những tài liệu này cung cấp kiến thức từ cơ bản đến nâng cao về điện tích ion, giúp bạn nắm vững các khái niệm và ứng dụng trong thực tiễn.
- Sách giáo khoa hóa học phổ thông:
Các sách giáo khoa hóa học từ cấp trung học cơ sở đến trung học phổ thông cung cấp kiến thức nền tảng về điện tích ion, bao gồm cách hình thành ion, quy tắc xác định số oxi hóa, và ứng dụng của ion trong các phản ứng hóa học.
- Tài liệu đại học về hóa học vô cơ:
Ở cấp độ đại học, các tài liệu về hóa học vô cơ cung cấp cái nhìn sâu hơn về điện tích ion, từ việc xác định số oxi hóa của các nguyên tố trong ion đa nguyên tử đến các nguyên tắc liên quan đến cấu trúc phân tử và năng lượng.
- Các bài giảng trực tuyến:
Các khóa học trực tuyến từ các trường đại học danh tiếng hoặc các nền tảng giáo dục như Coursera, Khan Academy cung cấp các bài giảng video và bài tập tương tác về điện tích ion và các chủ đề liên quan.
- Bài viết khoa học và nghiên cứu:
Các bài viết khoa học được xuất bản trên các tạp chí chuyên ngành là nguồn tài liệu quý giá để cập nhật các nghiên cứu mới nhất về điện tích ion, bao gồm các phát hiện về cấu trúc ion, sự chuyển hóa của ion trong các môi trường khác nhau, và ứng dụng trong công nghệ mới.
- Trang web giáo dục:
Các trang web giáo dục như Chemguide, ThoughtCo, và các trang web của các tổ chức hóa học cung cấp các bài viết chuyên sâu và tài liệu tham khảo về điện tích ion, kèm theo các ví dụ minh họa và bài tập thực hành.
Việc tham khảo các tài liệu này sẽ giúp bạn củng cố và mở rộng kiến thức về điện tích ion, hỗ trợ trong việc học tập và nghiên cứu khoa học.