Chủ đề điện tích ion: Điện tích ion là khái niệm quan trọng trong hóa học, giúp hiểu rõ hơn về cấu trúc và tính chất của các hợp chất hóa học. Bài viết này cung cấp thông tin chi tiết về điện tích ion, cách tính toán, và những ứng dụng thực tiễn trong đời sống và công nghiệp.
Mục lục
Điện Tích Ion: Khái Niệm và Ứng Dụng
Trong hóa học, điện tích ion là khái niệm cơ bản, đề cập đến sự mất hoặc nhận electron của nguyên tử để tạo thành ion. Điện tích ion ảnh hưởng trực tiếp đến cấu trúc và tính chất của các chất hóa học, đặc biệt là các hợp chất ion.
1. Định Nghĩa Điện Tích Ion
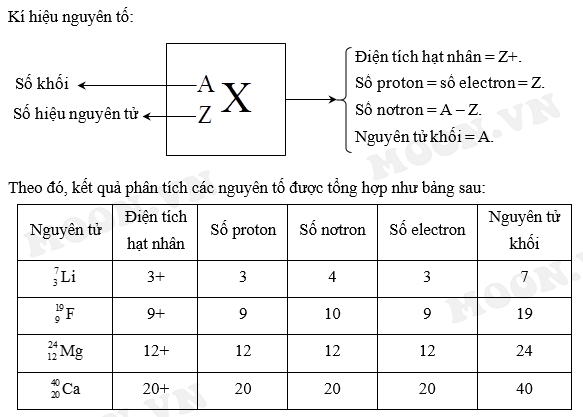
Khi một nguyên tử mất đi hoặc nhận thêm electron, nó trở thành một ion với điện tích tương ứng. Điện tích của ion được tính dựa trên sự chênh lệch giữa số lượng proton trong hạt nhân và số lượng electron trong ion.
2. Các Loại Ion
- Cation: Ion có điện tích dương do mất electron.
- Anion: Ion có điện tích âm do nhận electron.
3. Cách Tính Điện Tích Ion
Điện tích ion được tính bằng công thức:
\[ \text{Điện tích ion} = \text{Số đơn vị điện tích hạt nhân} - \text{Số electron của ion} \]
Ví dụ, với ion natri (Na+):
\[ \text{Điện tích của Na^+} = 11 (số proton) - 10 (số electron) = +1 \]
4. Vai Trò Của Điện Tích Ion Trong Hóa Học
- Điện tích ion quyết định lực hút tĩnh điện giữa các ion, tạo nên liên kết ion trong các hợp chất.
- Các hợp chất ion thường có nhiệt độ nóng chảy cao, độ bền vững, và dẫn điện khi ở trạng thái lỏng hoặc dung dịch.
5. Ví Dụ Về Liên Kết Ion
Một trong những ví dụ phổ biến nhất về liên kết ion là trong hợp chất NaCl (muối ăn), nơi ion Na+ và Cl- liên kết với nhau thông qua lực hút tĩnh điện:
\[ \text{Na} + \text{Cl} \rightarrow \text{Na}^+ + \text{Cl}^- \rightarrow \text{NaCl} \]
6. Ứng Dụng Thực Tiễn Của Điện Tích Ion
- Các hợp chất ion như NaCl được sử dụng rộng rãi trong thực phẩm, y học, và công nghiệp.
- Điện tích ion còn đóng vai trò quan trọng trong các quá trình điện hóa học, như điện phân và pin điện hóa.

.png)
1. Khái Niệm Về Điện Tích Ion
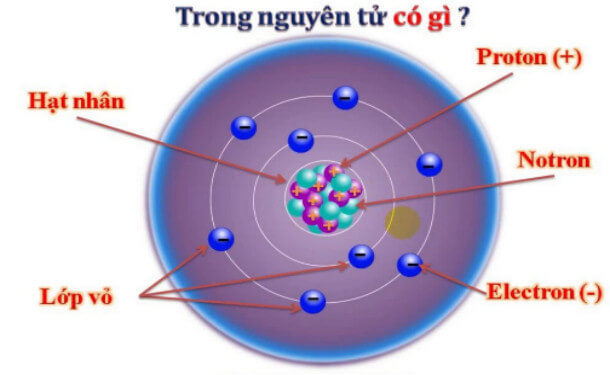
Điện tích ion là khái niệm trong hóa học dùng để chỉ sự chênh lệch giữa số lượng proton và electron trong một nguyên tử hoặc phân tử khi nó mất hoặc nhận thêm electron. Quá trình này tạo ra các hạt mang điện gọi là ion.
Các nguyên tử hoặc phân tử có thể trở thành ion thông qua hai quá trình chính:
- Mất electron: Khi một nguyên tử mất đi một hoặc nhiều electron, nó sẽ có nhiều proton hơn electron và trở thành ion dương (cation).
- Nhận electron: Khi một nguyên tử nhận thêm một hoặc nhiều electron, nó sẽ có nhiều electron hơn proton và trở thành ion âm (anion).
Điện tích của ion được xác định dựa trên sự chênh lệch giữa số proton và electron. Ví dụ, nếu một nguyên tử natri (Na) mất đi một electron, nó sẽ có điện tích +1 và trở thành ion Na+. Tương tự, nếu một nguyên tử clo (Cl) nhận thêm một electron, nó sẽ có điện tích -1 và trở thành ion Cl-.
Công thức tổng quát để tính điện tích ion:
\[
\text{Điện tích ion} = \text{Số proton} - \text{Số electron}
\]
Điện tích ion đóng vai trò quan trọng trong việc hình thành liên kết ion giữa các nguyên tử, ảnh hưởng đến cấu trúc và tính chất của các hợp chất hóa học. Nhờ đó, nó giúp giải thích nhiều hiện tượng hóa học trong tự nhiên và ứng dụng trong các lĩnh vực khoa học và công nghiệp.
2. Cách Tính Điện Tích Ion
Điện tích của một ion phụ thuộc vào số lượng electron mà nguyên tử đã mất hoặc nhận. Khi một nguyên tử mất electron, nó sẽ trở thành ion dương (cation) với điện tích dương tương ứng với số electron bị mất. Ngược lại, khi một nguyên tử nhận electron, nó sẽ trở thành ion âm (anion) với điện tích âm tương ứng với số electron được nhận.
Ví dụ, một nguyên tử Natri (Na) khi mất đi một electron sẽ trở thành cation Na+. Công thức tính điện tích của ion là:
Cation:
Ví dụ:
Anion:
Ví dụ:
Như vậy, việc tính toán điện tích ion dựa trên việc xác định số lượng electron mà nguyên tử mất đi hoặc nhận vào để đạt cấu hình bền.

3. Ảnh Hưởng Của Điện Tích Ion Trong Liên Kết Hóa Học
Điện tích của ion đóng vai trò quan trọng trong việc hình thành và duy trì liên kết hóa học giữa các nguyên tử và phân tử. Điện tích ion có thể tạo ra các lực tĩnh điện mạnh, ảnh hưởng đến sự tương tác giữa các ion trong một hợp chất hóa học.
Liên kết ion:
Liên kết ion là loại liên kết hóa học phổ biến nhất mà điện tích ion đóng vai trò then chốt. Liên kết này hình thành khi một nguyên tử mất đi electron để trở thành cation, trong khi nguyên tử khác nhận electron để trở thành anion. Sự khác biệt về điện tích giữa cation và anion tạo ra lực hút mạnh, giúp giữ các ion lại với nhau trong mạng tinh thể ion.
Ví dụ: Liên kết giữa Na+ và Cl- trong NaCl:
Liên kết cộng hóa trị phân cực:
Điện tích ion cũng ảnh hưởng đến liên kết cộng hóa trị, đặc biệt là trong các liên kết cộng hóa trị phân cực. Khi có sự chênh lệch lớn về độ âm điện giữa hai nguyên tử, cặp electron dùng chung bị lệch về phía nguyên tử có độ âm điện cao hơn, tạo ra các phần điện tích dương và âm cục bộ trong phân tử.
Ví dụ: Liên kết giữa H và O trong phân tử H2O:
Phân tử nước H2O có sự phân cực rõ ràng, với đầu O mang điện tích âm và đầu H mang điện tích dương.
Như vậy, điện tích ion không chỉ ảnh hưởng đến cấu trúc của các hợp chất hóa học mà còn quyết định tính chất và phản ứng hóa học của chúng.

XEM THÊM:
4. Ứng Dụng Thực Tiễn Của Điện Tích Ion
Điện tích ion đóng vai trò quan trọng trong nhiều ứng dụng thực tiễn, từ y học, công nghiệp, cho đến các lĩnh vực công nghệ cao. Dưới đây là một số ứng dụng nổi bật:
- Điện phân: Điện tích ion được sử dụng trong quá trình điện phân để tách các nguyên tố ra khỏi hợp chất. Ví dụ, trong quá trình điện phân nước (H2O), dòng điện làm phân tách các ion H+ và OH-, tạo ra khí hydro và oxy.
- Pin và ắc quy: Các loại pin và ắc quy hoạt động dựa trên nguyên lý chuyển động của các ion giữa các điện cực. Ví dụ, trong pin lithium-ion, các ion Li+ di chuyển giữa cực âm và cực dương trong quá trình sạc và xả, giúp cung cấp năng lượng cho các thiết bị điện tử.
- Ứng dụng trong y học: Trong y học, các ion được sử dụng trong liệu pháp ion hóa để điều trị một số bệnh lý hoặc cải thiện sức khỏe. Ví dụ, máy ion hóa không khí giúp tạo ra các ion âm, làm sạch không khí và cải thiện chất lượng môi trường sống.
- Xử lý nước: Công nghệ sử dụng ion để xử lý nước, chẳng hạn như quá trình trao đổi ion để loại bỏ các ion không mong muốn như Ca2+, Mg2+ trong nước cứng, từ đó làm mềm nước và tăng chất lượng nước.
- Cảm biến ion: Các cảm biến ion được sử dụng để đo lường nồng độ các ion trong môi trường, chẳng hạn như cảm biến pH đo nồng độ ion H+ trong dung dịch.
Như vậy, điện tích ion không chỉ là một khái niệm lý thuyết mà còn có nhiều ứng dụng thực tiễn quan trọng trong đời sống và công nghiệp, góp phần vào sự phát triển của khoa học kỹ thuật và y học.

5. Các Ví Dụ Điển Hình Về Liên Kết Ion
Liên kết ion là loại liên kết hóa học hình thành giữa các ion có điện tích trái dấu, thường là giữa kim loại và phi kim. Dưới đây là một số ví dụ điển hình về liên kết ion:
- Liên kết trong NaCl (Muối ăn): Natri (Na) là kim loại kiềm, dễ mất đi một electron để trở thành ion Na+. Clo (Cl) là phi kim, dễ nhận thêm một electron để trở thành ion Cl-. Khi Na và Cl kết hợp, chúng tạo thành liên kết ion, trong đó Na+ và Cl- bị hút vào nhau bởi lực hút tĩnh điện, hình thành nên hợp chất NaCl.
- Liên kết trong CaCl2 (Canxi Clorua): Canxi (Ca) là kim loại kiềm thổ, dễ mất đi hai electron để trở thành ion Ca2+. Mỗi nguyên tử Cl nhận một electron từ Ca để trở thành ion Cl-. Hai ion Cl- sẽ kết hợp với một ion Ca2+ để tạo thành hợp chất CaCl2, với các liên kết ion mạnh mẽ.
- Liên kết trong MgO (Magie Oxit): Magie (Mg) mất hai electron để trở thành ion Mg2+, trong khi oxy (O) nhận hai electron để trở thành ion O2-. Sự kết hợp giữa Mg2+ và O2- tạo thành liên kết ion, dẫn đến việc hình thành hợp chất MgO.
- Liên kết trong Al2O3 (Nhôm Oxit): Nhôm (Al) mất ba electron để trở thành ion Al3+, trong khi mỗi nguyên tử oxy nhận hai electron để trở thành ion O2-. Liên kết ion giữa các ion Al3+ và O2- hình thành nên hợp chất Al2O3, một chất rắn có cấu trúc tinh thể bền vững.
Các ví dụ trên minh họa cho các liên kết ion điển hình, nơi mà sự tương tác tĩnh điện giữa các ion trái dấu tạo nên các hợp chất bền vững với cấu trúc mạng tinh thể đặc trưng.
6. Tổng Kết Và Ý Nghĩa Của Điện Tích Ion
Điện tích ion đóng vai trò quan trọng và không thể thiếu trong hóa học, đặc biệt là trong việc hình thành các hợp chất ion và xác định tính chất của chúng. Ion là các hạt mang điện tích, được tạo ra khi nguyên tử hoặc phân tử mất hoặc nhận thêm electron, dẫn đến sự hình thành các cation (ion dương) và anion (ion âm).
Trong quá trình hình thành liên kết ion, các nguyên tử kim loại có xu hướng nhường electron để tạo thành cation, trong khi các nguyên tử phi kim lại có xu hướng nhận electron để tạo thành anion. Lực hút tĩnh điện giữa cation và anion tạo ra liên kết ion, một loại liên kết hóa học mạnh mẽ và bền vững. Liên kết này chính là yếu tố cốt lõi quyết định cấu trúc mạng tinh thể và các tính chất vật lý của hợp chất ion.
Một số tính chất nổi bật của hợp chất ion bao gồm điểm nóng chảy và điểm sôi cao, độ cứng, tính giòn, và khả năng dẫn điện khi ở trạng thái nóng chảy hoặc trong dung dịch. Điều này là do cấu trúc mạng tinh thể chặt chẽ và lực hút mạnh giữa các ion mang điện tích trái dấu.
Trong thực tiễn, điện tích ion và liên kết ion có ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau. Trong công nghiệp, chúng được sử dụng để sản xuất các vật liệu có độ bền cao và dẫn điện tốt. Trong y tế, các ion như
Tổng kết lại, việc nghiên cứu và hiểu rõ về điện tích ion không chỉ giúp chúng ta nắm vững các khái niệm cơ bản trong hóa học mà còn mở ra nhiều cơ hội ứng dụng trong thực tiễn. Sự tương tác giữa các ion với nhau cũng như với môi trường xung quanh là yếu tố then chốt để phát triển các công nghệ mới và cải thiện chất lượng cuộc sống.