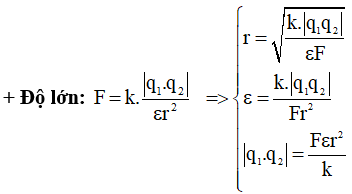Chủ đề ký hiệu điện tích: Ký hiệu điện tích là một yếu tố cơ bản trong điện học, thể hiện lượng điện năng mà một vật thể sở hữu. Bài viết này sẽ giúp bạn hiểu rõ hơn về các ký hiệu điện tích, ứng dụng của chúng trong đời sống, và những công thức tính toán quan trọng liên quan đến điện tích.
Mục lục
Ký Hiệu Điện Tích: Khái Niệm và Ứng Dụng
Ký hiệu điện tích là một phần quan trọng trong lĩnh vực vật lý và hóa học, được sử dụng để biểu thị các giá trị và thuộc tính của điện tích trong các hạt cơ bản, nguyên tử và phân tử. Trong phần này, chúng ta sẽ tìm hiểu về các khái niệm cơ bản liên quan đến ký hiệu điện tích, cách biểu diễn và các ứng dụng của chúng trong thực tế.
Ký Hiệu Điện Tích Trong Vật Lý và Hóa Học
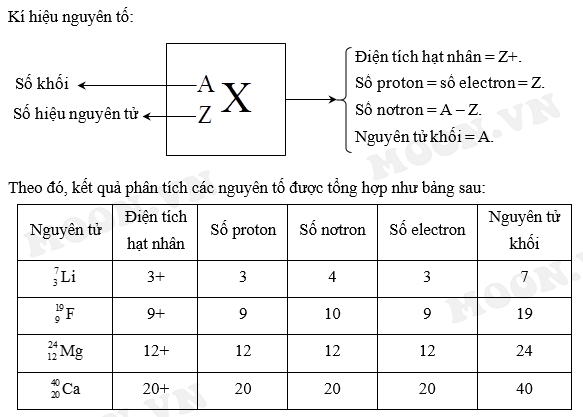
- Điện tích: Điện tích là một thuộc tính cơ bản của vật chất, xuất hiện trong các hạt cơ bản như electron, proton, và các ion. Điện tích được ký hiệu bằng chữ "q" và đo bằng đơn vị Coulomb (C).
- Ký hiệu của điện tích: Trong vật lý và hóa học, điện tích thường được biểu thị bằng dấu "+" hoặc "-" tương ứng với điện tích dương hoặc âm. Ví dụ, electron có điện tích âm và được ký hiệu là "-e", trong khi proton có điện tích dương và được ký hiệu là "+e".
- Công thức tính điện tích: Điện tích được xác định theo công thức: \[ q = n \times e \] trong đó \(q\) là điện tích, \(n\) là số lượng hạt mang điện, và \(e\) là điện tích của một hạt cơ bản.
Ứng Dụng Thực Tế Của Ký Hiệu Điện Tích
Ký hiệu điện tích không chỉ là một khái niệm lý thuyết mà còn có nhiều ứng dụng thực tế quan trọng trong khoa học và công nghệ.
- Ứng dụng trong y tế: Điện tích hạt nhân được sử dụng trong các thiết bị y tế như máy chụp X-quang và máy cắt lớp vi tính (CT scan) để tạo ra hình ảnh chi tiết của cơ thể con người.
- Năng lượng hạt nhân: Điện tích hạt nhân đóng vai trò quan trọng trong các phản ứng phân hạch và nhiệt hạch, là cơ sở của công nghệ năng lượng hạt nhân.
- Xác định cấu trúc vật chất: Trong nghiên cứu vật liệu, kỹ thuật nhiễu xạ tia X và neutron sử dụng điện tích hạt nhân để xác định cấu trúc của các tinh thể và phân tử.
Khái Niệm Liên Quan Đến Điện Tích
Trong quá trình nghiên cứu về điện tích, có một số khái niệm liên quan mà bạn cần nắm vững:
| Khái niệm | Mô tả |
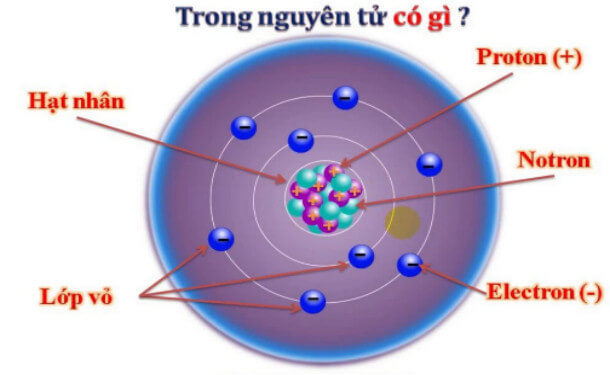
| Proton | Hạt mang điện tích dương, tồn tại trong hạt nhân của nguyên tử. |
| Electron | Hạt mang điện tích âm, chuyển động xung quanh hạt nhân nguyên tử. |
| Ion | Nguyên tử hoặc phân tử mang điện tích do mất hoặc nhận thêm electron. |
| Điện trường | Khu vực xung quanh một vật thể mang điện tích, nơi mà lực điện tác động lên các hạt mang điện khác. |
Với các thông tin trên, bạn đã có cái nhìn tổng quan về ký hiệu điện tích và tầm quan trọng của chúng trong các lĩnh vực khoa học và ứng dụng thực tiễn.

.png)
Ký Hiệu Điện Tích Trong Điện Học
Trong điện học, ký hiệu điện tích được dùng để mô tả lượng điện mà một vật thể có thể mang. Điện tích là một trong những khái niệm cơ bản nhất, được ký hiệu bằng chữ "q" hoặc "Q" trong các công thức và biểu đồ điện học.
Các ký hiệu điện tích có thể khác nhau tùy thuộc vào ngữ cảnh:
- q: Thường được dùng để biểu thị điện tích của một hạt hoặc một vật nhỏ trong các bài toán vật lý.
- Q: Dùng để biểu thị điện tích tổng cộng hoặc điện tích lớn hơn trong các hệ thống phức tạp.
Điện tích có thể là dương hoặc âm, tùy thuộc vào loại hạt hoặc vật thể:
- Điện tích dương (+): Được tạo ra khi một vật mất đi electron, ví dụ như ion dương trong hóa học.
- Điện tích âm (-): Được tạo ra khi một vật nhận thêm electron, ví dụ như ion âm trong hóa học.
Điện tích trong điện học được đo lường bằng đơn vị Coulomb (C), là một đơn vị SI và có công thức tính:
$$ Q = n \times e $$
Trong đó:
- Q: Điện tích tổng cộng (Coulomb)
- n: Số lượng electron hoặc proton
- e: Điện tích của một electron hoặc proton, có giá trị khoảng \(1.6 \times 10^{-19}\) Coulomb
Việc hiểu và sử dụng đúng các ký hiệu điện tích trong điện học là nền tảng quan trọng để nắm vững các nguyên lý điện học và áp dụng vào thực tế.
Ứng Dụng Của Điện Tích Trong Thực Tế
Điện tích là một yếu tố quan trọng và có nhiều ứng dụng thực tế trong đời sống hàng ngày cũng như trong công nghệ. Dưới đây là một số ứng dụng phổ biến của điện tích:
- Trong linh kiện điện tử: Điện tích được sử dụng để điều khiển dòng điện trong các linh kiện như tụ điện, transistor, và diode. Các linh kiện này là nền tảng của mọi thiết bị điện tử hiện đại, từ máy tính đến điện thoại di động.
- Trong hệ thống điện công nghiệp: Điện tích đóng vai trò trong việc lưu trữ và truyền tải năng lượng. Các hệ thống điện như máy phát điện, pin và hệ thống lưới điện đều dựa vào nguyên lý điện tích để hoạt động hiệu quả và an toàn.
- Trong công nghệ cảm biến: Điện tích được sử dụng trong các cảm biến đo lường và kiểm soát môi trường. Ví dụ, cảm biến điện dung sử dụng sự thay đổi điện tích để đo độ ẩm, áp suất hoặc vị trí của vật thể.
- Trong y học: Điện tích được ứng dụng trong các thiết bị y tế như máy tạo nhịp tim, máy đo nhịp tim và các thiết bị chẩn đoán hình ảnh. Điện tích giúp tạo ra các xung điện cần thiết để duy trì hoạt động bình thường của cơ thể.
- Trong công nghệ xử lý nước: Điện tích được sử dụng để loại bỏ tạp chất trong nước qua quá trình điện phân. Kỹ thuật này giúp sản xuất nước sạch và an toàn cho việc sử dụng.
- Trong đời sống hàng ngày: Điện tích có vai trò trong các hiện tượng như sét, tĩnh điện, và các hiện tượng điện từ khác. Việc hiểu rõ về điện tích giúp chúng ta giải thích và kiểm soát những hiện tượng này một cách hiệu quả.
Nhờ vào các ứng dụng đa dạng của điện tích, con người có thể tạo ra và cải tiến nhiều công nghệ hữu ích, đóng góp vào sự phát triển của xã hội hiện đại.

Công Thức Tính Điện Tích
Điện tích là đại lượng vật lý cơ bản được sử dụng để mô tả mức độ tích tụ điện trong một vật thể. Công thức tính điện tích dựa trên nhiều yếu tố khác nhau, và dưới đây là một số công thức phổ biến:
Công Thức Tính Điện Tích Từ Số Electron hoặc Proton
Khi biết số lượng electron hoặc proton trong một vật, ta có thể tính điện tích theo công thức:
$$ Q = n \times e $$
Trong đó:
- Q: Điện tích (Coulomb)
- n: Số lượng electron hoặc proton
- e: Điện tích của một electron hoặc proton, với giá trị xấp xỉ \(1.6 \times 10^{-19}\) Coulomb
Công Thức Tính Điện Tích Dựa Trên Điện Trường
Trong trường hợp điện trường được tạo ra bởi một điện tích điểm, công thức tính điện tích là:
$$ Q = E \times r^2 / k $$
Trong đó:
- Q: Điện tích (Coulomb)
- E: Cường độ điện trường (N/C hoặc V/m)
- r: Khoảng cách từ điện tích điểm đến điểm đo điện trường (mét)
- k: Hằng số Coulomb, với giá trị xấp xỉ \(8.99 \times 10^9 \, \text{N m}^2/\text{C}^2\)
Công Thức Tính Điện Tích Từ Cường Độ Dòng Điện
Điện tích có thể được tính từ cường độ dòng điện và thời gian theo công thức:
$$ Q = I \times t $$
Trong đó:
- Q: Điện tích (Coulomb)
- I: Cường độ dòng điện (Ampe)
- t: Thời gian dòng điện chạy qua (giây)
Những công thức trên là cơ sở để hiểu và tính toán điện tích trong nhiều ứng dụng thực tế và trong các bài toán vật lý.

Các Loại Điện Tích Trong Hóa Học
Trong hóa học, điện tích đóng vai trò quan trọng trong việc xác định tính chất và hành vi của các nguyên tử, ion, và phân tử. Điện tích có thể được chia thành nhiều loại khác nhau dựa trên bản chất và sự phân bố của nó. Dưới đây là một số loại điện tích phổ biến trong hóa học:
1. Điện Tích Dương (Cation)
Điện tích dương xuất hiện khi một nguyên tử mất đi một hoặc nhiều electron, khiến số lượng proton (điện tích dương) nhiều hơn số lượng electron (điện tích âm). Các cation thường gặp trong hóa học bao gồm:
- Na+: Ion natri
- Ca2+: Ion canxi
- Al3+: Ion nhôm
2. Điện Tích Âm (Anion)
Điện tích âm xuất hiện khi một nguyên tử nhận thêm một hoặc nhiều electron, khiến số lượng electron nhiều hơn số lượng proton. Các anion thường gặp trong hóa học bao gồm:
- Cl-: Ion clo
- O2-: Ion oxi
- SO42-: Ion sunfat
3. Điện Tích Trung Hòa (Nguyên Tử Trung Hòa)
Điện tích trung hòa xảy ra khi số lượng proton và electron trong một nguyên tử hoặc phân tử bằng nhau, dẫn đến tổng điện tích bằng 0. Trong trường hợp này, nguyên tử hoặc phân tử không có điện tích tổng, ví dụ:
- H2: Phân tử khí hydro
- O2: Phân tử khí oxi
- CH4: Phân tử metan
Các loại điện tích này đóng vai trò quan trọng trong việc hình thành liên kết hóa học và ảnh hưởng đến các phản ứng hóa học, từ đó quyết định tính chất hóa học của các chất.