Chủ đề theo chiều tăng dần của điện tích hạt nhân: Theo chiều tăng dần của điện tích hạt nhân là một nguyên tắc cơ bản trong hóa học, giúp giải thích cách sắp xếp các nguyên tố trong bảng tuần hoàn. Bài viết này sẽ giúp bạn hiểu rõ hơn về quy luật sắp xếp, sự biến đổi tính chất và ứng dụng thực tiễn trong nghiên cứu hóa học và đời sống.
Mục lục
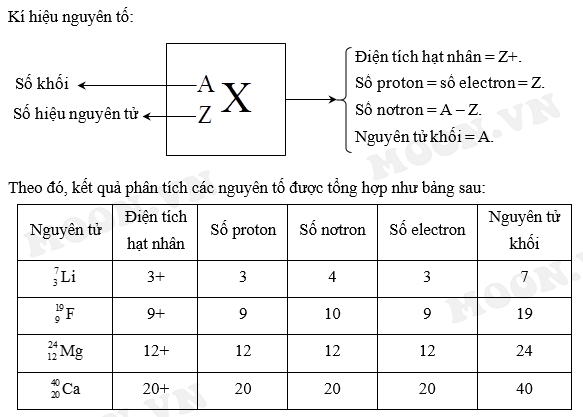
Theo Chiều Tăng Dần Của Điện Tích Hạt Nhân Trong Bảng Tuần Hoàn
Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân. Việc hiểu rõ sự biến đổi này giúp ta nhận biết được quy luật về tính chất hóa học của các nguyên tố.
1. Nguyên tắc sắp xếp các nguyên tố
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn dựa trên ba tiêu chí chính:
- Số điện tích hạt nhân (số proton) tăng dần từ trái sang phải trong một chu kỳ.
- Số lớp electron của nguyên tử tăng dần từ trên xuống dưới trong một nhóm.
- Các nguyên tố có cấu hình electron tương tự sẽ có tính chất hóa học gần giống nhau và được sắp xếp thành cùng một cột (nhóm).
2. Sự biến đổi tính chất của nguyên tố trong chu kỳ
Trong một chu kỳ, theo chiều tăng dần của điện tích hạt nhân, các tính chất sau có sự biến đổi:
- Độ âm điện tăng dần.
- Bán kính nguyên tử giảm dần.
- Tính kim loại giảm, trong khi tính phi kim tăng.
3. Sự biến đổi tính chất của nguyên tố trong nhóm
Trong một nhóm, từ trên xuống dưới, khi số lớp electron tăng lên, các tính chất thay đổi như sau:
- Bán kính nguyên tử tăng dần.
- Độ âm điện giảm dần.
- Tính kim loại tăng, tính phi kim giảm.
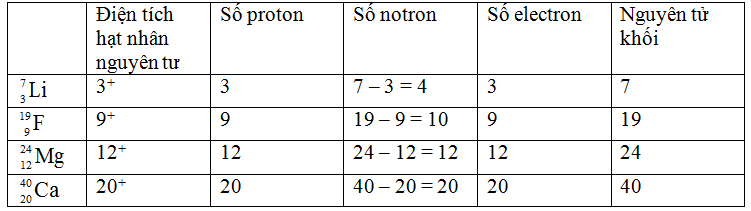
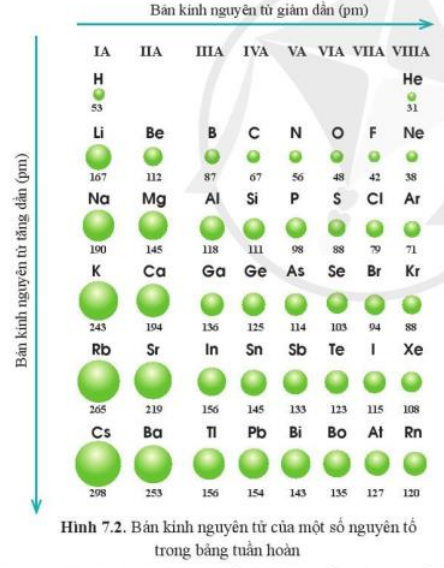
4. Ví dụ minh họa
Ví dụ, trong chu kỳ 2:
| Nguyên tố | Li | Be | B | C | N | O | F | Ne |
| Số proton | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Theo chiều tăng dần của điện tích hạt nhân từ Li đến Ne, độ âm điện tăng dần, tính kim loại giảm dần.
5. Quy luật liên quan đến nhóm
Trong nhóm IA, từ Li đến Cs, ta thấy tính kim loại tăng dần do bán kính nguyên tử tăng, làm giảm khả năng hút electron của hạt nhân đối với các lớp electron ngoài cùng.

.png)
1. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
Các nguyên tố trong bảng tuần hoàn được sắp xếp theo quy luật dựa trên điện tích hạt nhân và cấu hình electron của chúng. Điều này giúp thể hiện được mối liên hệ giữa số proton trong hạt nhân và tính chất hóa học của nguyên tố.
- Các nguyên tố được sắp xếp theo chiều tăng dần của số proton (điện tích hạt nhân) từ trái sang phải trong một chu kỳ.
- Trong một chu kỳ, số lớp electron không thay đổi, nhưng số proton tăng dần, dẫn đến sự thay đổi trong cấu trúc và tính chất của nguyên tố.
- Từ trên xuống dưới trong một nhóm, số lớp electron tăng lên, ảnh hưởng đến bán kính nguyên tử và các đặc tính hóa học khác.
Quy luật này giúp chúng ta dự đoán được sự biến đổi tuần hoàn của các tính chất hóa học, chẳng hạn như:
- Độ âm điện: tăng dần từ trái sang phải và giảm dần từ trên xuống dưới.
- Bán kính nguyên tử: giảm dần từ trái sang phải và tăng dần từ trên xuống dưới.
- Tính kim loại và phi kim: Tính kim loại giảm dần từ trái sang phải, trong khi tính phi kim tăng dần.
Sự sắp xếp theo quy luật này không chỉ thể hiện sự hài hòa giữa cấu trúc hạt nhân và electron, mà còn phản ánh được tính chất hóa học của từng nguyên tố một cách rõ ràng và nhất quán.
2. Sự biến đổi tính chất các nguyên tố theo chu kỳ
Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn diễn ra theo quy luật tuần hoàn khi đi từ trái sang phải trong một chu kỳ. Điều này có thể được giải thích dựa trên cấu hình electron và điện tích hạt nhân của các nguyên tố.
- Độ âm điện: Độ âm điện tăng dần từ trái sang phải trong một chu kỳ do điện tích hạt nhân tăng, dẫn đến lực hút của hạt nhân đối với các electron tăng lên.
- Bán kính nguyên tử: Bán kính nguyên tử giảm dần từ trái sang phải do lực hút giữa hạt nhân và electron ngoài cùng tăng lên, kéo các electron lại gần hơn.
- Năng lượng ion hóa: Năng lượng ion hóa tăng dần từ trái sang phải vì cần nhiều năng lượng hơn để loại bỏ electron do lực hút hạt nhân mạnh hơn.
- Tính kim loại và phi kim: Tính kim loại giảm dần khi đi từ trái sang phải, trong khi tính phi kim tăng dần. Điều này liên quan đến xu hướng nhường hoặc nhận electron của các nguyên tố.
Những biến đổi này cho thấy tính chất hóa học của các nguyên tố không phải là ngẫu nhiên mà tuân theo một quy luật cụ thể, giúp việc nghiên cứu và dự đoán tính chất hóa học của các nguyên tố trở nên rõ ràng và hiệu quả hơn.

3. Sự biến đổi tính chất các nguyên tố theo nhóm
Khi xét theo nhóm trong bảng tuần hoàn, các tính chất của nguyên tố cũng biến đổi theo quy luật nhất định, chủ yếu do sự thay đổi số lớp electron và khoảng cách giữa hạt nhân với các electron ngoài cùng.
- Bán kính nguyên tử: Bán kính nguyên tử tăng dần khi đi từ trên xuống dưới trong một nhóm. Nguyên nhân là do số lớp electron tăng lên, làm cho nguyên tử trở nên lớn hơn.
- Năng lượng ion hóa: Năng lượng ion hóa giảm dần từ trên xuống dưới. Lực hút giữa hạt nhân và các electron ngoài cùng yếu dần, khiến việc loại bỏ electron trở nên dễ dàng hơn.
- Độ âm điện: Độ âm điện giảm dần khi đi xuống trong một nhóm do khoảng cách từ hạt nhân đến electron ngoài cùng lớn hơn, làm giảm lực hút hạt nhân.
- Tính kim loại và phi kim: Tính kim loại tăng dần từ trên xuống dưới trong các nhóm kim loại kiềm và kiềm thổ, trong khi tính phi kim giảm dần trong các nhóm halogen.
Sự biến đổi này thể hiện rõ tính tuần hoàn và liên kết chặt chẽ giữa cấu trúc nguyên tử và tính chất hóa học của các nguyên tố, giúp chúng ta dễ dàng dự đoán đặc điểm và ứng dụng của chúng trong thực tiễn.
4. Ứng dụng của bảng tuần hoàn trong hóa học
Bảng tuần hoàn là công cụ mạnh mẽ trong hóa học, giúp dự đoán tính chất của các nguyên tố, phản ứng hóa học và thiết kế các hợp chất mới. Nhờ sự sắp xếp theo chiều tăng dần của điện tích hạt nhân, các nhà khoa học có thể sử dụng bảng tuần hoàn để dự đoán và nghiên cứu hóa học theo cách hiệu quả hơn.
- Dự đoán tính chất của nguyên tố: Bảng tuần hoàn cho phép xác định nhanh các tính chất vật lý và hóa học của một nguyên tố, dựa trên vị trí của nó trong bảng.
- Hướng dẫn điều chế và tổng hợp: Việc biết trước xu hướng phản ứng của các nguyên tố giúp thiết kế quá trình tổng hợp chất mới một cách tối ưu.
- Nghiên cứu mối quan hệ giữa các nguyên tố: Bảng tuần hoàn giúp hiểu rõ hơn về mối quan hệ tương hỗ giữa các nhóm và chu kỳ, từ đó rút ra những quy luật chung trong hóa học.
- Ứng dụng trong giáo dục: Bảng tuần hoàn là công cụ học tập quan trọng, giúp sinh viên và giáo viên hiểu rõ hơn về cấu trúc và tính chất của nguyên tố.
Nhờ vào tính ứng dụng rộng rãi, bảng tuần hoàn đã trở thành nền tảng cho nhiều tiến bộ trong nghiên cứu hóa học và công nghiệp, góp phần thúc đẩy phát triển khoa học và công nghệ.