Chủ đề điện tích ion là gì: Điện tích ion là một khái niệm cơ bản và quan trọng trong hóa học, liên quan đến cách các nguyên tử và phân tử tương tác với nhau. Bài viết này sẽ giúp bạn hiểu rõ về điện tích ion, cách hình thành, tính chất và vai trò của nó trong đời sống và công nghiệp.
Mục lục
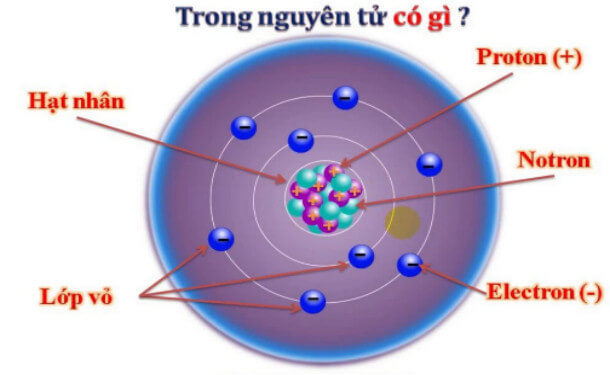
Điện Tích Ion Là Gì?
Điện tích ion là một khái niệm cơ bản trong hóa học và vật lý, dùng để chỉ lượng điện tích mà một ion mang. Ion là các nguyên tử hoặc nhóm nguyên tử bị mất hoặc nhận thêm electron, dẫn đến việc chúng mang điện tích dương hoặc âm.
1. Khái Niệm Ion
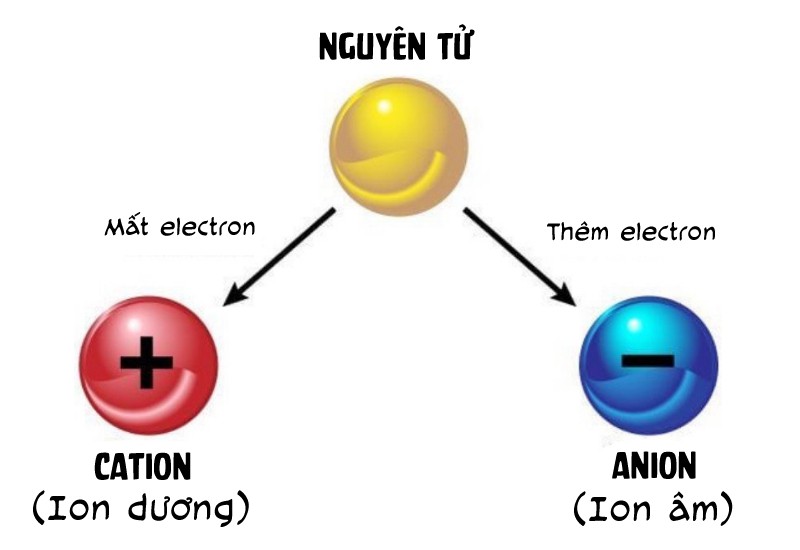
- Ion dương (cation): Là ion mang điện tích dương, hình thành khi một nguyên tử mất đi một hoặc nhiều electron. Ví dụ, Na+ là ion dương của natri sau khi mất đi một electron.
- Ion âm (anion): Là ion mang điện tích âm, hình thành khi một nguyên tử nhận thêm một hoặc nhiều electron. Ví dụ, Cl- là ion âm của clo sau khi nhận thêm một electron.
2. Quá Trình Hình Thành Ion
Ion được hình thành thông qua các quá trình nhường hoặc nhận electron giữa các nguyên tử. Khi nguyên tử kim loại nhường electron, nó trở thành ion dương. Ngược lại, khi nguyên tử phi kim nhận electron, nó trở thành ion âm.
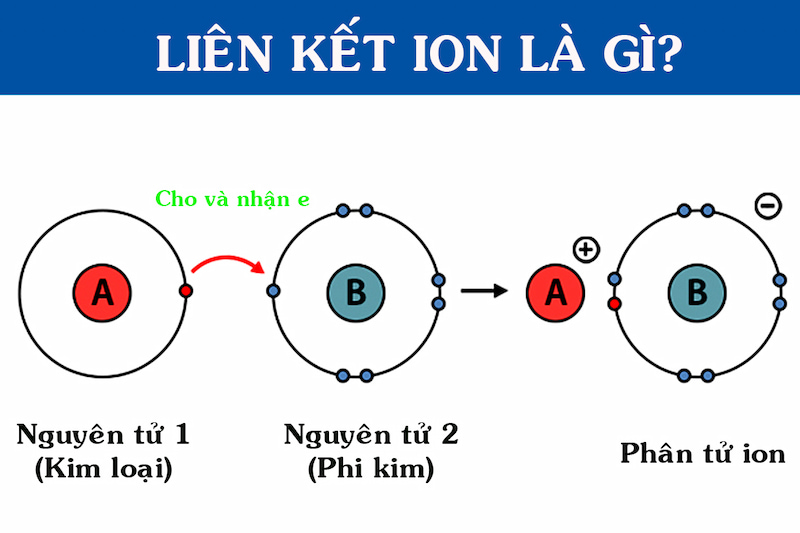
3. Liên Kết Ion
Liên kết ion là liên kết hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Ví dụ, trong phân tử NaCl, ion Na+ và Cl- liên kết với nhau nhờ lực hút tĩnh điện, tạo thành muối ăn.
4. Tinh Thể Ion
Tinh thể ion là các hợp chất ion ở trạng thái rắn, được tạo thành từ các ion liên kết với nhau bằng lực hút tĩnh điện. Những hợp chất này thường có nhiệt độ nóng chảy cao, khó bay hơi và dẫn điện khi tan trong nước.
5. Ứng Dụng Của Ion Trong Đời Sống
Ion có vai trò quan trọng trong nhiều lĩnh vực của đời sống, từ sinh học, y học đến công nghệ. Ví dụ, ion âm được cho là có lợi cho sức khỏe con người khi giúp cải thiện hô hấp, tuần hoàn máu và giảm stress.
6. Ví Dụ Thực Tế
- Muối ăn (NaCl): Là một hợp chất ion được tạo thành từ ion Na+ và Cl-.
- Canxi clorua (CaCl2): Là hợp chất ion quan trọng trong công nghiệp và y học.
7. Kết Luận
Điện tích ion và các khái niệm liên quan đến ion là những kiến thức cơ bản nhưng rất quan trọng trong hóa học, có ứng dụng rộng rãi trong cả đời sống hàng ngày và các ngành công nghiệp.

.png)
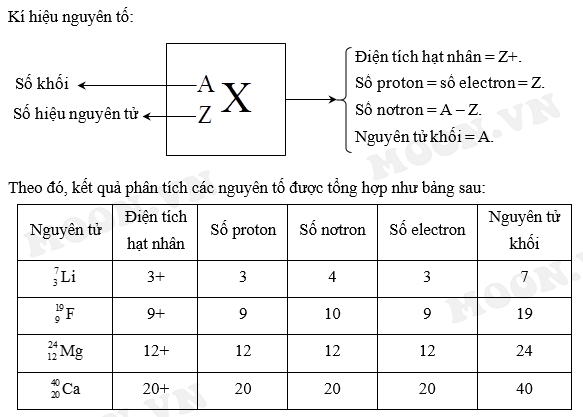
I. Khái Niệm Ion và Điện Tích Ion
Ion là các hạt mang điện tích, được hình thành khi nguyên tử hoặc nhóm nguyên tử mất hoặc nhận thêm electron. Tùy vào việc mất hay nhận electron mà ion có thể mang điện tích dương hoặc âm.
- Ion dương (cation): Là ion mang điện tích dương, hình thành khi nguyên tử mất đi một hoặc nhiều electron. Ví dụ, ion Na+ hình thành khi nguyên tử natri mất đi một electron.
- Ion âm (anion): Là ion mang điện tích âm, hình thành khi nguyên tử nhận thêm một hoặc nhiều electron. Ví dụ, ion Cl- hình thành khi nguyên tử clo nhận thêm một electron.
Điện tích ion là giá trị điện tích mà một ion mang. Giá trị này phụ thuộc vào số lượng electron mà ion đã mất hoặc nhận thêm.
Công thức tính điện tích ion được biểu diễn dưới dạng:
\[ \text{Điện tích ion} = \text{Số proton} - \text{Số electron} \]
Ví dụ, một ion Na+ có 11 proton và 10 electron, do đó điện tích của nó là +1. Tương tự, ion Cl- có 17 proton và 18 electron, do đó điện tích của nó là -1.
Tóm lại, ion và điện tích ion là những khái niệm cơ bản trong hóa học, giúp giải thích cách các nguyên tử và phân tử tương tác với nhau thông qua các quá trình trao đổi electron.
II. Cách Hình Thành Ion
Ion hình thành khi nguyên tử hoặc nhóm nguyên tử mất hoặc nhận thêm electron, làm thay đổi cân bằng điện tích giữa proton và electron. Quá trình này có thể diễn ra theo hai cách chính: nhường electron để tạo ion dương và nhận electron để tạo ion âm.
1. Quá Trình Nhường Electron và Hình Thành Ion Dương
Khi một nguyên tử mất đi một hoặc nhiều electron, nó sẽ trở thành ion dương (cation). Điều này xảy ra khi nguyên tử có số proton nhiều hơn số electron sau khi mất electron. Ví dụ, nguyên tử natri (Na) có thể mất một electron để trở thành ion Na+.
Phản ứng biểu diễn quá trình này:
\[ \text{Na} \rightarrow \text{Na}^{+} + \text{e}^{-} \]
- Khi nguyên tử mất electron, số lượng proton vẫn giữ nguyên, nhưng số lượng electron giảm, dẫn đến ion mang điện tích dương.
- Ion dương có xu hướng tham gia vào các phản ứng để tạo thành liên kết ion với các ion âm.
2. Quá Trình Nhận Electron và Hình Thành Ion Âm
Khi một nguyên tử nhận thêm một hoặc nhiều electron, nó sẽ trở thành ion âm (anion). Điều này xảy ra khi số electron nhiều hơn số proton. Ví dụ, nguyên tử clo (Cl) có thể nhận thêm một electron để trở thành ion Cl-.
Phản ứng biểu diễn quá trình này:
\[ \text{Cl} + \text{e}^{-} \rightarrow \text{Cl}^{-} \]
- Khi nguyên tử nhận thêm electron, số lượng proton vẫn giữ nguyên, nhưng số lượng electron tăng, dẫn đến ion mang điện tích âm.
- Ion âm cũng có xu hướng tham gia vào các phản ứng để tạo thành liên kết ion với các ion dương.
Quá trình hình thành ion là cơ sở để tạo nên các hợp chất ion, trong đó các ion dương và ion âm liên kết với nhau qua lực hút tĩnh điện, hình thành nên các hợp chất có cấu trúc bền vững.

III. Tính Chất Của Các Hợp Chất Ion
Các hợp chất ion là các chất được hình thành từ sự liên kết giữa các ion dương và ion âm, tạo thành cấu trúc tinh thể bền vững. Những hợp chất này có những tính chất đặc trưng quan trọng như sau:
1. Tính Chất Vật Lý
- Điểm nóng chảy và điểm sôi cao: Do lực hút tĩnh điện mạnh mẽ giữa các ion mang điện tích trái dấu, các hợp chất ion thường có điểm nóng chảy và điểm sôi rất cao.
- Trạng thái tồn tại: Ở điều kiện thường, các hợp chất ion thường tồn tại ở dạng rắn và có cấu trúc tinh thể đều đặn.
- Độ cứng: Các hợp chất ion có độ cứng cao nhưng dễ vỡ, do sự xê dịch của các lớp ion có thể làm mất cân bằng lực hút tĩnh điện.
2. Tính Chất Hóa Học
- Khả năng tan trong nước: Phần lớn các hợp chất ion có khả năng tan tốt trong nước. Khi tan, các ion trong hợp chất phân ly, dẫn đến sự tồn tại của các ion tự do trong dung dịch.
- Dẫn điện trong dung dịch: Khi các hợp chất ion tan trong nước, chúng tạo ra dung dịch dẫn điện nhờ sự di chuyển của các ion tự do. Tuy nhiên, ở trạng thái rắn, các hợp chất ion không dẫn điện do các ion không thể di chuyển tự do.
- Phản ứng hóa học: Các hợp chất ion dễ dàng tham gia vào các phản ứng hóa học, đặc biệt là phản ứng trao đổi ion trong dung dịch.
Tóm lại, các hợp chất ion có những tính chất vật lý và hóa học đặc trưng, liên quan chặt chẽ đến cấu trúc ion của chúng. Những tính chất này làm cho các hợp chất ion trở thành một phần quan trọng trong nhiều lĩnh vực, từ hóa học đến công nghệ và đời sống hàng ngày.
IV. Ứng Dụng của Ion và Điện Tích Ion
Ion và điện tích ion đóng vai trò quan trọng trong nhiều lĩnh vực khoa học và công nghệ, từ hóa học, y học đến các ứng dụng trong đời sống hàng ngày. Dưới đây là những ứng dụng tiêu biểu:
1. Trong Công Nghệ Hóa Học
- Sản xuất các hợp chất hóa học: Ion được sử dụng trong các phản ứng hóa học để tổng hợp nhiều hợp chất, đặc biệt là trong quá trình điện phân để tách và thu hồi kim loại từ quặng.
- Ứng dụng trong pin và ắc quy: Các ion đóng vai trò quan trọng trong việc dẫn điện trong các thiết bị lưu trữ năng lượng như pin và ắc quy. Chúng tạo ra dòng điện thông qua sự di chuyển của các ion giữa hai điện cực.
2. Trong Y Học và Sinh Học
- Điều trị bệnh: Ion như ion canxi và kali là thiết yếu cho hoạt động của tế bào và cơ thể con người. Chúng được sử dụng trong y học để điều chỉnh các chức năng sinh lý và điều trị nhiều loại bệnh lý.
- Chẩn đoán y học: Các thiết bị y tế như máy chụp X-quang và máy MRI sử dụng ion để tạo ra hình ảnh cơ thể, giúp chẩn đoán bệnh tật một cách chính xác.
3. Trong Công Nghệ Môi Trường
- Lọc nước: Các ion được sử dụng trong quá trình xử lý nước để loại bỏ các chất ô nhiễm. Công nghệ trao đổi ion giúp làm mềm nước và loại bỏ các ion kim loại nặng.
- Xử lý chất thải: Ion cũng được áp dụng trong việc phân hủy và trung hòa các chất thải nguy hại, góp phần bảo vệ môi trường.
4. Trong Các Ứng Dụng Khác
- Công nghiệp thực phẩm: Ion được sử dụng để bảo quản thực phẩm, đặc biệt là các loại muối ion như natri clorua (muối ăn) để ngăn chặn sự phát triển của vi khuẩn.
- Công nghệ điện tử: Trong lĩnh vực điện tử, ion được sử dụng để sản xuất các vật liệu bán dẫn và trong quá trình chế tạo vi mạch.
Nhờ những ứng dụng đa dạng và thiết thực, ion và điện tích ion không chỉ có ý nghĩa trong khoa học mà còn có tầm quan trọng lớn đối với cuộc sống hiện đại, góp phần cải thiện chất lượng cuộc sống và thúc đẩy sự phát triển công nghệ.

V. Ví Dụ Thực Tế về Ion và Điện Tích Ion
Ion và điện tích ion không chỉ tồn tại trong các phòng thí nghiệm mà còn có mặt trong nhiều hiện tượng và ứng dụng thực tế trong đời sống hàng ngày. Dưới đây là một số ví dụ cụ thể:
1. Nước Muối (NaCl)
Nước muối là một ví dụ điển hình về sự tồn tại của ion trong đời sống hàng ngày. Khi NaCl hòa tan trong nước, nó phân ly thành ion Na+ và Cl-. Những ion này giúp dẫn điện trong dung dịch, làm cho nước muối có khả năng dẫn điện.
2. Pin (Ắc Quy)
Pin là một ví dụ khác về ứng dụng của ion. Trong pin, các ion di chuyển giữa các điện cực để tạo ra dòng điện. Ví dụ, trong pin lithium-ion, các ion Li+ di chuyển từ cực âm sang cực dương qua dung dịch điện phân, tạo ra năng lượng điện cho các thiết bị.
3. Sữa Chua
Sữa chua chứa nhiều ion canxi (Ca2+), rất cần thiết cho sức khỏe xương và răng. Các ion này giúp cơ thể hấp thụ canxi một cách hiệu quả từ thực phẩm.
4. Lọc Nước Bằng Trao Đổi Ion
Trong quá trình lọc nước, phương pháp trao đổi ion được sử dụng để loại bỏ các ion không mong muốn như Ca2+ và Mg2+, giúp làm mềm nước. Những ion này được thay thế bằng các ion Na+, làm giảm độ cứng của nước.
5. Xà Phòng và Chất Tẩy Rửa
Các ion trong xà phòng và chất tẩy rửa (thường là ion Na+ hoặc K+) giúp làm sạch vết bẩn và dầu mỡ bằng cách phân tách chúng khỏi các bề mặt, giúp quá trình làm sạch hiệu quả hơn.
Những ví dụ trên minh họa cách mà ion và điện tích ion xuất hiện và ảnh hưởng đến cuộc sống hàng ngày, từ việc giữ gìn sức khỏe đến các ứng dụng công nghệ và môi trường.
XEM THÊM:
VI. Kết Luận
Điện tích ion đóng vai trò quan trọng trong nhiều khía cạnh của khoa học và cuộc sống hằng ngày. Các ion, thông qua điện tích của chúng, không chỉ tạo nên cấu trúc của nhiều hợp chất hóa học mà còn tham gia vào nhiều quá trình sinh học và công nghiệp.
Từ việc hình thành các hợp chất ion như muối ăn (NaCl) cho đến các ứng dụng trong công nghệ sản xuất, y học, và môi trường, điện tích ion ảnh hưởng mạnh mẽ đến các lĩnh vực khác nhau. Hiểu biết về điện tích ion giúp chúng ta nắm bắt được các quy trình hóa học cơ bản, từ đó áp dụng vào thực tiễn một cách hiệu quả.
Như vậy, nghiên cứu và ứng dụng điện tích ion không chỉ giới hạn trong phòng thí nghiệm mà còn góp phần quan trọng trong cải thiện chất lượng cuộc sống, từ sản xuất công nghiệp đến bảo vệ sức khỏe con người.